基于AQP9和线粒体细胞凋亡途径相关性探讨健脾活血祛湿方对体外培养H22肝癌细胞的影响*
2021-03-31杨孝芳施杨婉玲
李 嘉,高 玲,杨孝芳,张 军,蒲 翔,施杨婉玲
(贵州中医药大学,贵阳 550025)
肝癌是最常见的结缔组织瘤之一,每年在全世界范围有60万新增患者,其恶性程度仅次于胃癌和食道癌,在所有肿瘤相关性死因中排在第三位[1]。中药对减轻肝癌患者的临床症状,提高患者的生存质量和免疫功能、预防复发和转移都具有重要作用[2]。课题组以“毒损肝络”理论为用药的指导依据,自拟健脾活血祛湿方辅助治疗肝癌。前期研究结果显示,本方可显著提高肝硬化腹水大鼠线粒体水通道蛋白8、9(aquaporin8、9,AQP8、9)的表达,减轻线粒体水肿,同时促进线粒体ATP合成,改善肝功能,提高细胞色素C氧化酶(cytochrome c oxidase,COX)活性表达,促进肝癌细胞在线粒体途径的凋亡[3]。为进一步研究本方在治疗肝癌中可能存在的作用及作用机制,课题组进行体外培养H22肝癌细胞,在不同剂量健脾活血祛湿方的给药干预下,观察细胞的增殖抑制率、凋亡率及线粒体膜电位和AQP9的改变,为中医药治疗肝癌提供实验依据。
1 材料
1.1 细胞株
H22小鼠肝癌细胞,购自中南大学湘雅医学院细胞保存中心。
1.2 实验药物
健脾活血祛湿方组成:五爪龙30 g,白术30 g,白背叶根30 g,猪苓15 g,田基黄20 g,茜草15 g,土鳖虫10 g,砂仁5 g(后下),全部药材均购自贵阳中医学院第一附属医院药房,符合《中华人民共和国药典》2010年版要求。先加蒸馏水浸泡40 min,一煎加药材量的8倍水,沸腾后煎40 min;二煎加药材量的6倍水,沸腾后煎30 min过滤,2次所得滤液混合后干燥浓缩至15 ml,-20 ℃保存备用。以1 g/m1的原液,80 ℃水浴30 min,连续3 d灭活后,1000rpm离心10 min,-20 ℃保存备用。实验时以含2%DMEM培养液倍比稀释。
1.3 主要试剂
胎牛血清(美国Gibco公司);DMEM高糖培养基(美国Invitrogen公司);DMSO(美国Sigma公司);胰蛋白酶、PBS缓冲液、Trizol(均为Invitrogen公司);PrimeScriptTMRT reagent Kit withgDNAEraser,RR047 A、TBGreen© Premix Ex TaqTMII,RR820 A(均为TAKARA公司);氯仿、异丙醇、无水乙醇(均购自广州化学试剂厂);DEPC(上海生工(GAPDH抗体)(1∶4000稀释液),杭州三箭公司;AQP9抗体(1∶400稀释液),博世德公司(批号BA3619-2);Bax抗体(1∶1000稀释液),CST公司(批号5023);Bcl-2抗体(1∶1000稀释液),CST公司(批号2870);注射用环磷酰胺(cyclophosphamide, CTX):200 mg/瓶,德国Baxter Oncology Gmbh 公司。
1.4 仪器
超净工作台(苏州苏洁净化设备有限公司);倒置显微镜(美国thermo公司);低速离心机(湖南湘仪离心机仪器有限公司);酶标仪(美国thermo公司);ABI7500荧光定量PCR仪(美国Invitrogen公司);PCR仪(美国thermo公司);DYY7C型电泳仪电源(北京市六一仪器厂);TY-80B脱色摇床(江苏金坛市莱华仪器制造有限公司);电泳槽(Tanon公司);湿转转膜仪(Tanon公司)。
2 方法
2.1 细胞培养
从液氮中取出冻存的小鼠H22细胞,置于含有10%小牛血清的RPMI 1640培养基中,于37 ℃、5% CO2条件下连续培养孵育,倒置显微镜下观察细胞生长情况并用台盼兰染色,计算细胞存活率达95%以上,取对数生长期细胞,用PBS缓冲液清洗2遍,经胰蛋白酶消化后,加入4 mL DMEM高糖培养基终止胰蛋白酶的消化,充分均匀吹打,使H22细胞处于单个悬浮状态,对H22细胞进行细胞计数。
2.2 比色法(MTT)测定
H22细胞增殖抑制率将药物做系列倍比稀释成高浓度(200 mg/ml)、中浓度(100 mg/ml)、低浓度(50 mg/ml),同时设置不加任何药物的空白组和CTX组(20 mg/ml),在37 ℃、5% CO2条件下分别培养24 h、48 h、72 h、96 h,标记为A、B、C、D。取对数生长期细胞,将细胞密度调整为3×103/mL,接种在2块96孔板中。96孔板外围孔加入PBS缓冲液0.1 ml/孔,中间60孔每孔加入100μLDMEM高糖培养基,置于37 ℃,5%CO2条件下培养24 h。24 h后取孔板A每孔加入20 μL MTT,继续放于CO2培养箱中培养4 h,弃上清加入DMSO 150 μL,充分振荡溶解结晶,在490 nm波长酶联免疫检测仪测定各孔的吸光度(A),计算药物作用24 h细胞增殖抑制率。同理测出48 h、72 h、96 h孔板B、C、D各孔吸光度。增殖抑制率=(对照组A490-实验组A490)/对照组A490×100%。
2.3 Annexin V-FICT/PI检测
H22细胞凋亡率取对数生长期细胞,将细胞密度调整为6×104/mL接种在6孔板中,每孔2 mL,置于37 ℃、5%CO2条件下培养24 h,胰蛋白酶消化细胞,终止消化后离心收集2×104个细胞,双蒸水稀释5×Binding Buffer为1×工作液,取500 μL 1×Binding Buffer重悬细胞。每个流式管加入5 μL Annexin V-FICT和10 μL PI,避光静置5 min。通过FICT检测通道(FLI)检测Annexin V-FICT(Ex=488 nm;Em=530 nm),通过PE检测通道检测PI(FL2)。
2.4 逆转录-聚合酶链反应(RT-PCR)检测
表1示,H22细胞AQP9的表达细胞加1 ml Trizol提取总RNA,室温放置5 min,加入200 μL氯仿,颠倒混匀后室温放置15 min,4℃ 12000 g离心15 min,吸取上层水相,至另一离心管中,加入0.5 ml异丙醇混匀,室温放置5~10 min,4℃ 12000 g离心10 min,弃上清,RNA沉于管底,加入1 ml 75%乙醇,温和振荡离心管,洗涤沉淀,4 ℃ 8000 g离心5 min,尽量弃上清,室温晾干或真空干燥5~10 min,加入50 μL DEPC处理过的H2O溶解并测量RNA浓度。从-80 ℃冰箱中取出样品RNA 4 ℃下解冻,然后在 0.2 ml PCR 管中配制反应溶液。

表1 引物设计
反应体系:DNA 模板2 μL,PCR Forward Primer(10 μM)0.4 μL,PCR Reverse Primer(10 μM)0.4 μL,SYBR Premix Ex Taq II(Tli RNaseH Plus) (2×)10 μL,ROX Reference Dye II(50×)0.4 μL,dH2O Up to 20 μL。反转录条件:37 ℃ 15 min;85 ℃ 5sec4℃。将PCR管置于定量PCR仪中进行反应,反应条件为:95 ℃,30 s;95 ℃,3s;60 ℃,30 s,40 Reps,Melt Curve Stage。使用2^-ΔΔCт计算相对mRNA含量,ΔCт=Cт(目的基因)—Cт(管家基因)GAPDH,ΔCт=ΔCт(各用药组)—ΔCт(空白组),2^-ΔΔCт表示各用药组目的基因mRNA的含量相对空白组所改变的倍数。
2.5 免疫印迹法(Western Blotting,WB)检测
H22细胞AQP9、B细胞淋巴瘤-2 (B-cell lymphoma-2, Bcl-2)、Bcl-2相关X蛋白(Bcl-2 Associated X protein, Bax)的表达低温提取蛋白,蛋白定量,加入含2-ME(巯基乙醇,强还原剂)的5×上样缓冲液(1∶50)100 ℃变性5 min,12%的SDS-PAGE凝胶电泳、转膜,用5%的脱脂奶粉于摇床上封闭1 h。一抗孵育:取出封闭好的PVDF膜,用TBST漂洗,根据目的蛋白分子量大小与内参剪开,放入相应稀释好的一抗中孵育,4 ℃过夜。二抗孵育:第2天回收一抗,PVDF膜用TBST洗5遍,于摇床上进行洗涤,每次5 min。洗涤结束后,开始孵育二抗,二抗稀释比例为1∶6000,摇床上室温孵育50 min。用TBST洗膜5次,每次5 min,预先配好显影液、定影液、ECL发光液,每张膜上加200-300ulECL液进行曝光。
2.6 共聚焦显微镜技术观察
JC-1法检测细胞线粒体膜电位,取制备好的线粒体混悬液使用流式细胞仪按JC-1法检测。取适量JC-1(200×),按照每50 μL JC-1(200×)加入8 mL超纯水比例稀释JC-1。剧烈震荡充分溶解并混匀JC-1,然后再加入2 mL JC-1染色缓冲液(5×),混匀后把试剂盒中提供的CCCP(10mM)推荐按照1∶1000的比例加入到细胞培养液中,稀释至10 μM,处理细胞20 min,共振聚焦显微镜观察。
2.7 统计学方法
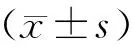
3 结果
3.1 MTT法测定H22细胞增殖抑制率
图1示,与空白组比较,CTX组在48 h、72 h和96 h对小鼠H22肝癌细胞的抑瘤率明显升高(P<0.05);与CTX组比较,健脾活血祛湿方各剂量组的抑瘤率呈时间/剂量依赖性增高(P<0.05),其中高剂量组在96 h的抑瘤率达最高。
注:与空白组比较:*P<0.05;与CTX组比较:△P<0.05
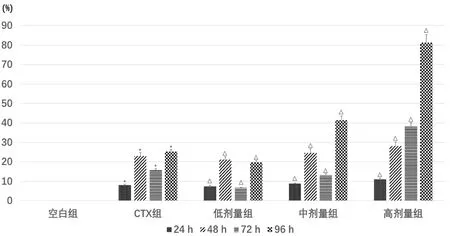
3.2 Annexin V-FICT/PI检测H22细胞凋亡率
图2示,Q2-UL表达晚期凋亡群体,Q2-UR表达中晚期凋亡群体,Q2-LL表达未凋亡群体,Q2-LR表达早期凋亡群体,图中箭头所指部分区域面积表示整体凋亡率。图2表2示,与空白组比较,CTX组的凋亡率明显增加(P<0.05);与CTX组比较,健脾活血祛湿方各剂量组凋亡率均明显增加(P<0.05),其中高剂量组表达显著(P<0.05)。

图2 Annexin V-FITC/PI检测H22肝癌细胞凋亡

表2 Annexin V-FITC/PI检测H22肝癌细胞凋亡比较
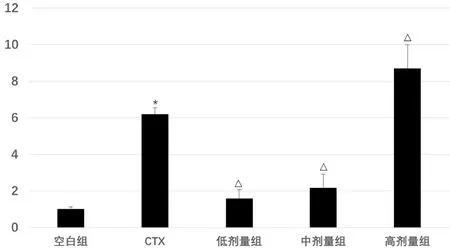
3.3 RT-PCR检测H22细胞AQP9的表达
图3示,与空白组比较,CTX组的AQP9mRNA转录水平明显增高(P<0.05);与CTX组比较,健脾活血祛湿方高剂量组的AQP9mRNA转录水平明显增高(P<0.05),中、低剂量组的AQP9mRNA转录水平明显下降(P<0.05),各剂量组呈剂量依赖性增高(P<0.05)。
注:与空白组比较:*P<0.05;与CTX组比较:△P<0.05
3.4 WB法检测H22细胞AQP9、Bax、Bcl-2的表达
图4、5示,与空白组比较,CTX组的AQP9、Bax、Bcl-2蛋白表达水平均有显著增高(P<0.05);与CTX组比较,健脾活血祛湿方各组AQP9、Bax蛋白表达水平呈剂量依赖性增高(P<0.05),Bcl-2蛋白表达呈剂量依赖性下降(P<0.05)。
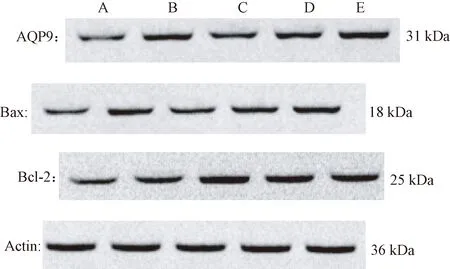
注:A.空白组; B.CTX组;C.低剂量组; D.中剂量组;E.高剂量组
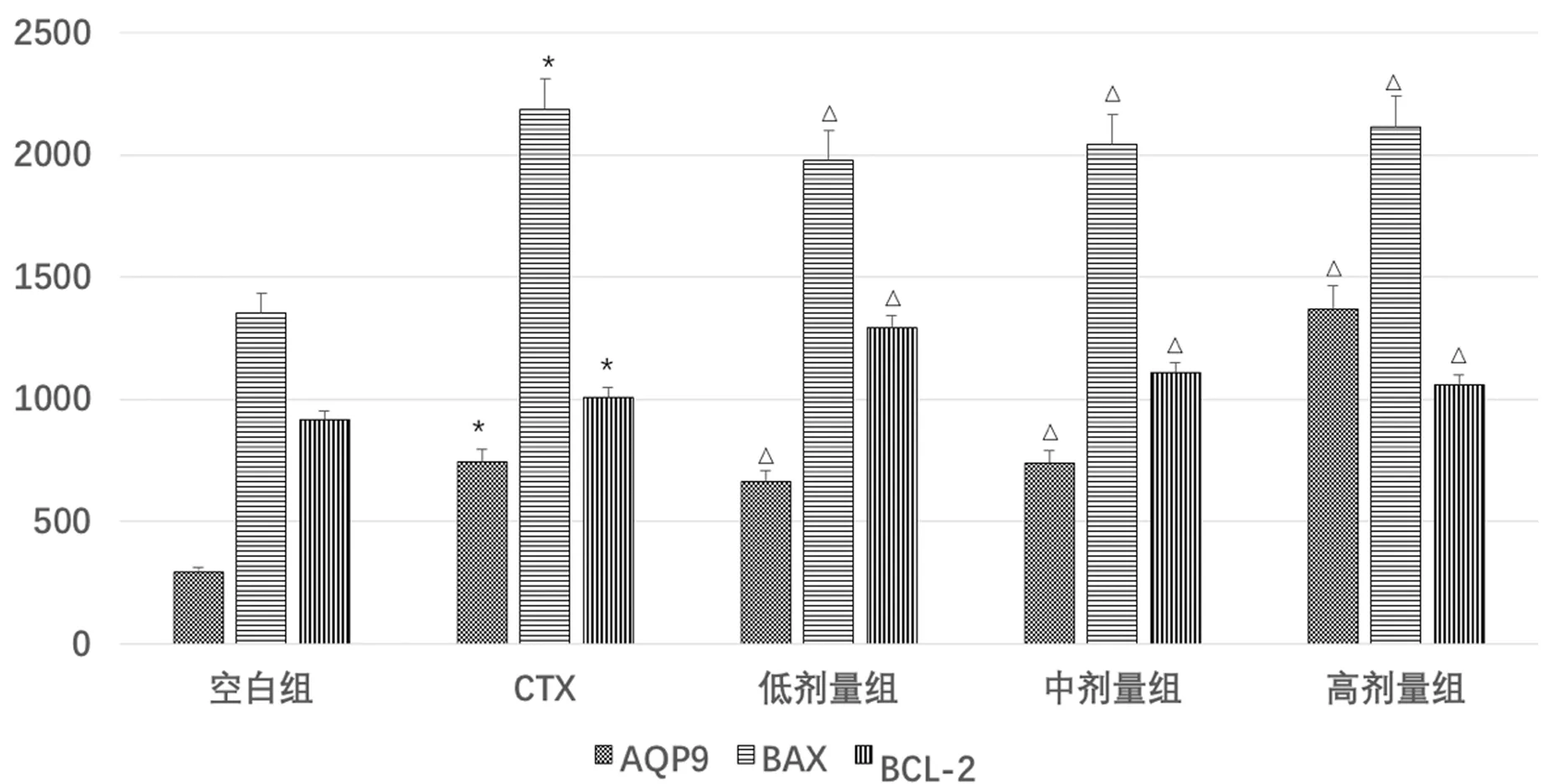
注:与空白组比较:*P<0.05;与CTX组比较:△P<0.05
3.5 共聚焦显微镜观察
JC-1法检测细胞线粒体膜电位:红色荧光表示细胞线粒体膜电位较高,绿色荧光表示细胞线粒体膜电位较低。图6示,空白组Merge无明显绿色荧光细胞显示,以红色荧光为主要表达(箭头所示);与空白组比较,CTX组Merge显示绿色荧光增多(箭头所示),提示线粒体膜电位有明显降低;与CTX组比较,健脾活血祛湿方低、中剂量组Merge显示绿色荧光变浅(箭头所示),高剂量组Merge主要表达绿色荧光且渐强(箭头所示),提示健脾活血祛湿方可显著降低线粒体膜电位,促进细胞凋亡。
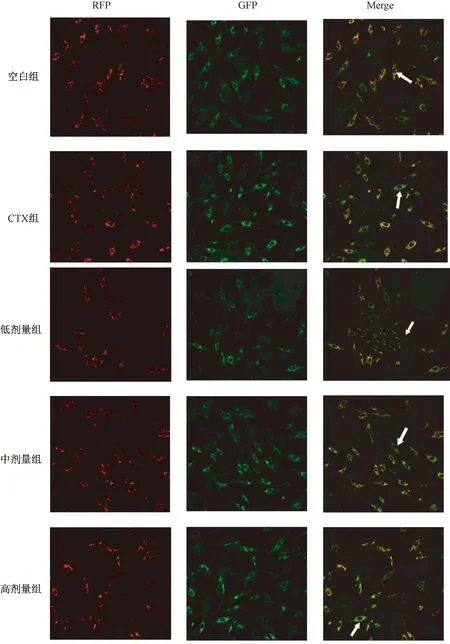
图6 共聚焦显微镜观察JC-1检测细胞线粒体膜电位(DAB×200)
4 讨论
肝癌属于中医学“肝积”“积聚”“癥瘕”等范畴,一般认为由于情志不畅、饮食劳倦、寒邪侵袭以及久病不愈、耗气伤血等因素影响脏腑气机异常变化,络脉郁滞不通、津血互换失常、痰湿血瘀凝滞脉络而终成本病[4]。肝癌属于本虚标实之证。络病学认为“毒损肝络”是肝癌形成的基本病理过程,其基础理论认为毒瘀作祟阻滞于肝络出现络虚、毒侵,而化毒为害则是络病迁延和深化的关键所在,此时的疾病处于正虚邪实、病势胶着状态。课题组根据此理论以健脾活血祛湿方辅助治疗肝癌。本方以五爪龙、白术为君,共奏健脾益气、补益肝络、化湿行水之功;以田基黄、猪苓、白背叶根三药为臣,以达健脾通络、清热利水之效;土鳖虫、茜根活血化瘀、通络为佐,砂仁调理脾胃、辛温化湿为使,达到利湿而不伤脾胃之效。全方配伍严谨,药味精炼,共奏健脾、通络、祛湿之功。现代药理学实验证实,五爪龙具有良好的抗病毒、抑制肿瘤、免疫调节等作用;白术具有良好的保肝利胆作用,常用于治疗肝硬化腹水、消癥积;白背叶根具有良好的保肝利胆、抗纤维化作用;田基黄具有保肝护肝、抗病毒、增强免疫等作用;猪苓、茜根同样具有良好的保肝护肝作用。课题组前期研究结果表明, 健脾活血祛湿方能缓解肝细胞线粒体损伤,改善肝线粒体代谢功能,并具有良好的保肝作用。课题组推测其机制可能是通过激发线粒体细胞凋亡途径,促进肝脏坏损细胞的早期凋亡。同时本研究结果也提示,健脾活血祛湿方各剂量组可呈时间/剂量依赖性地抑制肿瘤细胞生长。
AQP是一种广泛存在于细胞膜上的水通透性蛋白,是近年在肿瘤分子生物学领域内研究的一个热点。目前共发现有13个成员(命名为AQP0-12),主要介导肝癌细胞凋亡时水的内外膜运动。肝细胞上有多种AQPs且每种表达数量各异,其中AQP9是最重要的一种[5]。一些水通道蛋白在肿瘤中异常表达,并参与肿瘤的凋亡、增殖、侵袭及转移[6]。研究证实,AQP9表达于正常肝脏,在肝癌细胞中表达下降,使得肝癌细胞对渗透压反应和对凋亡的刺激性下降,从而促进肿瘤细胞增殖[7];AQP9在肝脏肿瘤细胞中比正常肝细胞表达显著减少,离体肝脏肿瘤细胞质膜的水通透性极低,对凋亡诱导信号反应迟钝,而正常肝细胞反应迅速。本研究表明,健脾活血祛湿方各剂量组的AQP9表达均呈剂量依赖性升高,课题组推测肝癌细胞凋亡可能是因为高表达的AQP9增加了肝癌细胞的通透性,促进细胞内外水代谢的运转,线粒体基质的渗透压升高,激活相关凋亡因子,引起半胱氨酸天冬氨酸蛋白酶级联反应(cysteinyl aspartate specific proteinase, Caspase),最终导致细胞核皱缩,核染色凝缩和核碎裂等现象。同时Annexin V-FICT/PI结果也提示,健脾活血祛湿方可呈剂量依赖性地促进细胞凋亡。
线粒体释放凋亡酶激活因子诱导Caspase家族产生级联反应,导致癌细胞的不可逆凋亡,这一过程在肝癌细胞凋亡的发生发展过程中发挥着重要作用[8]。线粒体细胞凋亡途径是三大经典凋亡途径的中心途径,以线粒体膜电位下降为标志,引起相关凋亡蛋白Bax、Bcl-2与一些通道蛋白PTP、AQP等变位,形成调亡小体导致凋亡。具体途径可表现为细胞受外界因素损伤刺激引起线粒体膜电位下降,ATP合成降低,胞质Ca2+升高以及细胞内活性氧种类(reactive oxygenspecies, ROS)的增加,使腺苷酸转运体(adenine nucleotide tranporter, ANT)的构象改变,进而导致PT孔开放。继而ATm及内膜腺苷转位酶(APH)崩解,呼吸链解偶联,线粒体基质的渗透压升高、内膜肿胀,膜内外形成渗透梯度,水通道蛋白迅速有选择性地将水排出,使细胞凋亡性容积减小(apoptotic volume decrease, AVD)[9-10],导致细胞水分丢失。同时伴随线粒体膜间隙的细胞色素c(cytochrome c, Cyt-C)、Smac/DIABLO、细胞凋亡诱导因子(apoptosis induced factor, AIF)、核酸内切酶G(endonucleaseG, EndoG)、Bcl-2蛋白家族等的释放,通过caspase级联反应引起细胞凋亡[11]。本研究发现,健脾活血祛湿方高剂量组细胞线粒体膜电位有下降并出现核皱缩,细胞呈现凋亡趋势;同时Western Blot检测结果也提示,健脾活血祛湿方促进AQP9、Bax表达增高、Bcl-2表达降低,增加促凋亡Bax与抗凋亡Bcl-2比值;Annexin V-FICT/PI结果也提示,健脾活血祛湿方可呈剂量依赖性地增高肝癌细胞凋亡率。
随着对AQP9的进一步研究,尤其针对其在正常肝细胞和肝癌细胞的显著差异表达,课题组自拟健脾活血祛湿方以研究该方基于AQP9促肝癌细胞凋亡的可能性。实验结果均提示,健脾活血祛湿方能够通过线粒体依赖途径触发肝癌细胞凋亡,这可能与AQP9具有一定相关性,但是否直接调控AQP9表达还需后续实验的深入研究。
