氟西汀对抑郁模型大鼠肠道菌群代谢多样性的影响*
2021-03-31蔡萧君陆振华颉彦鹏吴圆圆
李 宇 蔡萧君# 陆振华 颉彦鹏 王 涛 王 钦 吴圆圆
黑龙江省中医医院内分泌科1(150036) 消化内科2
抑郁症是临床常见的精神心理性疾病之一[1],已成为全球非正常死亡和致残的主要原因之一[2]。目前选择性5-羟色胺再摄取抑制剂(SSRI)仍为抑郁症的一线用药,其中氟西汀因其神经保护特性、抗炎、抗肿瘤[3]效果而广为人知,但其对肠道微生物的潜在作用迄今被低估。Zheng等[4]在无菌小鼠肠道内定植抑郁症的患者肠道微生物而建立的人源化小鼠可诱导抑郁症表型;Hsiao等[5]的研究发现,脆弱拟杆菌可通过改变肠黏膜通透性影响小鼠抑郁相关行为的发生。而抗抑郁药物对肠道菌群的调控机制目前尚不明确。本研究采用Biolog-ECO技术[6],结合《保健食品检验与评价技术规范》判定标准[7],选取6种常见菌属进行选择性培养,旨在探讨SSRI类抗抑郁药氟西汀对抑郁模型大鼠肠道菌群结构和代谢多样性的影响,从而为阐明其抗抑郁机制提供科学依据。
材料与方法
一、实验动物与主要试剂
8周龄SPF级SD雄性大鼠30只,体质量200~220 g,购自哈尔滨医科大学实验动物学部。于清洁级动物实验室饲养1周,环境温度21 ℃,相对湿度55%,12 h明暗交替,自由摄食饮水。盐酸氟西汀分散片购自法国礼来公司。
二、实验方法
1. 动物分组和模型建立:适应性饲养1周后,将30只大鼠随机分为空白组(n=10)、模型组(n=10)、氟西汀组(n=10)。模型组和氟西汀组均接受连续6周的慢性不可预知温和应激(CUMS),包括以下7种[8]:①电击足底1 min;②4 ℃冰水游泳5 min;③行为束缚2 h;④夹尾1 min;⑤禁食24 h;⑥禁水24 h;⑦夜间光照12 h。根据随机数字法每天定时随机选择1种刺激方法处理大鼠。每只大鼠单独1笼,每笼之间用不透光挡板遮挡。
2. 模型验证和药物干预:造模6周后,氟西汀组给予盐酸氟西汀分散片3.17 mg·kg-1·d-1灌胃,空白组和模型组给予6.3 mg·kg-1·d-1蒸馏水灌胃。连续灌胃8周后,进行行为学实验评估,包括悬尾实验、强迫游泳实验和旷场实验[9]。
3. 粪便收集和处理:将大鼠尾部提起固定,轻压下腹部,将新鲜粪便收集于无菌EP管中。4 ℃运回实验室,无菌条件下称取1 g粪便样品,加入10 mL 0.9% NaCl溶液,涡旋混匀,1 000 r/min离心5 min,去除食物残渣,取上清液,稀释为浓度10-2~10-5g/mL菌悬液,-20 ℃保存备用。取10-3g/mL菌悬液均匀涂抹于选择性培养基表层,倒置后恒温培养,采用稀释平板菌落计数法统计数量。8通道移液器吸取150 μL浓度为10-3g/mL的菌悬液至Biolog-ECO微平板,接种后放入37 °C恒温厌氧箱培养。运用Biolog系统每间隔24 h进行读数测定,检测碳源代谢过程中颜色和吸光度变化。平均颜色变化率(AWCD)表征微生物群落对单一碳源的利用能力和代谢总体活性。聚类分析对微平板中具有相同代谢特征的碳源进行亲疏度判别和重新分类,比较不同组别大鼠肠道菌群碳源代谢的差异。主成分分析使变量简化降维,对吸光度相关矩阵进行线性变换,提取对组间差异贡献大的因子。
三、统计学分析
结 果
一、大鼠行为学变化
与空白组相比,模型组大鼠悬尾挣扎时间、自主游泳时间和旷场内移动总距离显著减少(P<0.05);氟西汀组大鼠悬尾挣扎时间、自主游泳时间和移动总距离较模型组显著增加(P<0.05;图1)。
二、大鼠肠道6种常见菌属丰度变化
与空白组相比,模型组大鼠肠道内脆弱拟杆菌、肠球菌、肠杆菌和产气荚膜梭菌数量显著增加(P<0.05),双歧杆菌、乳杆菌数量显著减少(P<0.05)。与模型组相比,氟西汀组大鼠肠道内脆弱拟杆菌、肠球菌、肠杆菌和产气荚膜梭菌数量显著降低(P<0.05),双歧杆菌数量显著增加(P<0.05),乳杆菌数量无明显差异。与空白组相比,氟西汀组大鼠肠道内脆弱拟杆菌、双歧杆菌、乳杆菌数量显著降低(P<0.05),肠杆菌数量显著增加(P<0.05;图2)。
三、大鼠AWCD值和多样性指数变化
厌氧培养72 h内,各组AWCD值均随培养时间延长而逐渐增加,表明肠道微生物群的总体代谢活性随培养时间延长而逐渐增加。培养72 h后,各组AWCD值逐渐趋于平稳。模型组大鼠Shannon指数、Shannon均匀度、Simpson指数和Mclntosh指数均显著低于空白组(P<0.01);与模型组相比,氟西汀组大鼠Shannon指数和Mclntosh指数明显升高(P<0.01),而Shannon均匀度和Simpson指数无明显差异(图3)。
四、大鼠肠道菌群代谢聚类分析
当聚类距离≤5时,空白组和氟西汀组的碳源被聚为4类,模型组的碳源被聚为10类。说明 CUMS诱导的大鼠肠道微生物对碳源的利用比较分散,氟西汀治疗后,碳源利用相对比较集中,接近于空白组。空白组和氟西汀组中糖类D-半乳糖酸γ内酯、D,L-α-磷酸甘油、D-甘露醇和氨基酸类L-天冬酰胺酸、L-丝氨酸、L-苯基丙氨酸均被聚为一类,而在模型组中这些碳源被聚在不同的类别中,空白组中羧酸类D-苹果酸单独被聚为一类,氟西汀组中糖类D,L-α-磷酸甘油和羧酸类D-苹果酸、衣康酸、γ-羟基丁酸被聚为一类,说明氟西汀可使大鼠肠道微生物对D,L-α-磷酸甘油、D-苹果酸的利用发生变化(图4)。
五、大鼠肠道菌群代谢主成分分析
主成分分析结果显示,空白组、模型组、氟西汀组大鼠中成分1的方差贡献率分别为84.69%、68.61%、84.71%(图5)。
分析载荷图中3组大鼠肠道微生物对31种碳源的代谢特点,空白组、模型组和氟西汀组中PC1在I-赤藻糖醇、N-乙酰基-D-葡萄胺、D-纤维二糖等糖类碳源和L-苯基丙氨酸、L-丝氨酸、甘氨酸-L-谷氨酸等氨基酸类碳源上均有较高载荷,说明这两类碳源是大鼠肠道微生物代谢的必需碳源。模型组和氟西汀组中PC1在衣康酸等羧酸类碳源均有较高载荷,这可能与CUMS造模有关。与空白组相比,模型组增加了苯乙基胺、腐胺等胺类碳源,氟西汀组增加了α-环式糊精、G-肝糖等聚合物类碳源,说明氟西汀能提高大鼠肠道微生物对复杂大分子物质的利用能力。
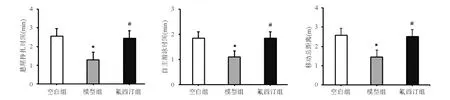
A:悬尾实验;B:强迫游泳实验;C:旷场实验

*与空白组比较,P<0.05;#与模型组比较,P<0.05
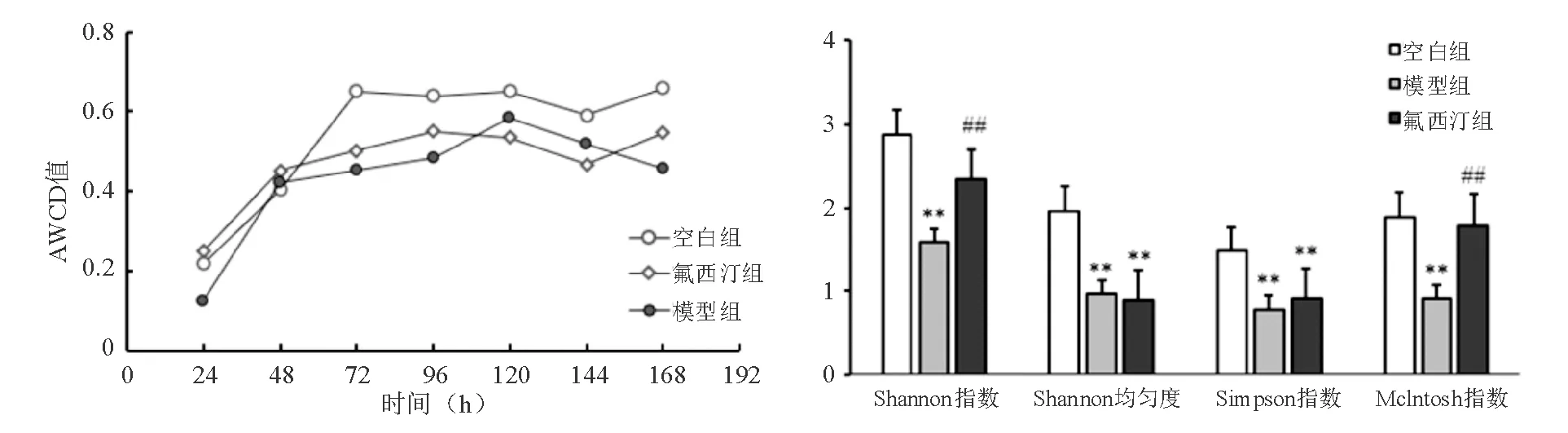
**与空白组比较,P<0.01;##与模型组比较,P<0.01

图4 大鼠肠道菌群代谢聚类分析
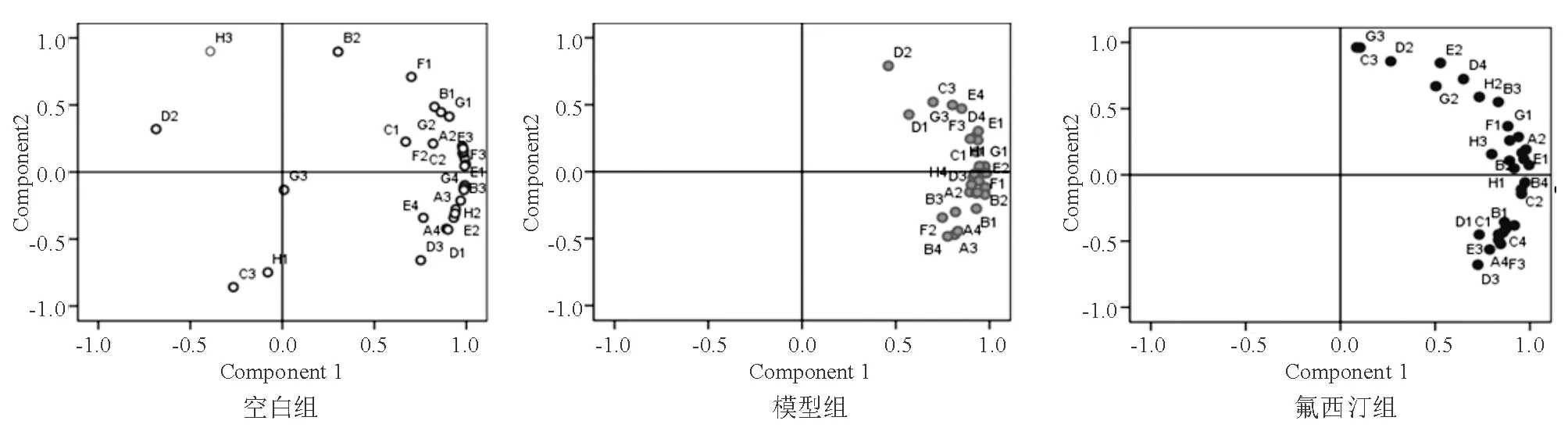
图5 大鼠肠道菌群代谢主成分分析
空白组中PC2在4-羟基苯甲酸、D-苹果酸等碳源上有较高的载荷,表明这些碳源对PC2贡献率较大;模型组中PC2在葡萄糖-1-磷酸盐、D-甘露醇、甘氨酸-L-谷氨酸、D,L-α-磷酸甘油等碳源上有较高的载荷;氟西汀组中PC2在4-羟基苯甲酸等碳源上有较高的载荷。D,L-α-磷酸甘油、D-半乳糖醛酸等糖类碳源在空白组和氟西汀组中对PC1贡献率较大,在模型组中对PC2贡献率较大。衣康酸等羧酸类和L-精氨酸等氨基酸类碳源在空白组和氟西汀组中对PC2贡献率较大,而在模型组中对PC2贡献率不大。
讨 论
抑郁症的发病机制非常复杂,包括生化、遗传、免疫、神经内分泌、心理社会环境等多种因素,近年研究发现,微生物-肠-脑轴在抑郁症等神经精神疾病中起有重要作用。中枢神经系统(CNS)、肠神经系统(ENS)、植物神经系统(ANS)和下丘脑-垂体-肾上腺(HPA)轴共同形成了微生物-肠-脑轴双向信号通路[10],使大脑能够对肠嗜铬细胞、免疫细胞、神经胶质细胞和Cajal间质细胞等[11-12]效应细胞的功能产生影响,肠道微生物又可通过肠-脑轴神经通路、神经内分泌-HPA轴途径、肠道免疫系统、合成神经递质、肠黏膜屏障、血脑屏障等途径影响大脑情感和认知行为[13-14]。
Biolog-ECO微平板鉴定和变性梯度凝胶电泳(DGGE)技术是目前微生物研究的两种重要方法。DGGE技术不依赖传统微生物培养,可基于PCR结果直接表征微生物遗传特征,菌种分辨率高,但仅能分离较小DNA片段,且一个条带可能代表多个菌种或同一菌种可能产生不同条带[15]。Biolog-ECO微平板技术无需分离纯种微生物,可通过碳源氧化快速检测微生物群落结构和多样性,尤其适用于快速生长型菌落,可最大限度保留微生物原有代谢特征,可重复性高,但碳源底物易受湿度、pH值等环境因素的影响[16]。
微生物Shannon指数可评估肠道微生物群落整体丰富度,Shannon均匀度是在菌群丰富度基础上衡量微生物个体分布的均匀度,Simpson多样性指数和Mclntosh指数均表示多样性测度,表征某些常见菌落的优势度和均匀度。本研究结果显示,氟西汀组大鼠悬尾挣扎时间、自主游泳时间和移动总距离较模型组显著增加(P<0.05),这与Yan等[17]的实验结果一致。Biolog-ECO结果显示模型大鼠肠道微生物的碳源利用能力和总体代谢活性发生显著变化,空白组大鼠AWCD值最大,表示其代谢总体活性最强,氟西汀可调节模型大鼠肠道菌群的整体代谢功能趋于正常。氟西汀还可上调模型大鼠Shannon指数和Mclntosh指数,而对整体均匀度和常见菌种优势度无明显调节作用。聚类和主成分分析显示,氟西汀干预后碳源利用相对集中,对聚合物类复杂大分子的利用增加,D,L-α-磷酸甘油和D-苹果酸代谢发生变化。D,L-α-磷酸甘油和D-苹果酸是连接胞质糖酵解与线粒体氧化磷酸化的重要环节和穿梭机制,由于线粒体内膜具有严格选择通透性,糖酵解产生的还原型烟酰胺腺嘌呤二核苷酸磷酸(NADPH)不能进入线粒体内膜,需经D,L-α-磷酸甘油和D-苹果酸转移还原当量才能进入线粒体呼吸链进行氧化供能[18]。说明氟西汀可通过调控糖酵解和线粒体氧化磷酸化途径影响大鼠肠道菌群代谢活性。
SSRI类药物主要通过靶向调节突触间隙中5-HT浓度发挥抗抑郁作用。人体95%的5-HT存在于肠道中[19],主要由嗜铬细胞产生。肠道微生物可通过调控短链脂肪酸(SCFA)代谢、色氨酸羟化酶1(TPH1) mRNA和5-羟色胺转运蛋白(SERT)基因表达,进一步影响5-HT水平[20]。5-HT又可对大肠埃希菌等微生物丰度和群体感应性[21]产生影响,肠道微生物可编码5-HT感应元件[22]。5-HT必须经由相关受体的介导才能发挥作用,其中5-HT2和5-HT3[23]被认为与抑郁症密切相关。5-HT2A受体在海马CA1、CA2、CA3区[24]和肠黏膜下层胆碱能神经元[25]中广泛表达,5-HT3受体大量分布于肠道肌间神经丛和黏膜下神经丛的神经元中[26],均受外来5-HT神经递质的调控。Lyte等[27]的研究发现,长期口服氟西汀可显著降低雄性健康大鼠肠道中乳杆菌丰度,提示氟西汀的负面临床效应是由肠道微生物群改变引起,口服乳杆菌制剂有助于改善氟西汀长期治疗的不良反应。由此可见,氟西汀对大鼠肠道菌群结构和代谢多样性具有显著调控作用,肠道微生物参与SSRI类药物抗抑郁的机制包括,一方面在5-HT与中枢、肠道神经元的受体结合后,可能通过肠-脑轴进一步引起肠道微生物结构和代谢多样性的改变;另一方面是肠道微生物受到5-HT的影响后,可能通过微生物-肠-脑轴自下而上改变大脑的情感和认知行为。
综上所述,本实验采用CUMS结合孤养建立抑郁大鼠模型,Biolog系统检测结果显示,抑郁大鼠肠道菌群结构和代谢多样性发生明显变化,SSRI类抗抑郁药氟西汀对抑郁导致的肠道菌群改变具有正向调控作用。氟西汀可使抑郁模型大鼠肠道中有益菌双歧杆菌丰度上调,使其迅速成为优势菌种,这与Zhang等[28]的研究结果一致;使条件致病菌脆弱拟杆菌、肠杆菌、肠球菌和有害菌产气荚膜梭菌丰度下调,而对乳杆菌丰度无明显调节作用。同时氟西汀可调节微生物整体丰富度和常见菌种均匀度逐渐恢复正常。
本实验仅对抑郁模型大鼠肠道菌群的体外代谢影响进行研究,而SSRI类抗抑郁药物与肠道微生物之间相互作用的具体机制还有待通过基因测序、粪菌移植等进一步揭示。因此,本课题组未来后续拟通过直接检测血液、粪便的代谢物样本来证实SSRI类抗抑郁药物与微生物和代谢物之间存在的因果关系。
