亚硒酸钠促进多形汉逊酵母DL-1合成谷胱甘肽的转录组学分析
2021-03-31刘婵婵荆蓉蓉钱卫东
王 婷,刘婵婵,任 娟,荆蓉蓉,钱卫东,*
(1.陕西科技大学食品与生物工程学院,陕西 西安 710021;2.西安医学高等专科学校,陕西 西安 710032)
谷胱甘肽(glutathione,GSH)又称γ-谷氨酰半胱氨酰甘氨酸,是一种由L-谷氨酸、L-半胱氨酸及L-甘氨酸组成的活性三肽。其结构中还原态的巯基能结合重金属离子和氧自由基,具有缓解重金属中毒、抗氧化功能,可以促进糖类、脂肪及蛋白质代谢,并具有防止溶血、防止皮肤色素沉积、有效防止食品的酶促或非酶促的褐变、增强食品风味和营养等作用。目前,GSH的制备方法主要包括化学合成法、酶转化法及发酵法[1]。其中,利用酿酒酵母[2](Saccharomyces cerevisiae)、毕赤酵母[3](Pichia pastoris)、产朊假丝酵母[4](Candida utilis)为工程菌发酵生产GSH的方法,具有菌种易培养、产量高、纯度好、品质安全,生产工艺完善等优点,被广泛应用于医药、化妆品和食品等行业中GSH原料的生产。
多形汉逊酵母(Hansenula polymorpha)是美国食品药品监督管理局批准的食品级酵母,属于甲醇型酵母,具有营养要求简单、耐酸(pH值适应范围为2.5~8.0)、耐高温(温度适应范围为25~48 ℃)、繁殖快、发酵密度高、便于遗传操作的优点,是乙型肝炎病毒表面抗原、人干扰素、胰岛素等生物工程产品开发和拓展的主要细胞平台之一[5]。Wang Dahui[6]和Xu Ruoyang[7]等通过紫外线-γ射线复合诱变、优化培养基补料方式、构建基因重组菌株、低pH值胁迫[4]促进产朊假丝酵母中GSH合成积累。钱卫东等[8]以30 μg/mL Na2SeO3诱导多形汉逊酵母使酵母胞内GSH产量提高到215.21 mg/L,但对于Na2SeO3诱导下多形汉逊酵母生物合成和积累GSH的分子机制仍有待进一步阐明。
近年来,转录组测序(RNA-Seq)技术因其分辨率高、数据重现性好等优势,逐渐成为研究基因表达水平、新基因的检测挖掘及其功能注释的重要手段[9]。因此,本研究以多形汉逊酵母DL-1为出发菌株,利用Na2SeO3诱导酵母高效合成GSH,通过转录组测序技术对比出发菌株与诱导菌株的转录本信息,筛选其表达差异基因(differential expression genes,DEGs),富集与GSH代谢及调控相关的基因通路,为进一步开展多形汉逊酵母定向分子改良,提高合成GSH效率提供新思路。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株与培养基
多形汉逊酵母DL-1(ATCC 26012),由陕西科技大学食品与生物工程学院功能微生物研究室保存。
种子培养基:葡萄糖20 g/L,酵母粉10 g/L,蛋白胨20 g/L,pH 6.0;发酵培养基:葡萄糖40 g/L,(NH4)2SO410 g/L,蛋白胨5 g/L,酵母粉5 g/L,KH2PO42.3 g/L,MgSO40.5 g/L,pH 6.0。培养基灭菌条件:将葡萄糖溶液和不含葡萄糖的培养基分别置于115 ℃,高压灭菌20 min,灭菌后按比例混匀,并以无菌的1 mol/L HCl或NaOH调节培养基pH值。
1.1.2 试剂
Na2SeO3天津市恒兴化工;2-硝基苯甲酸(5,5’-dithiobis-(2-nitrobenzoic acid),DTNB)、GSH美国Sigma公司;TRIzol Reagent(15596-026) 美国Invtrogen公司;其余试剂均为国产分析纯。
1.2 仪器与设备
J6-MI型冷冻离心机 美国Beckeman公司;Perkin-Elmer 402紫外-可见分光光度计 上海第三分析仪器厂;多功能酶标仪 美国BioTek公司。
1.3 方法
1.3.1 种子培养
将-80 ℃冰箱中保藏的菌种迅速解冻至室温,取1 mL接种至100 mL的种子培养基中,30 ℃、160 r/min摇床中培养24 h。
1.3.2 Na2SeO3对多形汉逊酵母生长抑制的EC50
取1 mL新鲜酵母发酵液,4 ℃、6 000 r/min离心10 min,沉淀以蒸馏水洗涤2 次,重悬,以细胞计数板计数酵母细胞个数;2 倍比稀释悬液,取100 μL置于酶标仪,在600 nm波长检测其OD值,分析OD值与细胞浓度的相关性。将酵母种子液接种到96 孔细胞培养板,0.5~1.0×104个/孔,加Na2SeO3溶液,使Na2SeO3终浓度分别为600、500、400、300、200、100、50 μmol/L,37 ℃、200 r/min培养24 h;然后测其OD600nm值,计算Na2SeO3对多形汉逊酵母生长抑制的EC50。
1.3.3 Na2SeO3对多形汉逊酵母生长的影响
以5%的接种量,将酵母种子液接种添加Na2SeO3的发酵培养基中,使Na2SeO3终浓度分别为0、30、60、120、240、480 μmol/L,200 r/min、37 ℃培养12 h;随后,在30 ℃条件下继续培养60 h;每间隔6 h 取样,每次取5 mL发酵液,4 ℃、6 000 r/min离心10 min,沉淀以蒸馏水洗涤2 次,85 ℃烘干至恒质量,测量菌体质量浓度,以干质量计。
1.3.4 多形汉逊酵母中GSH的提取和测定
DTNB可与GSH的巯基反应,生成黄色的3-羧基-4-硝基苯硫酚,且在412 nm波长处有强烈吸收峰,因此可以通过标准曲线法测定酵母发酵液中GSH质量浓度。取5 mL新鲜的酵母发酵液,4 ℃、6 000 r/min离心10 min,上清液用于检测胞外GSH含量;沉淀以5 mL 0.2 mol/L 磷酸盐缓冲液(pH 7.0)洗涤2 次,置冰浴中超声波破壁20 min(功率400 W,超声15 s,间歇10 s);将发酵液上清液与菌体超声破碎后获得的上清液,分别加入1.5 mL 0.06% NaOH和0.5 mL 0.03%甲醛,混匀,室温下静置2 min;再加入2.5 mL DTNB分析液(100 μmol/L DTNB,0.25 mol/L Tris-HCl,pH 8.0)混匀,25 ℃ 孵育5 min,在412 nm波长处测定吸光度,根据GSH标准曲线分别计算酵母胞外、胞内GSH产量,按照以下公式分别计算GSH的总产量、胞内GSH含量[10-11]:

1.3.5 多形汉逊酵母转录组测序
1.3.5.1 酵母培养及其RNA提取
将种子液以5%的接种量分别转接到正常和添加Na2SeO3的发酵培养液中,37 ℃、200 r/min培养至对数期;于4 ℃、6 000 r/min离心10 min,弃去上清液;加4 ℃预冷RNase free的磷酸盐缓冲液洗涤2 次;利用TRIzol试剂盒提取其总RNA;通过NanoDrop定量RNA浓度和纯度,通过琼脂糖凝胶电泳和Agilent 2100鉴定RNA完整性。
1.3.5.2 文库构建和转录组测序
文库的制备参照Illumina TruSeq RNA文库制备试剂盒V2操作说明,包括以下步骤:首先取1 μg检测合格的总RNA,用磁珠富集mRNA;然后以逆转录酶催化合成单链cDNA,经DNA聚合酶合成双链cDNA并连接测序接头,构建特异性cDNA文库;最后使用Agilent 2100对文库进行质量检测,将检验合格的不同文库置于Illumina HiSeq 2000平台进行转录组测序。
1.3.6 转录组测序数据处理及分析
1.3.6.1 转录组测序质量评估
将测序获得Raw Data经过去除接头和过滤得到Clean序列[12];使用Trinity软件[13-14]将短的Clean序列组装为Unigene序列;并将Clean序列与Unigene序列进行比对[15],得到Mapped Data;通过插入片段长度检验、随机性检验等进行原始序列质量评估[16]。
1.3.6.2 差异表达基因分析
将测序得到的Clean reads与Unigene库进行比对,结合RSEM[15-16]进行基因表达量水平估计;应用HTSeq方法对基因表达量进行FPKM定量[17-18];利用DESeq[19]进行Na2SeO3诱导组和对照组间的基因表达量对比分析,以差异倍数≥2或≤1/2且错误发现率(false discovery rate,FDR)≤0.01作为筛选标准,获得DEGs。
1.3.6.3 差异表达基因功能注释及富集分析
对筛选获得的Na2SeO3诱导组和对照组间的DEGs:1)通过BLAST2 GO比对到基因本体(Gene Ontology,GO)数据库(http://www.geneontology.org/),再通过topGO进行DEGs功能的GO富集[20];2)通过KAAS(KEGG automatic annotation server)比对到KEGG(Kyoto Encyclopedia of Genes and Genomes)数据库,再采取超几何分布样本抽取方法进行DEGs功能的KEGG代谢通路富集[21-22],进一步注解与GSH代谢调控相关基因、关键合成酶及其代谢途径。
1.4 数据统计分析
转录组样品设置2 个平行重复,其他样本设置3 个平行重复,使用SPSS 20.0对所检测的多形汉逊酵母生长及其GSH产量进行t检验分析,以P<0.05计为差异有统计学意义。
2 结果与分析
2.1 Na2SeO3对多形汉逊酵母生长影响
以细胞计数和发酵液吸光度分别考察多形汉逊酵母DL-1菌体增长情况,结果在1×104~1×1010个/mL范围,酵母细胞数目和发酵液OD600nm值呈良好的线性关系,拟合方程为y=0.095 8x+0.729 8,R2=0.986 3,P<0.001(图1A),因此,可用OD600nm间接表示酵母菌体浓度。在24 h发酵期内,≤100 μmol/L的Na2SeO3可以促进HP-DL-1生长,而>100 μmol/L的Na2SeO3抑制HPDL-1生长,其生长抑制EC50为234.72 μmol/L(图1B)。将HP-DL-1以5%的接种量接种于含不同浓度Na2SeO3的发酵培养基中,200 r/min,37 ℃发酵12 h,然后置于30 ℃继续发酵60 h;如图1C所示,0~120 μmol/L的Na2SeO3可促进HP-DL-1生长,60 μmol/L发酵48 h菌体质量浓度最高,达(40.29±0.64)g/L;而240 μmol/L和480 μmol/L的Na2SeO3延迟酵母进入对数生长期的时间,抑制HP-DL-1生长。不同浓度Na2SeO3诱导培养多形汉逊酵母DL-1发酵液中GSH的总产量如图1D所示,随着发酵时间延伸,酵母发酵液中GSH的积累逐渐增高,在48~54 h达到高峰。
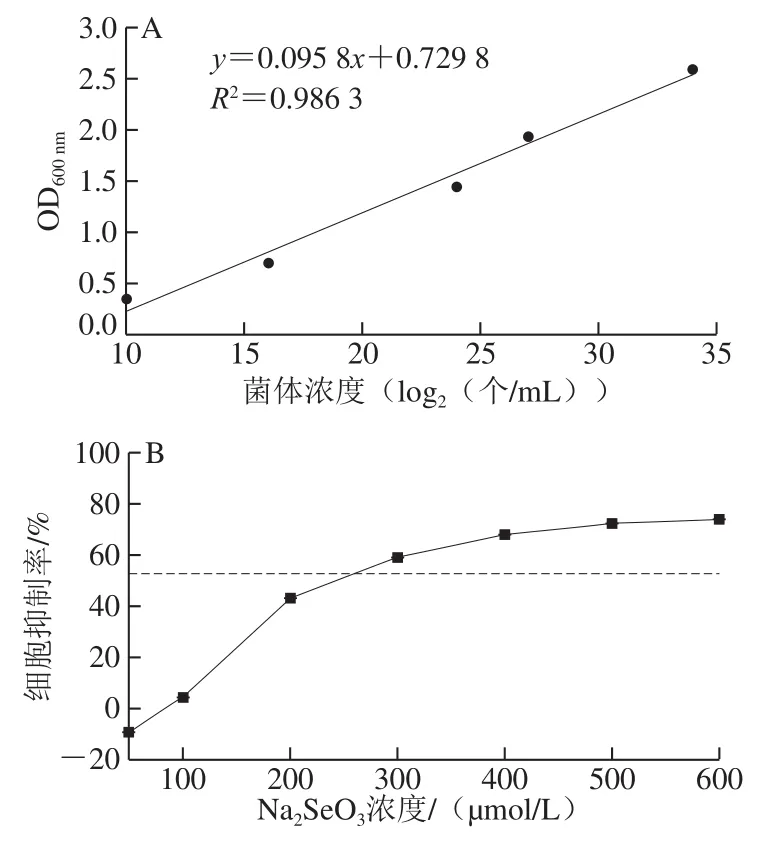
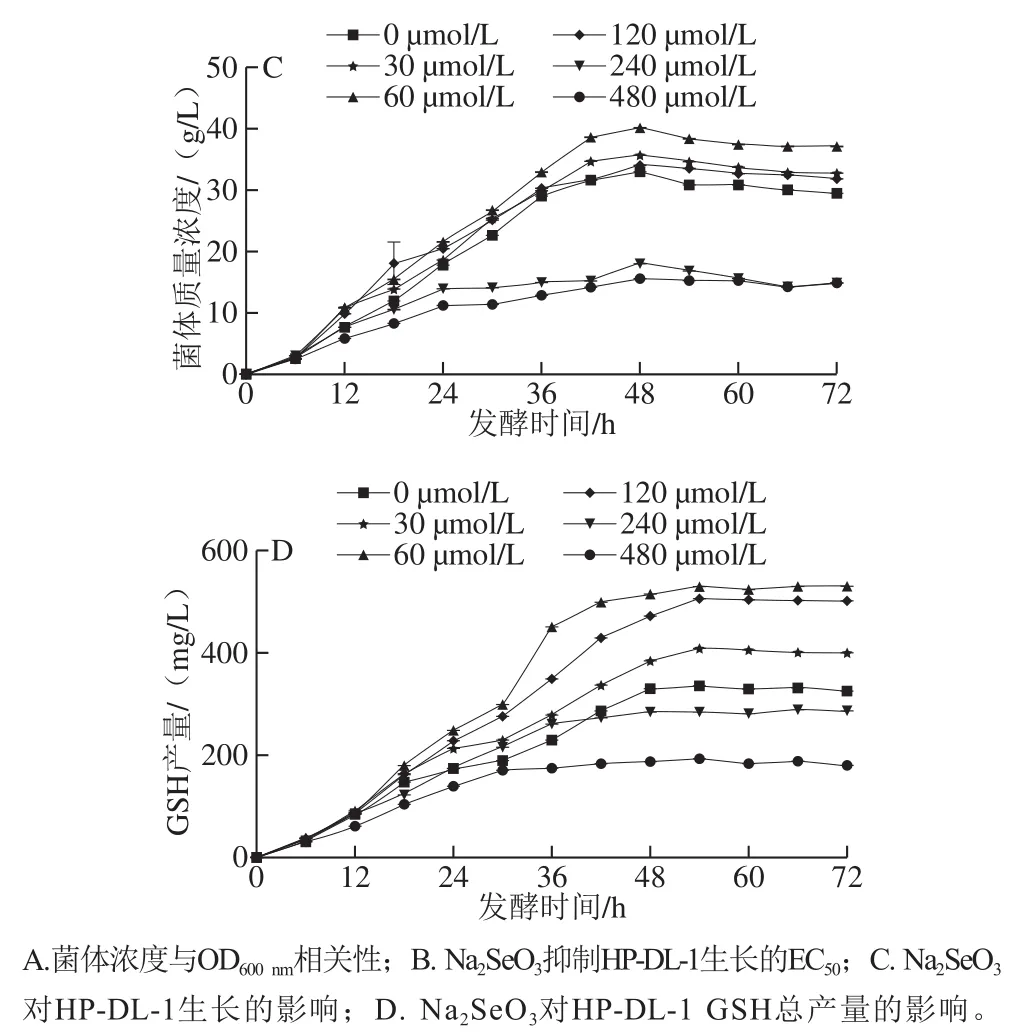
图 1 Na2SeO3对多形汉逊酵母DL-1生长及GSH总产量的影响Fig. 1 Effects of Na2SeO3 on the growth and GSH yield of HP-DL-1
2.2 Na2SeO3对多形汉逊酵母GSH总产量的影响
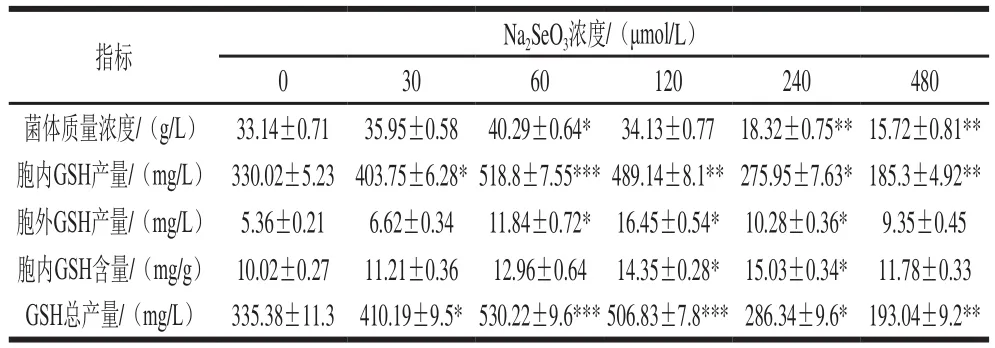
表 1 不同浓度Na2SeO3对多形汉逊酵母DL-1 GSH产量的影响Table 1 Effect of different concentrations of Na2SeO3 on GSH production of HP-DL-1
如表1所示,当Na2SeO3终浓度为60 μmol/L时,HP-DL-1发酵液GSH总产量最高,为(530.22±9.6)mg/L。随着发酵液中Na2SeO3浓度增加,Na2SeO3对HPDL-1由营养转为毒性作用,抑制菌体生长。当Na2SeO3浓度为240 μmol/L时,HP-DL-1胞内GSH含量最高,达(15.03±0.34)mg/g,但发酵液总GSH产量降低,为(286.34±9.6)mg/L。
2.3 RNA-seq数据质量评估
60 μmol/L Na2SeO3能有效促进多形汉逊酵母DL-1生长,发酵48~54 h后胞内GSH产量较高,因此,本研究将HP-DL-1种子液以5%的接种量分别转接到Na2SeO3终浓度为0 μmol/L(对照组)和60 μmol/L(诱导组)的发酵培养液中,37~30 ℃、200 r/min培养至对数期;提取RNA、构建文库并进行转录组测序。利用Fast QC(v 0.10.1)法分析测序质量,测序的碱基质量值用Qphred表示,样品测序数据如表2所示,对照组获得45 778 342 Clean reads,诱导组得到45 492 098 Clean reads,4 个转录组样本中Q30(0.1%碱基识别错误率)最小的样本值为95.28%,序列GC含量47.96%,表明转录组测序数据质量较高。
使用Trinity软件将短的reads拼接组装为较长的Unigene序列集;将Clean reads与Unigene序列进行比对,得到Mapped Data;结果显示,测序4 个样本定位到Unigene序列上的序列数均大于80%,最低匹配率为84.65%,表明本测序样本没有受到污染。
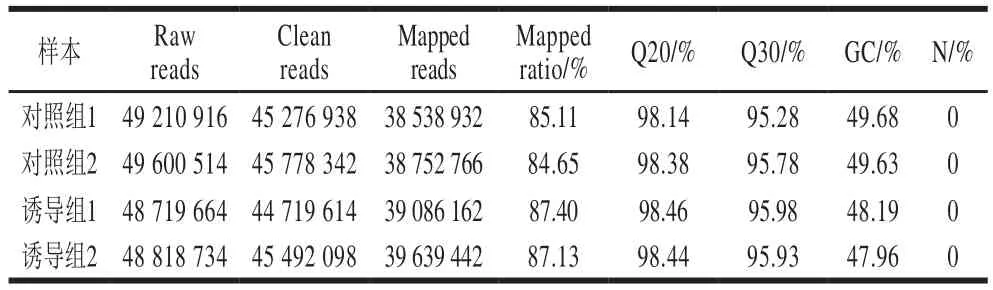
表 2 Na2SeO3诱导多形汉逊酵母DL-1的转录组测序质量分析Table 2 Quality statistics of transcriptome sequencing of HP-DL-1 induced by Na2SeO3
2.4 差异表达基因
采用Bowtie结合RSEM进行基因表达量水平估计;以FPKM计算各个基因相对表达量,以基因FC≥2或FC≤1/2且FDR≤0.01作为筛选条件,进行Na2SeO3诱导组与对照组多形汉逊酵母的差异表达分析。如图2所示,横坐标表示基因在不同样本中表达倍数变化,纵坐标表示基因表达量变化差异的统计学显著性,Na2SeO3诱导组与对照组多形汉逊酵母之间有1 254 个显著性DEGs,其中630 个DEGs表达显著上调,624 个DEGs表达显著下调,说明Na2SeO3对多形汉逊酵母DL-1的基因转录水平产生了广泛的影响。
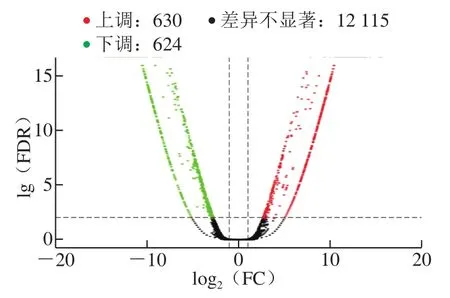
图 2 Na2SeO3诱导组和对照组比较的差异表达基因Fig. 2 DEGs between Na2SeO3 induced and control groups
2.5 差异表达基因GO富集分析
对获得的Na2SeO3诱导组和对照组间1 254 个显著DEGs进行GO数据库比对,其中639 个DEGs获得GO功能注释,再通过topGO进行DEGs的GO富集分析,639 个DEGs在GO功能二级分类下共涉及12 个生物过程(biological process,BP),10 个细胞组分(cellular component,CC),12 个分子功能(molecular function,MF)(图3)。生物学过程功能分组中包括106 个DEGs,主要涉及代谢过程、细胞过程和单有机体过程;在细胞组分的功能分组中包括63 个DEGs,主要涉及细胞、细胞组分、细胞膜组分和细胞器组分;在分子功能分组中包括470 个DEGs,主要涉及催化活性、结合、转运活性等功能。
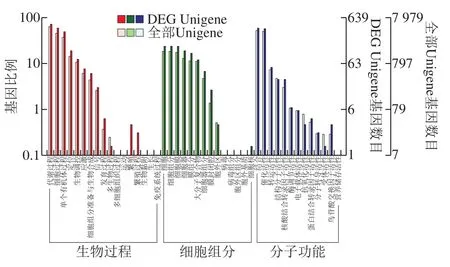
图 3 差异表达基因的GO富集Fig. 3 GO enrichment of DEGs between Na2SeO3 induced and control groups

图 4 差异表达基因的GO富集柱状图Fig. 4 Go enrichment histogram of DEGs between Na2SeO3 induced and control groups
进一步分析表明,639 个DEGs在GO功能分类下共涉及838 个GO term,选择富集最显著的30 个GO term,绘制GO富集柱状图(图4),纵坐标为富集的GO term,横坐标为该term中差异基因的个数,富集最显著主要涉及26 个生物过程和4 个细胞组分,包括细胞膜(92 个DEGs)和细胞核组分(71 个DEGs),跨膜转运(77 个DEGs)、DNA修复(22 个DEGs)、DNA复制(9 个DEGs)、DNA重组(12 个DEGs)过程,RNA剪切过程(5 个DEGs)、蛋白质糖基化(14 个DEGs)、磷脂生物合成(9 个DEGs)、丝氨酸/苏氨酸激酶调节(2 个DEGs)和GSH生物合成过程(2 个DEGs)等。
2.6 差异表达基因KEGG代谢通路富集
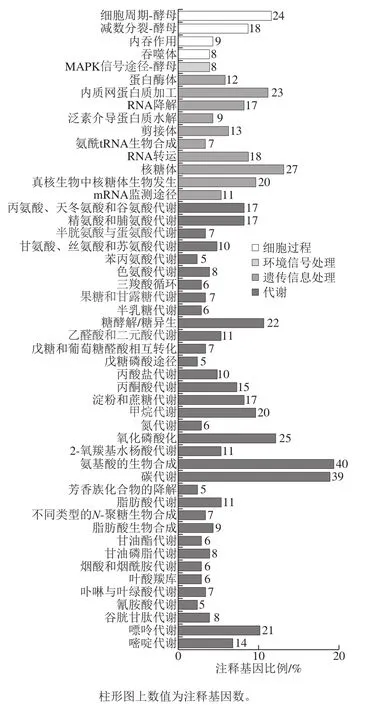
图 5 差异表达基因的KEGG通路富集Fig. 5 KEGG pathway enrichment of DEGs between Na2SeO3 induced and control groups
将获得的Na2SeO3诱导组和对照组间DEGs比对到KEGG数据库,通过超几何分布样本抽取方法进行DEGs功能的KEGG代谢通路富集,1 254 个显著DEGs中有649 个基因被KEGG注释,参与94 条代谢途径。选择富集最显著的50 个KEGG通路(图5),包括氨基酸的生物合成(40 个DEGs)、碳代谢(39 个DEGs)、糖酵解/糖异生(22 个DEGs)、核酸代谢(嘌呤21 个DEGs、嘧啶14 个DEGs)、甲烷代谢(20 个DEGs)、脂肪酸代谢(11 个DEGs)等代谢通路;酵母细胞周期(24 个DEGs)、有丝分裂等细胞过程(18 个DEGs);以及核糖体(27 个DEGs)和内质网蛋白质加工(23 个DEGs)的遗传信息处理通路。其中,参与核糖体和内质网蛋白质加工等遗传信息处理通路调控的基因为蛋白质合成和细胞有丝分裂做好准备;调控有丝分裂和细胞周期等细胞过程的调控基因与Na2SeO3诱导酵母细胞快速增值,提高发酵产率密切相关;碳、核酸、脂肪酸代谢过程相关基因保障细胞代谢维持稳定并为促进细胞生长繁殖提供物质和能量;而参与调控氨基酸的生物合成,尤其是参与GSH合成密切相关的丙氨酸、天冬氨酸和谷氨酸代谢通路,甘氨酸、丝氨酸和苏氨酸代谢通路,半胱氨酸和蛋氨酸代谢通路,以及GSH代谢通路的酶基因,其转录水平在Na2SeO3诱导组和对照组酵母之间呈现显著的差异。
2.7 GSH代谢相关的差异表达基因
GSH合成和代谢是由一些列酶催化介导的生化反应网络,通过对比分析差异表达基因GO富集和KEGG富集的结果,筛选2 组结果中高富集通路中共有的,并且参与调控GSH合成代谢的显著差异表达的酶基因,分析结果如表3所示。在Na2SeO3诱导发酵的多形汉逊酵母中,丝氨酸丙酮酸转氨酶(serine-pyruvate transaminase,SGX1)、丙氨酸乙醛酸转氨酶(alanineglyoxylate aminotransferase,MET6)、GSH合成酶(glutathione synthase,GSH-II)、磷酸葡萄糖酸脱氢酶(6-phosphogluconate dehydrogenase,GND1)、5-氧丙烷酶(5-oxoprolinase,OXP1)和γ-谷氨酰转肽酶(gamma-glutamyl-transpeptidase,ECM38)表达上调。Sahu等[23]研究表明SGX1和MET6可以通过顺序的转氨基作用,将羟基丙酮酸转化为丝氨酸,再转化为甘氨酸;甘氨酸经过GSH-II催化与谷氨酰半胱氨酸合成GSH[24];GND1通过促进NADPH脱氢为NADP+,维持GSH的还原态[25];OXP1和ECM38促进GSH-5异脯氨酸-谷氨酸的循环代谢[26];因此这些基因在Na2SeO3作用下转录水平增高,可以有效促进酵母细胞合成大量GSH,并保持GSH的还原态。

表 3 GSH代谢相关的差异表达基因Table 3 DEGs related to glutathione metabolism
另一方面,在Na2SeO3诱导发酵的多形汉逊酵母中,谷氨酸合酶、谷氨酰胺合成酶(glutamine synthetase,GLN1)和GSH-S-转移酶(glutathioneS-transferase,GSTs)表达下调,通过减少谷氨酸进入谷氨酸-谷氨酰循环比例[26],抑制胞内GSH酶解为谷氨酸、甘氨酸和乙酰CoA[27],促进GSH在细胞内积累。
此外,低能离子注入的重组酵母[28]、柱状黏滑菇菌[29](Hebeloma cylindrosporum)、酒酒球菌[9](Oenococcus oeni)等其他微生物中参与调控GSH合成的关键酶,如γ-谷氨酰基转移酶、GSH还原酶、GSH水解酶,其基因转录在本研究中表达无显著差异,这可能与诱导方式或菌种基因型不同有关,其具体原因还有待进一步研究探索。
3 结 论
本研究考察高密度、变温培养条件下,添加Na2SeO3诱导多形汉逊酵母合成GSH的发酵过程,发现60 μmol/L Na2SeO3可以诱导多形汉逊酵母合成GSH总产量提高,达到(530.22±9.6)mg/L。采用Illumina HiSeq测序平台对Na2SeO3诱导组与对照组多形汉逊酵母转录组进行对比分析,按照差异基因表达变化2 倍以上且FDR≤0.01的原则,两组间共筛选出1 254 个DEGs,其中630 个基因上调,624 个基因下调。通过差异基因GO富集分析结果可以明确Na2SeO3可以诱导酵母中参与跨膜转运、细胞壁生成等细胞过程的功能基因,以及调控蛋白糖基化、基因甲基化、丝氨酸/苏氨酸和GSH合成的酶基因的转录水平发生显著变化。最后通过差异基因KEGG富集分析确定差异表达基因在酵母细胞周期、碳代谢、氧化磷酸化、氨基酸的生物合成,尤其是谷氨酸、甘氨酸、半胱氨酸及GSH代谢通路中显著富集。本研究部分解析了Na2SeO3诱导多形汉逊酵母菌高产GSH的生理机制,同时也为进一步提高酵母GSH产量及其分子育种提供参考数据。
