红腐乳后酵期风味物质与细菌菌群分析
2021-03-31吴学凤穆冬冬张明珠侯志刚张钰萌李兴江
陈 卓,吴学凤,穆冬冬,何 莹,张明珠,蔡 静,侯志刚,郑 志,梁 进,张钰萌,李兴江,*
(1.合肥工业大学食品与生物工程学院,安徽省农产品精深加工重点实验室,安徽 合肥 230009;2.安徽农业大学茶与食品科技学院,安徽 合肥 230036)
腐乳又称霉豆腐,是以大豆为主要原料,经过浸泡、磨浆、点浆、制坯、前发酵、腌制、后发酵而成[1]。腐乳因后期处理不同分为青方、白方、红方和红油等多种风味,是我国独创的大豆发酵食品,已有一千多年的历史,其滋味鲜美、风味独特、营养丰富[2]。腐乳根据发酵菌种不同大致分为毛霉型、根霉型和细菌型3 种类型。毛霉是腐乳发酵过程中常用的菌种,大多研究集中在真菌对腐乳发酵过程的作用;由于腐乳后发酵为半开放式,因此细菌对腐乳发酵的风味及口感也产生影响[3-5]。探索后酵阶段细菌菌落演替、风味物质变化及其相互关系对高品质腐乳发酵有着至关重要的作用[6]。
近年来,高通量测序技术通过对细菌中16S rRNA基因的大规模测序并进行敏感检测,被广泛应用于研究微生物的组成和多样性[7]。此外,综合代谢组学方法结合多元统计分析被广泛应用于分析微生物代谢谱[8],采用氨基酸自动分析仪对腐乳中氨基酸变化进行分析,采用顶空固相微萃取-气相色谱-质谱联用技术研究腐乳发酵过程中风味物质变化[9]。应用代谢组学方法研究微生物群落,可以加深对发酵食品的认识[10-12]。本研究基于Pearson相关性分析优势菌群-风味组分之间的相关性,阐明后酵期红腐乳与微生物菌群之间的关系,旨在为提升腐乳风味品质和改良腐乳传统制造工艺提供基础数据。
1 材料与方法
1.1 材料与试剂
红腐乳收集于中国安徽八公山地区。
4-甲基-2-戊烯(内标,色谱纯)、氨基酸标准品、邻苯二甲醛(o-phthalaldehyde,OPA) 美国Sigma公司;甲醇、三氯乙酸(均为色谱级) 美国Tedia公司。
1.2 仪器与设备
100 μm PDMS萃取头、萃取手柄 美国Supelco公司;GC6890N-MSD5975气相色谱-质谱联用仪、100高效液相色谱仪 美国Agilent公司;HP-5MS毛细管柱(30.0 m×0.25 mm,0.25 μm)、顶空萃取瓶 美国Supelco公司;L8900全自动氨基酸分析仪 德国曼默博尔公司;MiSeq HTS平台 美国Illumina公司;聚合酶链式反应(polymerase chain reaction,PCR)基因扩增仪美国Thermo Scientific公司。
1.3 方法
1.3.1 样品前处理
在安徽八公山豆制品公司红腐乳装罐后入窖,在第10、30、60天分别取样。在罐中收集上中下三层腐乳各一块,装入无菌均质袋中,用均质机拍打2 min,取适量样品进行测定,样品冻存于-80 ℃冰箱备用[13]。
1.3.2 挥发组分预处理
将新购置的萃取头在气相色谱进样口250 ℃老化1 h。取5 g研磨均匀的腐乳样品放入顶空萃取瓶中,同时加入10 μL 125 mg/L 4-甲基-2-戊烯溶液[14]作为内标。60 ℃预热10 min后,插入老化后的100 μm PDMS萃取头,然后60 ℃萃取吸附40 min,用于气相色谱-质谱分析。
1.3.3 气相色谱-质谱分析
将萃取头缓慢从顶空瓶中取出后迅速插入气相色谱进样口,进样口温度250 ℃,解吸10 min,后进行气相色谱-质谱检测分析。以C7~C40正构烷烃作为外标。
气相色谱条件:HP-5MS弹性石英毛细管色谱柱(30 m×0.25 mm,0.25 μm);进样口250 ℃;载气为高纯(≥99.999%)氦气,流速1.0 mL/min;进样方式为不分流进样;升温程序:起始温度40 ℃,保持2.0 min,3 ℃/min升至180 ℃,再以10 ℃/min升至250 ℃,保持5 min[15]。
质谱条件:电子电离源,电子能量70 eV,离子源温度230 ℃,四极杆温度150 ℃,接口温度260 ℃,全扫描模式,范围35~450 u。
1.3.4 氨基酸含量分析
本实验采用反相高效液相色谱和OPA柱前衍生化紫外检测相结合的方法检测氨基酸含量[16]。
样品处理:在容量瓶中用5 g/100 mL三氯乙酸溶液将10.0 g腐乳样品填充至25 mL。用双层滤纸或针形滤纸过滤1 h后的溶液。将1 mL滤液转移到1.6 mL离心管中,10 000 r/min离心10 min。将每种样品的400 μL加入液相小瓶中,然后使用安捷伦Hypersil ODS柱(4.0 mm×250 mm,5 μm)在高效液相色谱系统中自动检测。
流动相:流动相A(pH 7.2)为27.6 mmol/L乙酸钠-三乙胺-四氢呋喃(500∶0.11∶2.5,V/V);流动相B(pH 7.2)为80.9 mmol/L乙酸钠-甲醇-乙酯(1∶2∶2,V/V)。
洗脱程序:0~17 min,92%~50% A、8%~50% B;17~20.1 min,50%~0% A、50%~100% B;20.1~24.0 min,0%~100% A、100%~0% B。流速1.0 mL/min;柱温40 ℃;紫外检测器检测波长338 nm;测定脯氨酸波长262 nm,采用外标法测定氨基酸含量。
1.3.5 理化性质分析
蛋白酶活性测定:参照GB/T 23527—2009《蛋白酶制剂》。得到标准曲线方程为y=0.010 09x+6.444 44×10-4,R2=0.999 6,在10~80 μg/mL范围内线性良好。
水分含量测定:参照GB 5009.3—2016《食品中水分的测定》;总酸含量测定:参照GB/T 12456—2008《食品中总酸的测定》;氨基酸态氮、食盐含量测定:参照SB/T 10170—2007《腐乳》。
1.3.6 DNA提取、扩增及测序
称取红腐乳5 g,将样品与125 mL磷酸盐缓冲液(pH 7.2)混合,取5 mL滤液用DNA试剂盒进行基因组DNA提取。基因组DNA提取完成后,用1%琼脂糖凝胶电泳检测提取的基因组DNA。然后在TransGenAP221-02和PCR仪中利用引物338F和806R扩增16S rRNA基因的V3-V4结构域。
将每个腐乳样品的PCR产物混合,进行2%琼脂糖凝胶电泳检测。PCR产物用AxyPrepDNA凝胶回收试剂回收,三聚氰胺洗脱。参照初步电泳定量结果,采用quantifluorqm-stBlue荧光定量系统对PCR产物进行定量,然后根据每个样品测序量进行混合。扩增自提交给上海马约比奥生物Pharm科技有限公司,用于Illumina文库付费制备、簇生成和MiSeq仪器上300~500 bp测序[17-19]。
1.3.7 风味物质定性和定量分析
利用保留指数(retention index,RI)进行定性,在与腐乳样品相同的色谱条件下进样分析,通过保留时间可计算RI,如式(1)所示。同时结合NIST库对风味物质定性[20]。
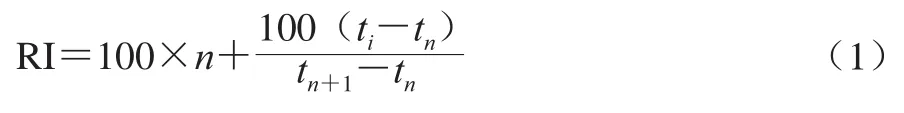
式中:n和n+1分别为未知物流出前后正构烷烃碳原子数;tn和tn+1分别为相应正构烷烃的保留时间/s;ti为未知物在气相色谱中的保留时间(tn<ti<tn+1)/s。
根据内标质量浓度对风味物质进行半定量,计算如式(2)所示:

式中:C为挥发性化合物质量浓度;Ax为挥发性化合物峰面积;A0为内标峰面积;C0为内标质量浓度。
1.4 数据分析
每个样本做3 组平行,计算3 次重复的平均值和标准差。采用SPSS19.0软件中的单因素方差分析(oneway ANOVA)。通过香气活度值(odor activity value,OAV)分析筛选腐乳中影响明显的风味物质(OAV=物质含量/香气阈值)。利用R语言绘制细菌属相对丰度的变化的热图,采用SPSS 19.0软件对腐乳种类与细菌群落多样性指数进行Pearson相关分析。计算前20 名丰度菌属与腐乳中挥发性风味物质和前20 名丰度菌属与游离氨基酸的Pearson相关系数,并在热图上显示[21]。
2 结果与分析
2.1 后酵期红腐乳中的挥发性风味物质

表 1 后酵期红腐乳中挥发性成分分析Table 1 Analysis of volatile components in post-fermented red sufu
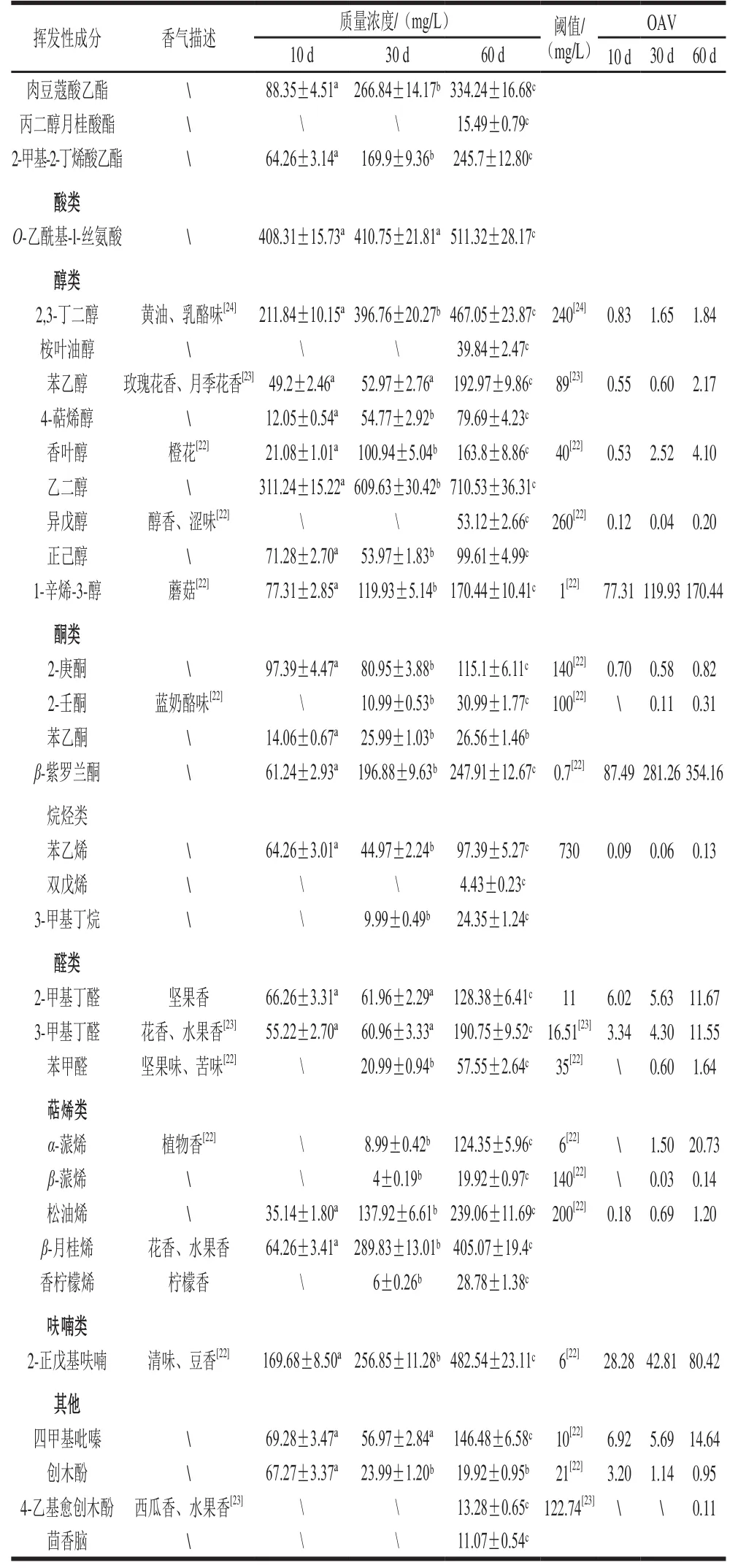
续表1
由表1可知,后酵期红腐乳中共鉴定出50 种挥发性物质,其中酯类20 种,醇类9 种,酸类1 种,酮类4 种,烷烃类3 种,醛类3 种,萜烯类5 种,呋喃类1 种,其他4 种。刘娜等[15]从红腐乳中共鉴定出64 种挥发性风味物质成分,主要以酯类化合物和萜烯类化合物为主,其中鉴定出主要挥发性风味物质为乙酸乙酯、丁酸乙酯、2-戊基呋喃等,在本研究中也鉴定为主要风味物质。但文献中鉴定出的挥发性物质成分与本研究中鉴定出的挥发性物质成分存在部分差异,如文献中未鉴定出吡嗪类物质而在本研究中鉴定出,这与红腐乳的制作工艺及产地的不同有很大关系。闫平平等[25]从红腐乳鉴定中显示,红腐乳挥发性风味物质中以长链脂肪酸酯含量最高,占风味物质总量的90%以上。与本研究有较大的差异,这与原材料的产地发酵场所不同、菌种不同导致风味的差异有关,同时这与闫平平等[25]选用DB-5MS色谱柱而本实验为HP-5MS色谱柱也有一定关系。从不同阶段后酵期红腐乳中鉴定出的成分分析可知,大部分酯类物质含量和种类随发酵进行而升高,在发酵30 d后,出现苯乙酸乙酯和月桂酸乙酯等常见风味物质。酸类物质和醛类物质含量在10~30 d变化较小,在30~60 d有较大变化。其他大部分挥发性风味物质如苯乙醇、香叶醇、2-正戊基呋喃等随着发酵进行而增加,且物质种类也随发酵进行而增加;本研究检测出一种酸类物质O-乙酰基-l-丝氨酸,可能作为一种代谢中间产物而存在。通过文献得到部分物质的风味阈值,结合物质含量计算OAV,得到15 种主要挥发性风味物质:苯乙醇、香叶醇、1-辛烯-3-醇、乙酸乙酯、己酸乙酯、辛酸乙酯、壬酸乙酯、葵酸乙酯、2-甲基丁酸乙酯、2-甲基丁醛、3-甲基丁醛、2-正戊基呋喃、四甲基吡嗪、β-紫罗兰酮、α-蒎烯。通过后续实验进一步推测挥发性风味物质与菌落之间的关系。
2.2 后酵期红腐乳的氨基酸含量
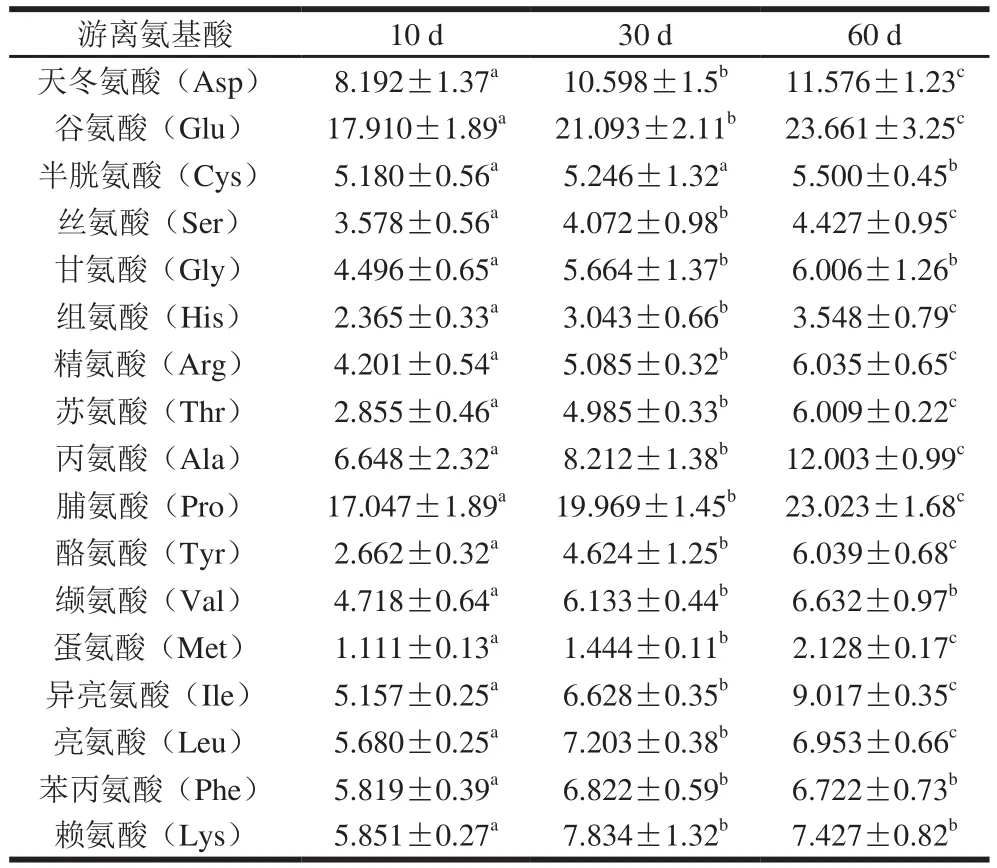
表 2 后酵期红腐乳中游离氨基酸含量Table 2 Analysis of free amino acids in post-fermented red sufu g/kg
如表2所示,在红腐乳中共检测到17 种氨基酸。成熟初期10 d,游离氨基酸总量小于130 g/kg,在第30天迅速增长到130 g/kg,此后游离氨基酸含量在第60天缓慢升高到150 g/kg,其中Leu、Phe和Lys在发酵阶段先升高后降低,这与芽孢杆菌(Bacillus)比例在发酵后期迅速降低其活性受到抑制有关。红腐乳中菌群丰度增加,除Bacillus外大部分菌种含量不断增加,多种菌群代谢使红腐乳中游离氨基酸总量升高。后酵期红腐乳中游离氨基酸种类丰富,含量高。其中含有8 种人体必需氨基酸,且人体必需氨基酸含量随发酵进行而升高。
2.3 后酵期红腐乳的理化性质
2.3.1 蛋白酶活性
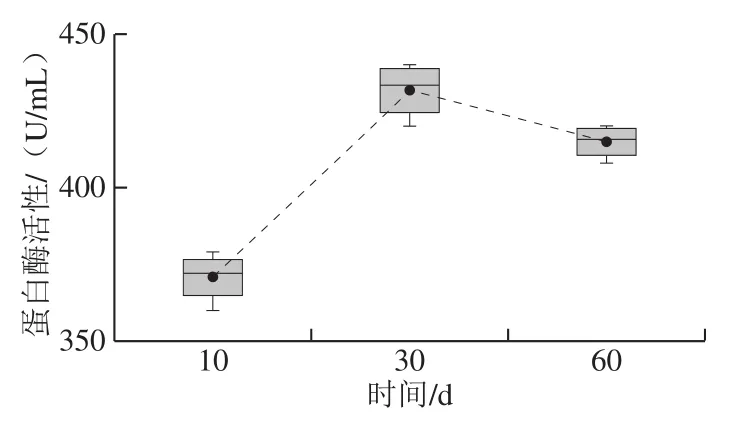
图 1 红腐乳后酵期蛋白酶活性箱型图Fig. 1 Protease activity in post-fermented red sufu
如图1所示,红腐乳后酵阶段蛋白酶活性变化为先迅速升高后缓慢降低(P<0.05),在后酵期,前期蛋白酶活性为374 U/mL,中期为437 U/mL,后期为418 U/mL。腐乳中的蛋白质在蛋白酶作用下被分解为氨基酸与小分子肽,氨基酸经转氨、脱羧、脱氢后形成腐乳特征风味物质。
2.3.2 基本理化指标分析

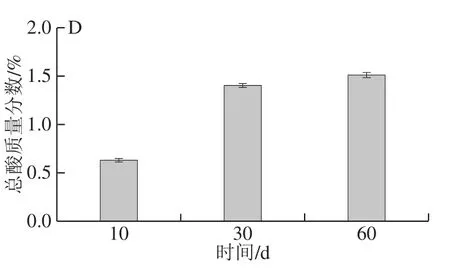
图 2 红腐乳后酵期氨基酸态氮(A)、水分(B)、食盐(C)和总酸(D)含量变化Fig. 2 Amino nitrogen content (A), water content (B), salt content (C)and total acid content (D) in post-fermented red sufu
由图2A可知,红腐乳中氨基酸态氮含量不断升高,这与腐乳中微生物代谢分解蛋白质产生多种氨基酸有主要联系。图2B显示,红腐乳后酵期水分含量不断升高,可推测随着发酵进行多种微生物作用使腐乳质构改变,持水性升高,提升腐乳的口感。图2C显示,红腐乳后酵阶段前期食盐质量分数为2.92%,食盐含量随着发酵进行而降低,到中期后趋于稳定,食盐质量分数为2.53%。食盐质量分数降低与腐乳加入卤汁后样品中的盐分缓慢溶于卤汁有关,食盐质量分数降低对腐乳中微生物的抑制能力降低,进而促进腐乳中的微生物代谢生成营养物质与风味物质。图2D显示,前期总酸质量分数迅速升高至1.4%后趋于平缓。
2.4 后酵期红腐乳中微生物稀释曲线
稀释曲线可说明检测样品的测序数据量是否足以反映环境中的微生物多样性,也可用来比较不同样品中的微生物多样性情况。由图3可见,后酵阶段红腐乳前期(10 d)、中期(30 d)和后期(60 d)的曲线趋于平坦,说明测序数据足以覆盖所有的微生物,表明了样品中微生物的多样性。同时,红腐乳不同发酵阶段微生物的稀释曲线,反映了在腐乳发酵过程中,微生物多样性逐渐升高。
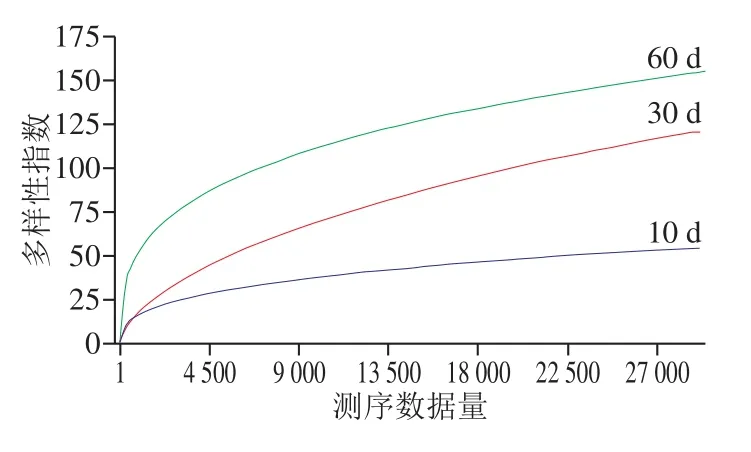
图 3 后酵期红腐乳稀释曲线Fig. 3 Rarefaction curves for post-fermented red sufu
2.5 后酵期红腐乳组间差异显著性分析
图4为红腐乳后酵阶段相对丰度前10 种微生物属水平物种组间差异图。红腐乳后酵前期(10 d)、中期(30 d)和后期(60 d)Bacillus相对丰度差异显著,进而影响谷氨酸等呈味氨基酸的产生,乙酸乙酯含量明显降低;Lelliottia相对丰度在后酵期中差异显著,抑制了后期阶段部分香味物质的产生;乳球菌(Lactococcus)相对丰度差异显著,有利于醛类物质在后期阶段的产生;不动杆菌(Acinetobacter)、肠杆菌(Enterobacter)、水栖菌(Enhydrobacter)等在3 种样品之间也差异显著,多种菌协同发酵使红腐乳后酵前期到中期蛋白酶活性显著升高。
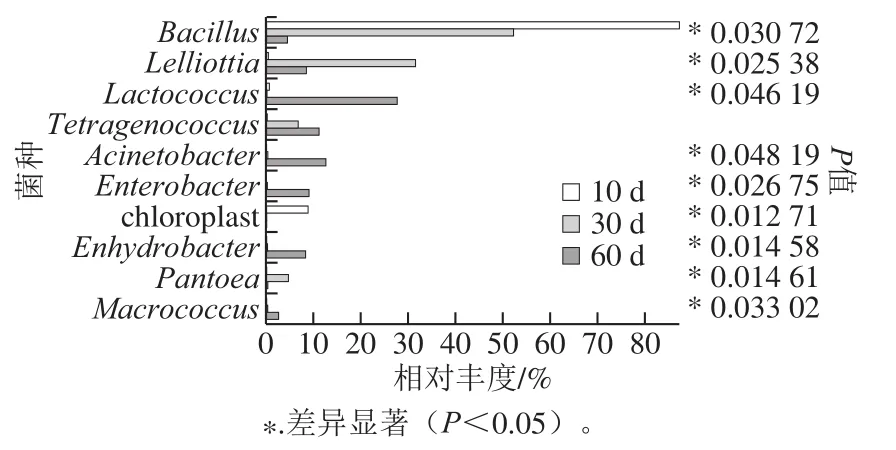
图 4 后酵期红腐乳菌群分布组间差异显著性检验Fig. 4 Significance test of differences in bacterial community distribution in red sufu at different post-fermentation times
2.6 后酵期红腐乳菌群主成分分析(principal component analysis,PCA)
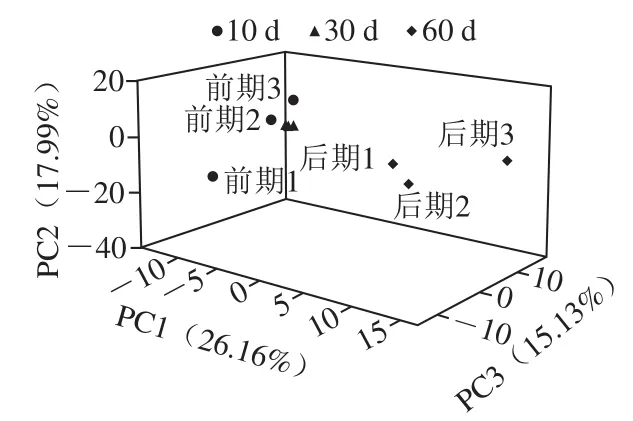
图 5 后酵期红腐乳PCAFig. 5 Principal component analysis of post-fermented red sufu
由图5可以看出,前期2与前期3两点距离较近说明两样品相似度较高,而这两点与前期1距离较远,菌群结构有一定差异。后酵中期距离很近,可推断菌落结构差异很小。后期1、后期2距离较近,可推断菌落结构差异较小,而这两点与后期3距离较远,菌群结构有一定差异。后酵前期红腐乳与中期红腐乳之间距离相对较近,表明后酵前期与后酵中期腐乳之间的菌落结构差异不明显。红腐乳后酵前、中期与红腐乳后酵后期之间距离相对较远,表明后酵前、中期与后酵后期红腐乳之间的菌落结构有明显差异。这些现象说明,在进行发酵的过程中发酵环境有所改变导致了红腐乳中微生物的情况差异显著。
2.7 后酵期红腐乳属水平微生物相对丰度分析
由图6可知,后酵10 d占主要比例的前5 个属为Bacillus(91.71%)、Acinetobacter(2.98%)、chloroplast(2.58%)、Lelliottia(0.73%)和Tetragenococcus(0.07%)。后酵30 d占主要比例的前5 个属为Bacillus(65.91%)、Lelliottia(19.49%)、Tetragenococcus(5.53%)和Lactococcus(2.13%)。后酵60 d占主要比例的5 个属为Lactococcus(20.10%)、Lelliottia(14.88%)、Acinetobacter(12.06%)、Tetragenococcus(10.77%)和Bacillus(10.21%)。Bacillus菌落丰度随发酵进行降低,逐渐由优势菌群演变为平均优势菌群。Acinetobacter在后酵前中期所占比例较小,在后酵后期所占比例迅速升高。chloroplast在红腐乳后酵前期和后期均有发现,而在后酵中期未检测到chloroplast的存在或所占比例极小。Lactococcus、Tetragenococcus、Enterobacter、Enhydrobacter、泛生菌(Pantoea)、巨球菌(Macrococcus)、明珠球菌(Leuconostoc)等在后酵中期和后期均有体现,但是这些菌属在后酵后期的比例高于中期。
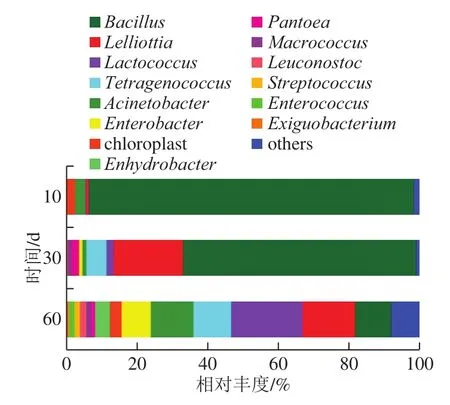
图 6 后酵期红腐乳菌群相对丰度Fig. 6 Bacterial abundance in post-fermented red sufu
2.8 后酵期红腐乳氨基酸与菌群关联分析
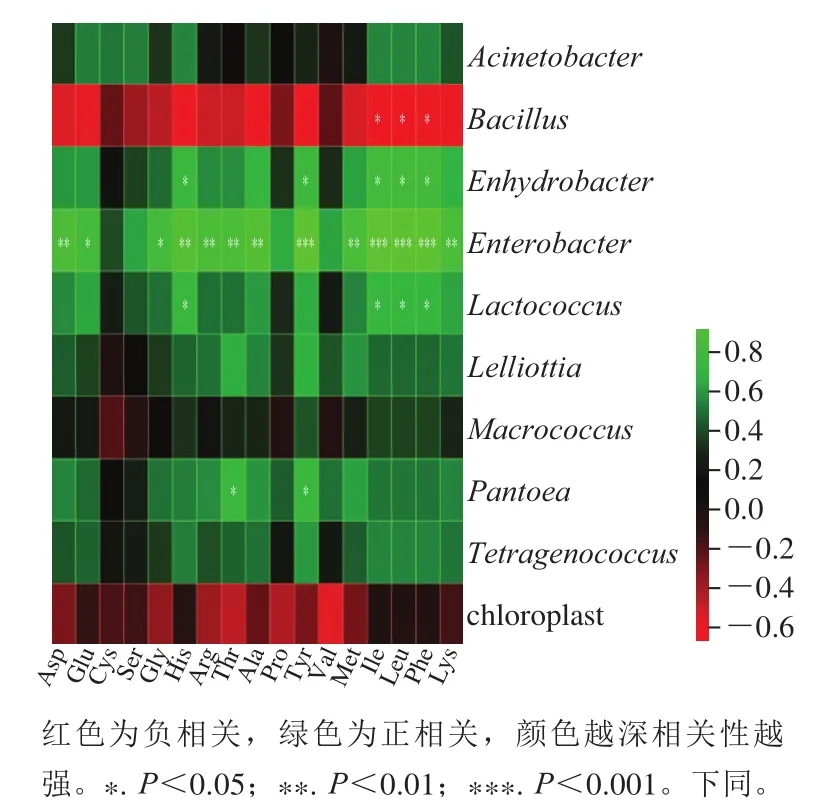
图 7 后酵期红腐乳菌群游离氨基酸相关性热图Fig. 7 Heat map showing the correlation between free amino acids and bacterial community in post-fermented red sufu
由图7可知,Enterobacter在后酵期发酵过程中与Lys、Phe等大部分氨基酸呈显著正相关。该菌在后酵过程中不断生长,在后期占据主导位置。Enterobacter与大多数氨基酸和氮化合物显著正相关,使样品中氨基氮浓度逐渐升高(图2C)。发酵大豆制品中蛋白质水解为氨基酸是提高风味和口感的重要过程[3]。Bacillus在红腐乳后酵阶段与部分氨基酸呈负相关,这说明Bacillus和后酵期红腐乳氨基酸并不是单一的线性关系,这与文献[26]中Bacillus发酵豆制品大幅度提高游离氨基酸浓度,Thr、Glu和Ala增幅最为明显有所不同。Bacillus在红腐乳后酵阶段由优势菌群逐渐变成弱势菌群(图6),菌群丰度显著下降。而在后酵过程中氨基酸含量不断升高(表2),这表明在红腐乳后酵阶段所产生的丰富氨基酸是由除Bacillus与多种菌属,如Enhydrobacter、Enterobacter、Lactococcus等共同作用产生的,Bacillus前期丰度过高抑制其他菌种的生长,这使得后酵期红腐乳中部分氨基酸与Bacillus呈负相关。虽然Bacillus丰度降低,比例减少,但Bacillus的菌数依然很高,所以在后酵阶段Bacillus与其他菌种协调作用提升红腐乳的风味和口感。chloroplast与后酵期红腐乳氨基酸含量相关性不显著。
2.9 后酵期红腐乳挥发性风味物质与菌群关联分析
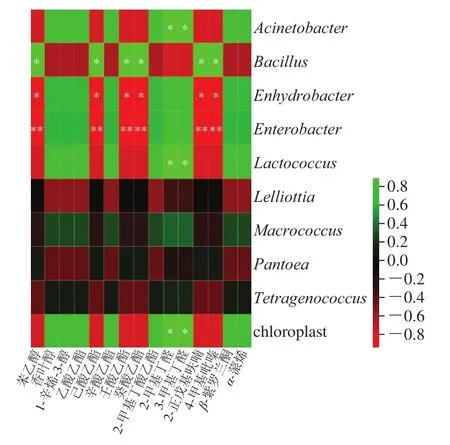
图 8 后酵期红腐乳菌群挥发性风味物质相关性热图Fig. 8 Heat map showing the correlation between volatile flavor substances and bacterial community in post-fermented red sufu
经OAV计算得到15 种风味影响较大的挥发性化合物与后酵期红腐乳中前10 种菌群关联分析得到图8。通过热图分析可知,Acinetobacter、Bacillus、Enterobacter、Lactococcus和chloroplast与红腐乳中主要挥发性风味物质相关联。Bacillus与多种酯类化合物显著正相关,其中己酸乙酯与Bacillus显著正相关(R=0.88,P=0.018)。该菌还可以产生己酸乙酯,这是中国白酒中的一种重要风味化合物[27];Bacillus对4-甲基吡嗪的含量有一定的影响(R=0.84,P=0.012),已被证明可以分泌各种酶和风味化合物提高四甲基吡嗪产量[28];该菌也与苯乙醇(R=0.88,P=0.018)、2-正戊基呋喃(R=0.86,P=0.016)呈显著正相关。Acinetobacter与部分酯类如辛酸乙酯(R=0.77,P=0.072)为主的风味化合物呈正相关,这与其含有丰富的酯水解酶,促进辛酸乙酯的合成有关[29]。醛类物质2-甲基丁醛(R=0.88,P=0.020)、3-甲基丁醛(R=0.68,P=0.015)与Lactococcus显著正相关。2-甲基丁醛、3-甲基丁醛是切达干酪中坚果味的主要来源,由于乳链球菌(原乳酸链球菌变种)在生长过程中具有高效生产此类醛的特性[30]。Enterobacter与大部分香味物质呈显著负相关。
3 结 论
本研究通过顶空固相微萃取-气相色谱-质谱联用技术、反相高效液相色谱和OPA柱前衍生化紫外检测相结合的方法,对腐乳中挥发性风味物质及氨基酸含量进行检测分析,检测出50 种后酵期红腐乳中的挥发性风味物质、17 种游离氨基酸,其中苯乙醇、乙酸乙酯2-正戊基呋喃等为后酵期红腐乳中主要风味物质。与此同时采用高通量测序法分析细菌菌落,发现后酵期红腐乳菌群随发酵进行不断丰富,Bacillus、Acinetobacter、Enterobacter、Tetragenococcus为后酵期红腐乳中的优势菌群。对游离氨基酸、部分挥发性风味物质与菌群进行Pearson相关性分析,发现后酵期红腐乳丰富的营养物质和挥发性风味物质的产生,与其随发酵进行而不断丰富的菌群紧密相关,多种菌协调作用共同构建了红腐乳的独特风味。各种菌的发酵演替特性与风味物质形成的关联性将进一步研究,该研究结果为提升腐乳风味品质和改良腐乳传统制造工艺提供了数据基础。
