不同包装方式对高水分含量肉粉肠微生物菌群及品质特性的影响
2021-03-31李其轩孔保华
李其轩,陈 倩,王 浩,孔保华
(东北农业大学食品学院,黑龙江 哈尔滨 150030)
高水分含量的熏煮肉粉肠是我国北方传统肉制品,因为淀粉含量较高、肉色粉嫩而得名,该产品兼具肉的香气和糖熏风味,备受人们喜爱。肉粉肠水分含量较高,而且通常在室温下散装销售,运输也是在相对开放式的环境中,因此易腐败变质,对其保鲜进行研究具有重要意义。
低温肉制品在世界范围内广受欢迎,如法兰克福香肠和培根等[1-2],其是指通过熏、煮、蒸、烤等热处理,使中心温度达到75 ℃的肉制品,能够较好地保持产品原有营养、风味和品质。但由于热处理温度低、时间短,一些微生物无法被完全杀灭,残留微生物会在贮藏期间大量繁殖,造成产品腐败,严重影响了商业价值,近年来低温肉制品的保鲜成为研究的热点和焦点[3]。肉粉肠采用的熟制温度较低,属于低温肉制品的范畴。
目前,真空包装是肉制品常用的包装方式[4],通过真空包装可以降低含氧量,延缓需氧微生物的生长以及脂肪、蛋白质的氧化,且不会影响产品原有品质[5]。张培旗等[6]研究发现经过真空包装的酱猪蹄菌落总数、挥发性盐基氮含量和感官评价结果要远远好于普通托盘包装,产品的外形、色泽和风味都保持较好。杨文婷等[7]进一步研究发现包装材料和杀菌温度会影响真空包装的效果,使用厚度为0.20 mm、透氧率为0.077 mL/(m2·d)的聚酰胺/聚乙烯袋,包装后在80 ℃下杀菌30 min可以最大限度延长手抓羊肉的货架期并保障其品质。
尽管近年来国内外已有一些研究报道了不同包装方式对肉制品品质的影响,但关于不同包装方式对低温熏煮高水分含量肉粉肠品质影响的研究鲜见报道。因此,本实验主要研究在20 ℃条件下,托盘包装和真空包装对高水分含量肉粉肠微生物菌群变化和品质特性的影响。主要测定指标包括菌落总数、pH值、水分含量、水分活度、硫代巴比妥酸反应物(thiobarbituric acid reactive substances,TBARS)值、质构特性和感官品质等,并通过16S rDNA扩增子测序技术分析不同包装方式肉粉肠中的主要腐败菌,探讨不同包装方式影响肉粉肠品质的原因。
1 材料与方法
1.1 材料与试剂
猪前腿肉(瘦肉)、背部膘(肥肉)、食盐、味素、绵白糖、生姜、葱、花椒粉、大料、香油 哈尔滨比优特超市;绿豆淀粉 哈尔滨哈达淀粉有限公司;红曲红色素 广东科隆生物科技有限公司;乳化剂哈尔滨康源食品原料有限公司;卡拉胶 烟台精协海洋科技发展有限公司。
平板计数琼脂 青岛高科园海博生物技术有限公司;氯化钾、硫代巴比妥酸、三氯乙酸、氯仿(均为分析纯)国药集团化学试剂沈阳有限公司。
1.2 仪器与设备
HWS-70BX恒温恒湿箱天津市泰斯特仪器有限公司;AL-104型精密电子分析天平北京赛多利斯仪器系统有限公司;高压蒸汽灭菌锅上海申安医用仪器厂;ZHJH-1109超净工作台上海智城分析仪器制造有限公司;SPX-250B-D型振荡培养箱上海博迅实业有限公司;DELTA 320 pH计 梅特勒-托利多仪器(上海)设备有限公司;DHG-9000电热恒温鼓风干燥箱上海一恒科学仪器有限公司;AQUALAB Pre台式水分活度仪美国Decagon Devices公司;DK-8B水浴锅 余姚市东方电工仪器厂;GL-21M高速冷冻离心机 湖南湘仪实验仪器开发有限公司;TU-1800 紫外-可见光分光光度计北京普析通用仪器有限公司;TA.XT Plus型质构仪英国Stable Micro Systems公司;PEN3便携式电子鼻气味分析仪 德国AIRSENSE公司。
1.3 方法
1.3.1 高水分含量肉粉肠的制备

表 1 高水分含量肉粉肠配方Table 1 Formulation of starch-meat sausages with high moisture content
高水分含量肉粉肠加工配方见表1。原料肉去除结缔组织,瘦肉与猪背膘搅碎后混合备用,三分之一的绿豆淀粉用85~90 ℃的开水预糊化,其余绿豆淀粉用温水化开,将肉、淀粉及全部添加剂混合并搅拌均匀制成肠馅,灌入洗净的猪小肠肠衣中,打结系紧后于85 ℃条件下水煮30 min,捞出后糖熏3 min(将铁锅先烧热,然后加入40 g白砂糖,待砂糖熔化后将肉粉肠置于一个铁架上,悬空置于锅内、盖盖),冷却至室温后进行包装。肉粉肠直径为3 cm、长度15 cm,共制备200 根,分为2 组,每组100 根,一组放置于托盘中,并覆盖一般透气性的高密度聚乙烯膜(托盘包装组),另一组放置于普通真空袋后抽真空;置于(20±1)℃、相对湿度60%避光条件下贮藏。每个贮藏时间每组取出10 根样品,其中7 根用于理化和微生物指标的测定,3 根用于感官评定。
1.3.2 菌落总数的测定
菌落总数参照GB/T 4789.2—2016《食品安全国家标准 食品微生物学检验 菌落总数测定》进行测定。
1.3.3 16S rDNA扩增子测序
细菌总DNA的提取参照Hu Yingying等[8]的方法,采用十六烷基三甲基溴化铵 (cetyltrimethylammonium ammonium bromide,CTAB)法,提取后的DNA利用质量分数1%的琼脂糖凝胶电泳检测其纯度和浓度,并使用无菌水稀释样品至1 ng/μL。对细菌的16S rDNA V4区段进行聚合酶链式反应(polymerase chainreaction,PCR)扩增,上游引物为5 1 5 F(5’-GTGCCAGCMGCCGCGGTAA-3’),下游引物为806R(5’-GGACTACHVGGGTWTCTAAT-3’)。PCR
体系共30 μL,其中Phusion Master Mix 15 μL、DNA模板10 μL、上下游引物各1.5 μL、灭菌ddH2O 2 μL。PCR程序为98 ℃预变性1 min,随后30 个循环(98 ℃变性10 s;50 ℃退火30 s;72 ℃延伸30 s),最后72 ℃延伸5 min。
PCR产物经质量分数2%的琼脂糖胶电泳纯化后割胶回收目标条带。产物纯化后由TruSeq DNA PCR-Free Library Preparation Kit建试剂盒构建文库,经过Qubit荧光和实时荧光定量PCR分析合格后,基于Illumina NovaSeq测序平台进行测序。下机后原始数据经过过滤得到高质量数据,对其进一步截取、过滤并去除嵌合体序列后得到有效数据,对所有样本的全部有效数据以97%的一致性进行可操作分类单元(operational taxonomic units,OTUs)聚类和物种分析,通过物种注释及丰度分析微生物菌群结构。
1.3.4 pH值的测定
pH值参照GB/T 9695.5—2008《肉与肉制品pH测定》进行测定。
1.3.5 水分含量及水分活度的测定
水分含量参照GB 5009.3—2010《食品安全国家标准食品中水分的测定》进行测定,水分活度利用水分活度仪测定。
1.3.6 TBARS值的测定
TBARS值测定参照Hu Yingying等[9]的方法,并作适当的修改。准确称取2.5 g样品放入试管中,加入1.5 mL 1 g/100 mL的硫代巴比妥酸溶液、8.5 mL体积分数2.5%三氯乙酸-盐酸溶液,混匀后沸水浴中反应30 min,冷却,取5 mL样品加入等体积的氯仿,1 800×g离心10 min,取上清液测定532 nm波长处的吸光度。TBARS值以每千克样品中所含丙二醛的质量表示,具体按下式计算。

式中:V为样品液体积(10 mL);M为TBARS的摩尔质量(144.15 g/mol);m为称量样品的质量/g;l为光程(1 cm);ε为摩尔消光系数(152 000 L/(mol·cm))。
1.3.7 质构特性的测定
使用探头为P/2探头,探头直径为2.00 mm,采用Two Deformation Test程序,包含两段运行程序,每个样品进行6 次平行,每个处理测定3 个样品。
质构仪参数:测试前速率为1.50 mm/s,第一段下压距离为2.00 mm,测试速率为5.00 mm/s,时间为30 s,测后速率为10.00 mm/s;第二段为穿刺,刺入深率为70%,测试速率为5.00 mm/s。
1.3.8 电子鼻检测气味
采用顶空固相微萃取进行气味的萃取。准确称取3 g切碎后的样品置于顶空密封瓶中,测定前在50 ℃水浴中加热45 min,使其顶部空间挥发性物质达到平衡状态,测试时直接将带有0.45 μm水相滤膜的进样针头插入顶空瓶,用便携式电子鼻气味分析仪进行测定,每个样品进行3 次平行,每个处理重复3 次。
电子鼻检测参数:采样时间间隔1 s/组;传感器自清洗时间100 s;传感器归零时间10 s;样品准备时间为3 s;进样流量300 mL/min;实验分析测试时间为60 s。
1.3.9 感官评价
感官评定由10 人组成,对不同实验组肉粉肠进行感官评定,采用双盲法进行检验。肉粉肠切成3 mm的薄片,采用评分法,每项指标最低分为1 分,最高分为7 分,分别为气味(1 分=有腐败气味,7 分=产品特有香味)、滋味(1 分=有腐败滋味,7 分=产品特有滋味)、组织状态(1 分=松散无弹性,7 分=致密有弹性)、整体可接受性(1 分=极差,7 分=极好)。
1.4 数据处理分析
所有实验指标测定重复3 次,结果表示为平均值±标准差。数据统计分析采用Statistix 8.1软件包中Linear Models程序进行,差异显著性分析使用Tukey HSD程序,P<0.05表示差异显著。采用Sigmaplot 12.5软件绘图,电子鼻结果和主成分分析采用SPSS软件处理。
2 结果与分析
2.1 不同包装方式对肉粉肠贮藏期间菌落总数的影响

图 1 托盘包装和真空包装肉粉肠贮藏期间菌落总数的变化Fig. 1 Changes in total bacterial counts in tray-package and vacuum-packaged starch-meat sausages during storage
如图1所示,贮藏期间两种包装方式的肉粉肠菌落总数均呈显著上升趋势(P<0.05),且同一贮藏时间托盘包装组的菌落总数显著高于真空包装组(P<0.05)。贮藏8 d 时真空包装和托盘包装的细菌总数分别为5.50(lg(CFU/g))和7.69(lg(CFU/g))。按照GB 2726—2016《食品安全国家标准 熟肉制品》的规定,熟肉制品菌落总数不得超过5.00(lg(CFU/g))。肉粉肠初始细菌总数为2.84(lg(CFU/g)),托盘包装组和真空包装组分别于第4天(4.55(lg(CFU/g)))和第6天(4.67(lg(CFU/g)))临近该数值,分别在第8天(7.69(lg(CFU/g)))和第12天(6.93(lg(CFU/g)))时已严重腐败。该结果说明真空包装中细菌增殖速度慢于托盘包装,可以使货架期延长2 d。目前市场上高水分含量肉粉肠多以托盘包装销售,在20 ℃的条件下,贮藏期通常为1~2 d,经真空包装处理后可达到3~4 d,本实验中肉粉肠货架期略长于市售产品,可能是由于实验中卫生条件把控更为严格,也没有运输、销售、贮藏等复杂流通环节,因此初始菌落总数较低。Dong Chunhui等[10]对比20 ℃时真空包装和托盘包装哈尔滨红肠的菌落总数,发现在第12天实验结束时,真空包装组的菌落总数显著低于托盘包装组(P<0.05);Chen Yuewen等[11]的研究也得到相似的结果。Woraprayote等[12]认为低氧的环境能抑制需氧菌,且有利于乳酸菌等厌氧和兼性厌氧细菌的生长,乳酸菌产生的细菌素也可能进一步抑制其他细菌的生长。本研究中托盘包装组可能以好氧菌为主,真空包装组则以厌氧或兼性厌氧菌为主,这可能是导致真空包装组菌落总数相对较低的原因。
2.2 微生物菌群结构分析结果
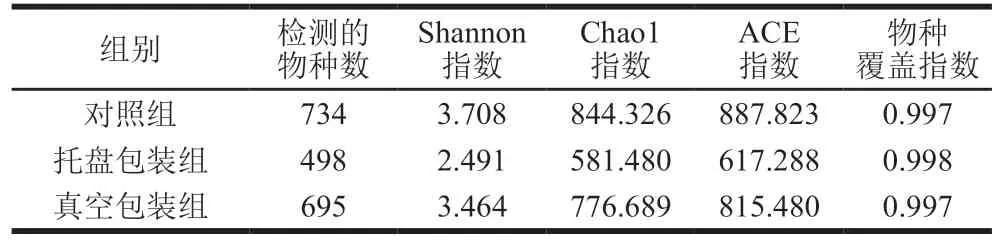
表 2 不同包装方式的肉粉肠腐败前后微生物菌群Alpha多样性指数Table 2 Alpha diversity indices of bacterial community in starch-meat sausages stored in different packages
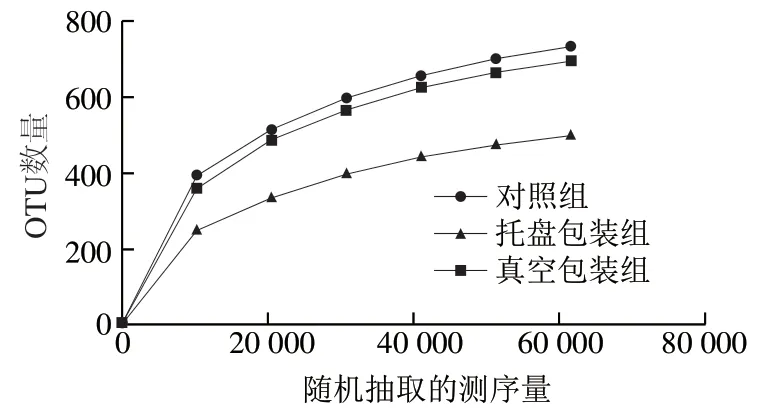
图 2 肉粉肠中微生物多样性测定的稀释曲线Fig. 2 Rarefaction curves for microbial diversity in starch-meat sausages
16S rDNA扩增子测序技术是研究微生物群落组成结构的重要手段[13-14],近年来逐渐应用在食品和肉制品的研究中[15-16]。本研究以第0天的样品为对照组,与严重腐败后的样品对比,探究不同包装方式的肉粉肠腐败前后微生物菌群物种多样性和相对丰度的变化。可以通过Alpha多样性指数对微生物物种丰富度和均匀度进行评估。如表2所示,所有样品的物种覆盖指数均高于0.997,说明所建立的文库科学有效,能反映肉粉肠中微生物的多样性[17],检测的物种数、Chao1指数、Shannon指数和ACE指数均为对照组>真空包装组>托盘包装组,表明对照组的菌群丰度和菌群多样性最高[18],与之相比,真空包装组小幅度降低,托盘包装组则明显低于其他两组。稀释曲线是依据测序量与对应物种数目构建的,如图2所示,随着测序量增加,对照组、托盘包装组和真空包装组的OTU曲线都趋于平坦,说明新检测到的菌群物种数量越来越少,测序深度科学合理。
物种相对丰度柱形累加图可以直观体现每组样品属(图3 A)和种(图3 B)水平上相对丰度排名前10的物种及其比例。对照组在属水平上蓝藻细菌(Cyanobacteria)相对丰度最高,但由于菌落总数较低,因此实际含量并不高,加之该细菌在处理组中几乎不存在,因此表明其不是引起腐败的腐败菌。除此之外,芽孢杆菌属(Bacillus)、魏斯氏菌属(Weissella)和乳杆菌属(Lactobacillus)相对丰度高于其他菌属。种水平的结果则表明初始菌相中相对丰度最高的是贝莱斯芽孢杆菌(Bacillus velezensis)(8.27%)和绿色魏斯氏菌(Weissella viridescens)(3.22%),其他细菌丰度不足1%。这些都是低温熏煮处理未能完全杀灭的残留细菌,其实际含量均处于较低的水平。腐败后,托盘包装组属水平上芽孢杆菌属(Bacillus)是优势菌属,通过种水平分析确定主要是贝莱斯芽孢杆菌(Bacillus velezensis)(34.57%);真空包装组中魏斯氏菌属(Weissella)和乳杆菌属(Lactobacillus)相对丰度最高,种水平分析进一步确定为绿色魏斯氏菌(Weissella viridescens1)(4.81%)和清酒乳杆菌(Lactobacillus sakei)(13.78%),此外贝莱斯芽孢杆菌(Bacillus velezensis)相对丰度为2.65%,也明显高于其他细菌,可以认为其对肉粉肠的腐败也产生了一定作用。

图 3 肉粉肠微生物属(A)和种(B)水平相对丰度柱形累加图Fig. 3 Histograms of relative abundance of microorganisms at the genus (A) and species (B) levels in starch-meat sausages
三元相图能进一步反映不同组在属和种水平上优势物种的差异,相对丰度排名前10的物种的三元相图见图4,可以发现各组之间优势物种差异明显。在属水平上相对丰度较高的菌属是蓝藻细菌(Cyanobacteria)、芽孢杆菌属(Bacillus)、魏斯氏菌属(Weissella)和乳杆菌属(Lactobacillus),其中蓝藻细菌(Cyanobacteria)几乎完全分布在对照组中,与柱形图结果一致,说明该菌属在腐败过程中没有繁殖,不是腐败菌,另外3 种菌属主要分布在两个处理组中。种水平上相对丰度较高的是贝莱斯芽孢杆菌(Bacillus velezensis)、绿色魏斯氏菌(Weissella viridescens)和清酒乳杆菌(Lactobacillus sakei)。它们在对照组中所占比例极低,贝莱斯芽孢杆菌(Bacillus velezensis)主要分布在托盘包装组,绿色魏斯氏菌(Weissella viridescens)和清酒乳酸杆菌(Lactobacillus sakei)主要分布在真空包装组中,这与图3的分析结果吻合。

图 4 肉粉肠微生物属(A)和种(B)水平相对丰度三元相图Fig. 4 Ternaryplot of relative abundance of microorganisms at the microbial genus (A) and species (B) levels in starch-meat sausages
以上结果说明腐败后样品的主要腐败菌来源于初始菌相,托盘包装组的主要腐败菌是贝莱斯芽孢杆菌,其在有氧条件下能够快速繁殖,并产生具有广谱抗菌活性的物质[19],如抗菌蛋白[20]、脂肽[21]、细胞壁降解酶[22]、NH3[23]、嗜铁素和蛋白酶[24]等,因此本实验中托盘包装组菌种多样性大幅降低。另外,芽孢杆菌是肉制品中常见的腐败菌,在腐败的低温熏煮香肠[25]、法兰克福香肠[26]和红肠[27]等肉制品中都曾发现主要腐败菌包含芽孢杆菌属。也有一些研究将腐败菌鉴定至种水平,如陈晓[28]的研究表明室温条件下腐败的热狗肠中主要腐败菌是枯草芽孢杆菌和地衣芽孢杆菌。潘晓倩等[29]发现25 ℃托盘贮藏条件下腐败的乳化香肠,其主要腐败菌是枯草芽孢杆菌、解淀粉芽孢杆菌和凝结芽孢杆菌等共9 种芽孢杆菌。这些研究结果都与本实验的菌相结论相似,说明不同的肉制品中芽孢杆菌的种类可能存在差异,高水分含量肉粉肠可能因为绿豆淀粉和水的含量较高而导致芽孢杆菌种类的不同。真空包装组的主要腐败菌是绿色魏斯氏菌和清酒乳杆菌,此外还伴有少量贝莱斯芽孢杆菌,这是因为低氧条件利于兼性厌氧的绿色魏斯氏菌和清酒乳杆菌生长[15],不利于贝莱斯芽孢杆菌生长。目前绿色魏斯氏菌被很多学者认为是造成低温肉制品货架期缩短的主要腐败菌[30]。丁珊珊[31]和Han Yanqing[32]等均发现绿色魏斯氏菌是真空包装西式火腿的主要腐败菌;徐雅梦等[33]在真空低温酱牛肉中发现绿色魏斯氏菌为优势腐败菌。真空包装样品存在的另一种主要腐败菌清酒乳杆菌也在低温肉制品中常见,俞龙浩等[34]的研究表明清酒乳杆菌是真空包装红肠中的主要腐败菌之一。
2.3 包装方式对肉粉肠贮藏期间理化指标的影响

表 3 托盘包装和真空包装肉粉肠贮藏期间理化指标的变化Table 3 Changes in physicochemical indexes of tray-packaged and vacuum-packaged starch-meat sausages during storage
如表3所示,托盘包装组的pH值先由初始的6.13显著下降至2 d时的5.87(P<0.05),然后又呈现上升趋势,到第8天时升高到6.17。真空包装组的pH值在贮藏过程中始终在下降(P<0.05),第6天达到5.80,第12天严重腐败时降至4.88。托盘包装组前期pH值下降主要是因为乳酸菌分解碳水化合物产酸,蛋白质氧化产生的羰基化合物也能继续氧化生成酸类物质[35];后期pH值的升高主要是因为贝莱斯芽孢杆菌大量繁殖产生的蛋白酶使蛋白质分解生成碱性的胺类等物质。真空包装组pH值始终下降则是因为真空条件更利于绿色魏斯氏菌和清酒乳杆菌的繁殖和代谢,分解淀粉等糖类物质生成乳酸等有机酸。
在贮藏期间肉粉肠的水分含量和水分活度略有下降,但变化不显著(P>0.05),两项指标始终保持在较高水平,这有利于大部分微生物的生长繁殖。该结果与贮藏环境有一定的关系,但更主要是因为添加了大量绿豆淀粉和水分,产品含水量高。余永名等[36]通过持水性实验、蒸煮实验验证了添加10%的绿豆淀粉后,肉糜不易移动水占凝胶总水分含量的90%以上,低场核磁共振T23的结果进一步表明添加绿豆淀粉能够显著减弱凝胶中不易移动水的流动,使肉糜具有很好的持水性。本实验中绿豆淀粉的添加量为40%,这是水分含量和水分活度波动较小的重要原因。
贮藏过程中两组样品的TBARS值均没有显著变化(P>0.05),这与孟少华[37]的实验结果相符。这是因为肉粉肠中脂肪的含量较低且贮藏时间较短,因此没有发生明显的脂肪氧化。徐梅[38]在香肠中接种清酒乳杆菌,发现其可以延缓脂肪及蛋白的氧化,肉粉肠中的清酒乳杆菌含量较高可能也是导致TBARS值变化不显著的原因之一。
2.4 包装方式对肉粉肠贮藏期间质构特性的影响

表 4 托盘包装和真空包装肉粉肠贮藏期间质构特性的变化Table 4 Changes in textural properties of tray-packaged and vacuum-packaged starch-meat sausages during storage
如表4所示,托盘包装组和真空包装组的硬度、回复性、弹性、咀嚼性、致密性、破壁力随贮藏时间延长整体呈现降低的趋势,但在贮藏中期才开始显著降低(P<0.05),这是因为此时腐败菌积累到一定数量,大量分解蛋白质与淀粉使肠体和肠衣腐烂。在各自贮藏期结束时,真空包装组的硬度、回复性、弹性、咀嚼性、致密性、破壁力均优于托盘包装组,说明真空包装可以延缓肉粉肠品质的劣化。另外,绿豆淀粉的直链淀粉比例较高,易发生老化回生[39],所以两组样品贮藏初期硬度、弹性都有小幅度上升的现象。
2.5 包装方式对肉粉肠贮藏期间感官品质的影响
如表5所示,滋味方面,在菌落总数超标前,两组样品得分略有下降但变化不显著(P>0.05),在各自菌落总数超标后无法入口评价;气味方面,两组样品的得分一直呈下降趋势,且各组贮藏后期显著下降(P<0.05),托盘包装组和真空包装组分别于第4、6天出现明显的腐败气味,托盘包装组第8天时得分最低,为1.50 分,低于同一时间真空包装组的4.73 分,也低于第12天时真空包装组的2.59 分,这表明托盘包装组腐败气味更浓重,感官上更难接受;组织状态方面,真空包装组得分无显著变化(P>0.05),托盘包装组前4 d得分没有显著变化(P>0.05),但之后的得分显著降低(P<0.05),说明托盘包装组腐烂更严重,肉粉肠结构松散失去弹性;两组样品的总体可接受性在腐败前无显著变化(P>0.05),但腐败后得分显著降低(P<0.05),尤其是托盘包装组,说明腐败对肉粉肠的感官质量影响很大。

表 5 托盘包装和真空包装肉粉肠贮藏期间感官评价结果Table 5 Sensory evaluation of tray-packaged and vacuum-packaged starch-meat sausages during storage
2.6 肉粉肠气味的电子鼻分析结果
电子鼻借助传感器感知味道,每根传感器对一类特征气体有强烈的响应(表6),可以通过主成分分析和传感器载荷分析了解样品区分情况以及哪类气味起到主要区分的作用。以第0天的样品为对照组,根据菌落总数和感官指标选择托盘包装第6、8天的样品和真空包装第10、12天的样品为不同腐败阶段的代表。如图5所示,PC1和PC2共解释了原始变量88.24%的信息,图5A中每一组样品可以被完整区分,说明它们的的挥发性气味有显著差异。托盘包装第0天和第6天的样品位于一、四象限内且相似度较高,而第8天的样品区别于前两者,起到区分作用的是代表氮氧化合物的W5S传感器和代表硫化物的W1W传感器,这是因为蛋白质分解并生成了胺类等含氮有机物和含硫化合物。真空包装第0天的样品位于第一、四象限,而第10、12天的样品也表现出明显的差异,第10天分布于第二象限,第12天分布于三、四象限,起区分作用的是W1S、W2S、W2W、W3S传感器,说明检测到了甲烷、乙醇、羰基、有机硫化物和烷烃等物质。羰基是羧酸及其衍生物、酮等官能团的组成部分,因此说明可能的挥发性风味物质包括酸类、酯类、酮类、醇类、碳氢化合物和硫化物等。产酸主要与绿色魏斯氏菌、清酒乳杆菌有关,硫化物可能是少量贝莱斯芽孢杆菌分解蛋白质后产生的。丁珊珊等[31]用气相色谱-质谱检测接种了绿色魏斯氏菌的真空火腿,发现腐败后酸类、酯类、酮类的含量显著增加,醇类、醛类和碳氢化合物也有检出,因此其余气味物质与绿色魏斯氏菌的代谢有关。

表 6 电子鼻传感器性能描述Table 6 Performance description of electronic nose sensors

图 5 基于PC1和PC2的肉粉肠气味主成分分析平面图Fig. 5 Principal component analysis (PCA) score and loading plots of PC1 versus PC2 for odorant composition of starch-meat sausages
2.7 肉粉肠品质特性的主成分分析结果
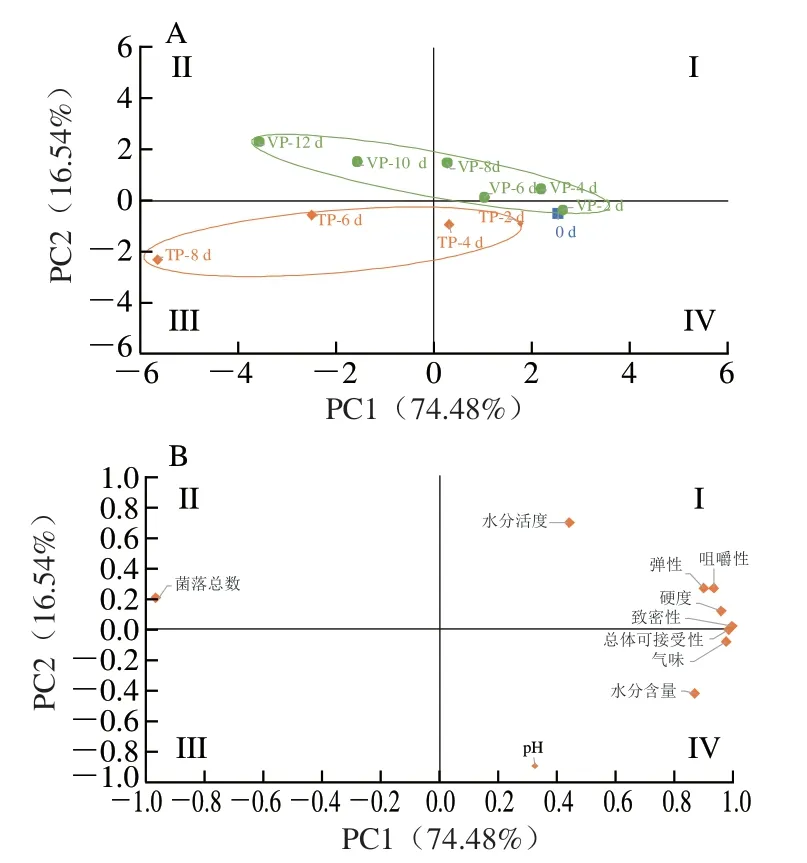
图 6 基于PC1和PC2的肉粉肠品质特性主成分分析平面图Fig. 6 PCA score and loading plots of PC1 versus PC2 for sensory,microbial, physicochemical and texture properties of starch-meat sausages
参照Han Qi等[40]的方法,本研究以肉粉肠的品质指标为变量,用主成分分析建立不同包装方式与变量之间的相关性,得到每一变量对样品区分的贡献率。如图6所示,PC1和PC2共解释了原始变量91.02%的信息,说明各变量之间相关性很强。PC1几乎涵盖了所有指标,其与水分含量、气味、总体可接受性、硬度、致密性、弹性和咀嚼性呈正相关,与菌落总数呈负相关,前文的结果也表明菌落总数的增加使肉粉肠的腐败加剧,对质构特性、感官质量和气味均有影响。托盘包装的样品与真空包装的样品分布间隔较远,说明不同包装方式的样品能被显著区分(P<0.05),且贡献最大的是菌落总数和pH值,前文的结果也表明托盘包装和真空包装样品的菌落总数和pH值变化规律不同,这是因为两组样品的主要腐败菌不同,因此微生物增殖速率和代谢产物都有所差异。
3 结 论
本实验研究了在20 ℃贮藏条件下,真空包装和托盘包装对高水分含量肉粉肠微生物菌群和品质的影响。结果表明,产品的初始水分含量达到70.30 g/100 g,水分活度为0.984,两种包装方式对产品TBARS值、水分含量和水分活度无显著影响。20 ℃条件下贮藏时,托盘包装组菌落总数于4 d时接近国家标准上限5.00(lg(CFU/g)),8 d时严重腐败,达到7.69(lg(CFU/g)),主要腐败菌是贝莱斯芽孢杆菌,能分解蛋白质产生胺类等物质,pH值先显著下降后上升,并产生氮氧化合物和硫化物的气味,对肠体和肠衣破坏严重,产品质构发生严重的劣变,感官质量下降。而真空包装组菌落总数于6 d时接近国家标准上限,比托盘包装组保质期延长了2 d,产品在12 d时严重腐败,达到6.93(lg(CFU/g)),主要腐败菌是绿色魏斯氏菌和清酒乳杆菌,消耗淀粉和其他碳水化合物产生乙酸和乳酸,因此使pH值显著下降,并生成明显的酸味;真空包装组质构特性结果优于托盘包装组,在第8天产品仍有较好的可接受性。综上,高水分含量肉粉肠在20 ℃条件下贮藏的过程中,真空包装和托盘包装产品的微生物菌群和品质变化有很大的差异。本实验为进一步研究高水分含量的肉制品品质保持和定向抑菌提供了一定的理论参考。
