巴马长寿特征饮食模式对自然衰老小鼠的抗衰老效果
2021-03-31黄燕婷梅丽华潘海博覃璐琪饶川艳聂梦琳朱雯君李全阳
黄燕婷,梅丽华,潘海博,覃璐琪,饶川艳,聂梦琳,朱雯君,李全阳
(广西大学轻工与食品工程学院,广西 南宁 530004)
衰老是一个复杂的分子和细胞衰退的多因素过程,随着时间的推移,机体组织功能会下降,容易生病和死亡[1]。影响衰老的因素有个体遗传因素和外部环境因素[2],其中饮食是外部环境因素中最重要的部分[3]。
合理饮食与健康长寿的关系密切,据文献报道,坚持地中海饮食可以改善微血管功能[4],降低糖尿病[5]、心血管疾病、癌症和退行性疾病的发生率[6],还可改善认知能力[7]。Takeda等调查发现日本百岁老人对肉类、鱼类、谷物和脂肪油的摄入量更低[8]。通过饮食干预延缓衰老是目前研究抗衰老的一项有力手段。对比单一营养素,复合营养素能更好地起到延缓小鼠衰老的作用[9]。目前对于抗衰老效果的研究,多采用D-半乳糖衰老模型小鼠,而采用自然衰老小鼠验证抗衰老效果的研究较少,据报道D-半乳糖衰老模型小鼠与自然衰老小鼠的生化结果存在一定的差异[10]。目前普遍认为自然衰老模型小鼠在神经系统、机体结构及行为上更接近人,其更适合作为研究的对象[11]。
本课题组前期对巴马长寿区饮食特征及长寿现象进行研究发现,巴马长寿区饮食是一种以粥类、粗杂粮类等食物为主的膳食纤维多糖饮食模式[12],具有低能量、低脂肪、低胆固醇、高膳食纤维、高VA的特征[13],在此基础上,宋奇等[14]设计了能限组、胡豆组、纤维组、元素组和复合组饮食这5 种饮食模式,用D-半乳糖致衰老小鼠进行验证,发现复合组饮食模式抗衰老效果最为显著。兰海静等[15]进一步将巴马长寿区饮食特点与特色益生菌合并,设计了4 种巴马特色饮食模式,并用D-半乳糖致衰老小鼠进行验证,结果发现巴马饮食模式II、III能显著改善衰老小鼠的运动水平和抗焦虑能力。为了探寻效果更好的巴马长寿特征饮食模式,并扩大范围研究其对年轻小鼠及自然衰老小鼠的抗衰老效果。本实验通过凝练前期研究结果,进一步优化了膳食纤维、β-胡萝卜素、番茄红素、益生菌以及能量限制参数,设计了两种优化的巴马长寿特征饮食模式,并分别采用年轻小鼠和自然衰老小鼠来验证这两种模式的抗衰老效果,以期为新饮食模式的具体应用提供更加完善的依据。
1 材料与方法
1.1 动物、材料与试剂
36 只3 月龄SPF级昆明小鼠(雌雄各半,体质量(36±3)g)和36 只15 月龄SPF级自然衰老的昆明小鼠(雌雄各半,体质量(41±3)g)均购自广西医科大学(生产许可证号:SCXK(桂)2014-0002),饲养温度(24±2)℃、相对湿度(60±10)%,12 h昼夜交替,每日喂食4 g饲料[16],自由饮水。
基础饲料(符合GB 13078—2017《饲料卫生标准》和GB 14924.3—2010《实验动物 配合饲料营养成分》)北京科澳协力饲料有限公司。
低聚木糖 山东龙力生物科技股份有限公司;低聚果糖、低聚异麦芽糖 山东百龙创园生物科技股份有限公司;VA醋酸酯干粉、VC粉、VE粉、葡萄糖酸亚铁、葡萄糖酸锰、富硒酵母 河南明瑞食品添加剂有限公司;β-胡萝卜素、番茄红素、大豆异黄酮 西安圣青生物科技有限公司;MRS培养基、TPY培养基 青岛海博生物技术有限公司;罗伊氏乳杆菌LT018、发酵乳杆菌P132、干酪乳杆菌L614(均分离自巴马百岁老人粪便)广西大学轻工与食品工程学院食品营养与发酵工程研究室;超氧化物歧化酶(superoxide dismutase,SOD)试剂盒、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)试剂盒、丙二醛(malondialdehyde,MDA)试剂盒、考马斯亮蓝蛋白测定试剂盒、苏木精-伊红(hematoxylin-eosin,HE)染色液 南京建成生物工程研究所;质量分数4%多聚甲醛 河北博海生物工程开发有限公司。
1.2 仪器与设备
CLF-10C超微粉碎机 浙江省温岭市创力药材机械厂;9KLP-125制粒机 郑州荣丰机械设备有限公司;Morris水迷宫设备上海欣软信息科技有限公司;Pico17低温冷冻离心机美国Thermo公司;立式高压灭菌锅上海三申医疗器械有限公司;超净工作台 苏州安泰空气技术有限公司;TG16W微量高速离心机 长沙平凡仪器仪表有限公司;METASH UV-5200紫外-可见分光光度计上海元析仪器有限公司;DNP-9082BS电热恒温培养箱上海新苗医疗器械制造有限公司;CKX41倒置显微镜日本Olympus公司;EG1160石蜡包埋机、1020自动脱水机、RM2235石蜡切片机 德国Leica公司。
1.3 方法
1.3.1 饲料设计与制备
本实验在前期研究的基础上,进一步优化了膳食纤维、β-胡萝卜素、番茄红素和益生菌参数,并进行能量限制,设计了巴马长寿饮食模式优化I(优食I)和巴马长寿饮食模式优化II(优食II),并分别以自然衰老小鼠和年轻小鼠进行验证。
饲料配制:结合本课题组前期研究结果以及GB 14924.3—2010,并参考齐广海等[17]的方法。最终确定巴马长寿特征优食I、II的配方:将基础饲料粉碎,并加入强化的营养素,混匀后,制粒成型。优食I中,低聚果糖、低聚木糖、低聚异麦芽糖、大豆异黄酮、VA、VC、VE、铁、锰、钴、硒剂量为兰海静等[15]所设巴马特色饮食模式II组和Ⅲ组之间的中间剂量,计算方法参考文献[18],β-胡萝卜素剂量参考文献[19],番茄红素剂量参考文献[20]。在优食I的基础上,进一步对各类营养素的剂量进行强化,得到优食II。优食II中,膳食纤维用量参考文献[21-23],VA用量依据兰海静等[15]饮食模式II进行设计,VC、VE和大豆异黄酮的用量为优食I与兰海静等[15]所设计的饮食模式II之间的中间剂量,计算方法参考文献[18],β-胡萝卜素和番茄红素用量参考文献[19-20],铁、锰剂量参考GB 14924.3—2010进行设计,钴、硒剂量分别参考宋奇等[14]复合组、元素组进行设计。两种优化饮食均加入复合益生菌,干酪乳杆菌L614、发酵乳杆菌P132和罗伊氏乳杆菌LT018的活菌数均为108CFU/mL,按照菌液体积比例1∶1∶1混合,灌胃剂量为0.1 mL/10 gmb。对照组饲喂基础饲料,并灌胃等体积的生理盐水。
1.3.2 动物分组及处理
小鼠适应性喂养一周后,随机分为6 组,雌雄各半,每组12 只。36 只3 月龄小鼠随机分为年轻对照组、年轻优食I组和年轻优食II组;36 只15 月龄小鼠随机分为衰老对照组、衰老优食I组和衰老优食II组。各组给予不同处理,年轻优食I组和衰老优食I组饲喂优食I饲料,年轻优食II组和衰老优食II组饲喂优食II饲料,每只小鼠限制进食4 g/d,并以0.1 mL/10 gmb灌胃活菌数为108CFU/mL的混合菌液,年轻对照组和衰老对照组饲喂基础饲料,灌胃等体积的生理盐水。每周记录一次体质量,根据体质量变化及时调整灌胃剂量。
1.3.3 Morris水迷宫实验
Morris水迷宫设备由一个高50 cm、直径120 cm的圆形水池及一个平台组成,池壁每间隔90°设置一个标志物,将平面划分为4 个象限,平台设置在第三象限。水池中加入清水,采用加热棒调整水温在(24±2)℃,添加食品级黑色素将水染成黑色,以隐蔽位于水下的平台。水迷宫实验于灌胃第8周开始,参照文献[24-25]进行,为期6 d,实验前5 d进行定位航行实验,第6天进行空间探索实验。定位航行实验每天训练4 次,每次训练小鼠都从不同象限的入水点进入,入水的同时开始计时,记录小鼠找到隐藏平台的时间,即逃避潜伏期,如果60 s内小鼠未能找到平台,则记录本次的逃避潜伏期为60 s,并将小鼠引导到平台上,让其站立在平台上观察10 s。空间探索实验将隐藏在水下的平台撤掉,选取第二象限作为小鼠的入水点,记录小鼠的逃避潜伏期、60 s内小鼠穿越平台的次数、在目标象限的停留时间和目标象限内的行驶路程。
1.3.4 抗氧化指标的测定
Morris水迷宫行为学实验结束之后,所有小鼠禁食、禁水12 h,称体质量,麻醉后摘除眼球取血,颈椎脱臼处死小鼠,于冰上解剖取出脑组织,用生理盐水漂洗,滤纸擦干,称质量,并迅速放入-80 ℃冰箱保存。测定当天取出脑组织,称质量,加入脑组织质量9 倍体积的生理盐水,在冰水浴中使用匀浆器进行匀浆,制得质量分数10%脑组织匀浆液,4 ℃、3 500 r/min离心10 min,取上清液测定SOD活力、GSH-Px活力和MDA含量。
1.3.5 脑组织切片观察
解剖后取出小鼠的左侧大脑,4 ℃条件下,将左侧大脑固定在质量分数4%多聚甲醛中24 h以上,脱水处理后,包埋在石蜡中,用石蜡切片机对样品切片,再用HE染色,中性树脂封片,倒置显微镜(400×)观察HE染色显示的海马区形态学特征。
1.4 数据统计分析
采用SPSS19.0软件进行统计分析,采用GraphPad Prism 7.00软件作图,实验数据以±s表示。两组间比较采用单因素方差分析,多组间比较采用单因素方差分析和Duncan检验,P<0.05表示数据具有统计学意义。
2 结果与分析
2.1 巴马长寿特征饮食模式对小鼠体质量的影响
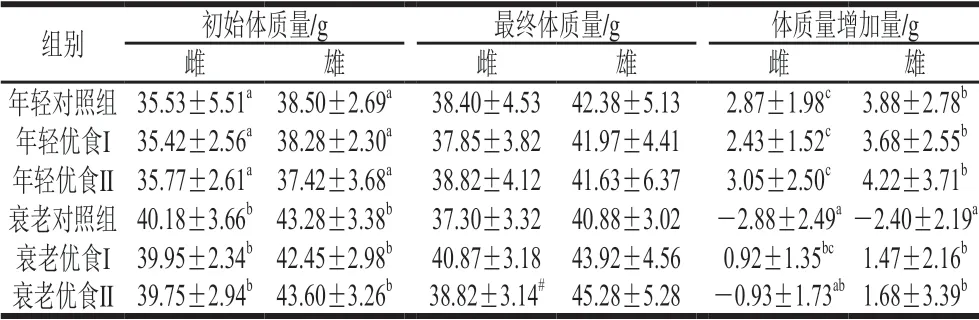
表 1 巴马长寿特征饮食模式对小鼠体质量的影响Table 1 Effect of Bama longevity characteristic dietary patterns on body mass of mice
体质量作为衡量机体生长的一项指标,常用于反映机体的健康状况[26]。由表1可知,实验开始时,年轻雌雄小鼠组间初始体质量无显著差异(P>0.05),衰老雌雄小鼠组间初始体质量也无显著差异(P>0.05)。实验结束后,衰老优食II组雌雄小鼠最终体质量之间存在显著性差异(P<0.05)。与年轻对照组相比,年轻优食I组和II组小鼠体质量增加量差异不显著(P>0.05)。衰老对照组雌鼠和雄鼠体质量增加量分别为-2.88、-2.40 g,表明机体的衰老导致了体质量下降。与衰老对照组相比,衰老优食I组雌鼠和雄鼠体质量增加量均有显著性差异(P<0.05)。衰老优食II组雌鼠体质量增加量为-0.93 g,雄鼠体质量增加量为1.68 g。宋奇[14]和兰海静[15]等研究发现巴马长寿特征饮食模式对D-半乳糖致衰老模型小鼠的生长发育没有不良影响。本实验进一步发现巴马长寿特征饮食模式对年轻小鼠的生长发育影响不显著,但能够显著减缓衰老小鼠体质量下降的趋势。
2.2 巴马长寿特征饮食模式对小鼠学习记忆能力的影响

表 2 巴马长寿特征饮食模式对小鼠在水迷宫中逃避潜伏期的影响Table 2 Effects of Bama longevity characteristic dietary patterns on escape latency of mice in water maze test
表2为5 d定位航行实验中,各组小鼠逃避潜伏期的变化情况。随训练时间的延长,除衰老对照组外,其余5 组小鼠的逃避潜伏期显著缩短,年轻对照组雌鼠和雄鼠逃避潜伏期分别缩短了2 7.2 1%、2 4.9 2%(P<0.05)。年轻优食I、II组雌鼠的逃避潜伏期分别缩短了41.67%、32.18%(P<0.05),雄鼠的逃避潜伏期分别缩短了48.89%、44.05%(P<0.05)。衰老对照组逃避潜伏期并没有随训练时间的延长发生显著变化,雌鼠和雄鼠的逃避潜伏期仅分别缩短13.78%、13.02%(P>0.05),说明自然衰老小鼠学习记忆能力严重退化。而衰老优食I、II组雌鼠的逃避潜伏期分别缩短46.35%、31.96%(P<0.05),雄鼠的逃避潜伏期分别缩短27.14%、28.59%(P<0.05)。年轻优食I、II组雄鼠逃避潜伏期下降程度大于雌鼠,而衰老优食I、II组雌鼠逃避潜伏期下降程度大于雄鼠,组内雌鼠和雄鼠逃避潜伏期差异均不显著。晏林等[27]研究发现,连续17 周灌胃不同剂量的枸杞汁能够使自然衰老小鼠(12 月龄)在定位航行实验中的逃避潜伏期缩短27.55%~32.69%。相比较而言,本实验中年轻优食I组雌鼠和雄鼠、年轻优食II组雄鼠、衰老优食I组雌鼠逃避潜伏期下降程度更大,且自然衰老小鼠年龄更大,饮食干预时间更短,表明巴马长寿特征饮食模式具有增强学习记忆的作用,并且优食I对学习记忆损伤修复的效果也更明显。
各组小鼠在平台象限内运动情况的典型路线见图1,整体运动趋势为:年轻对照组小鼠在目标象限内的运动范围较多,停留时间较长,多次穿越平台。与年轻对照组相比,年轻优食I组与年轻优食II组小鼠多在目标象限内运动,且在目标象限内运动的路程和停留时间更长,穿越平台次数更多;此外,年轻优食I组小鼠穿越平台次数比年轻优食II组较多。衰老对照组小鼠主要围绕象限的四周运动,运动方向不明确,很少围绕平台象限运动,几乎没有穿过平台,在目标象限内的运动路程和停留时间都远短于年轻对照组,结果表明衰老对照组小鼠在前5 d的定位航行实验中获得强化记忆的效果很差,学习记忆能力严重衰退。与衰老对照组相比,衰老优食I、II组小鼠在目标象限内的运动路程和停留时间都有所延长,且多次穿越平台。说明优食I、II组对改善年轻小鼠及自然衰老小鼠的学习记忆能力均有效果,有关量化统计结果见图2。

图 2 巴马长寿特征饮食模式对各组小鼠逃避潜伏期(A)、穿越平台次数(B)、目标象限停留时间(C)、目标象限路程(D)的影响Fig. 2 Effects of Bama longevity characteristic dietary patterns on escape latency (A), platform-crossing number (B), target quadrant residence time (C) and target quadrant travel distance (D) of mice in each group
由图2可知,与年轻对照组相比,衰老对照组小鼠逃避潜伏期显著延长、穿越平台次数、目标象限停留时间及目标象限路程均有所下降,其中雄鼠的逃避潜伏期显著延长了100.78%(P<0.05)、穿越平台次数显著下降了58.50%(P<0.05)。衰老优食I、II组与衰老对照组相比,逃避潜伏期均显著缩短,衰老优食I组雌鼠和雄鼠逃避潜伏期分别缩短62.84%、46.59%(P<0.05),衰老优食II组雌鼠和雄鼠逃避潜伏期分别缩短44.51%、59.54%(P<0.05),年轻优食I、II组雌鼠和雄鼠逃避潜伏期与年轻对照组相比也有所缩短,但差异不显著(P>0.05)。年轻优食I组雌鼠和雄鼠穿越平台次数均为最高,与年轻对照组相比,分别提高133.33%(P<0.05)和50.0%(P>0.05)。与衰老对照组相比,衰老优食I组雌鼠穿越平台次数提高150.0%,衰老优食II组雄鼠提高120.48%,但差异不显著(P>0.05)。衰老优食II组雄鼠目标象限停留时间较衰老对照组显著延长108.78%(P<0.05)。与年轻对照组相比,年轻优食I、II组雄鼠目标象限停留时间分别延长57.49%、54.39%,但差异不显著(P>0.05)。各组雌鼠目标象限路程之间没有显著性差异,年轻优食I、II组雄鼠目标象限路程较年轻对照组分别显著延长68.14%、61.78%(P<0.05)。衰老优食I、II组雄鼠目标象限路程比衰老对照组分别延长78.49%、58.51%,但差异不显著(P>0.05)。结果表明,机体的衰老会引起学习记忆能力的衰退,巴马长寿特征饮食模式能够提高年轻小鼠的学习记忆能力,并有效逆转衰老小鼠学习记忆能力下降的程度。
Morris水迷宫实验常用于评价小鼠的学习记忆能力[28],据报道,连续6 周摄入25~100 mg/kgmb的鹰嘴豆异黄酮提取物可使衰老小鼠的逃避潜伏期缩短5.06%~17.88%[29]。连续8 周摄入20 g/kgmb的血人参提取物能使D-半乳糖衰老模型小鼠的逃避潜伏期缩短32.74%[30]。连续6 周摄入250 mg/kgmb的无瓣海桑果实乙醇提取物能使D-半乳糖衰老模型小鼠的穿越平台次数显著提高38.94%[31]。不同剂量的丝瓜提取物能使衰老模型小鼠的目标象限停留时间延长26.08%~61.85%[32]。综上,本实验中优食I、II对增强年轻小鼠与衰老小鼠学习记忆能力与有关报道相比具有一定的优势。
2.3 巴马长寿特征饮食模式对小鼠脑组织抗氧化指标的影响
SOD能够清除机体内的自由基,使细胞免受氧化损伤,其活性水平与机体氧化应激水平紧密相关[33]。由图3A可知,衰老对照组脑组织SOD活力与年轻对照组相比有所降低,且雌鼠显著下降23.46%(P<0.05)。年轻优食I组与年轻对照组相比,衰老优食I、II组与衰老对照组相比,脑组织SOD活力均显著上升,特别是衰老优食I组,雌鼠SOD活力显著提高49.33%(P<0.05),雄鼠SOD活力显著提高34.30%(P<0.05),衰老优食II组雌鼠SOD活力显著提高41.08%(P<0.05),雄鼠SOD活力显著提高30.41%(P<0.05)。宋奇等[14]设计的5 种巴马长寿饮食模式对衰老模型小鼠脑组织SOD活力影响并不显著(P>0.05)。罗磊等[34]发现灌胃200 mg/(kgmb·d)的金银花叶黄酮能将衰老模型小鼠脑组织SOD活力提高27.34%,均低于本实验中优食I、II对衰老小鼠脑组织SOD活力的调节效果。

图 3 巴马长寿特征饮食模式对小鼠脑组织SOD活力(A)、MDA含量(B)和GSH-Px活力(C)的影响Fig. 3 Effects of Bama longevity characteristic dietary patterns on SOD activity (A), MDA content (B) and GSH-Px activity (C) in brain tissue of mice
MDA是体内脂质过氧化的代谢产物,含量过高会加剧细胞膜损伤,MDA含量直接反映了机体脂质过氧化水平[35]。由图3B可知,与年轻对照组相比,衰老对照组雌雄小鼠脑组织MDA含量分别显著上升22.98%、46.77%(P<0.05),表明自然衰老小鼠机体内的脂质过氧化水平升高。年轻优食I、II组与年轻对照组相比,小鼠脑组织MDA含量均有一定程度的下降,尤其是年轻优食I组:雌鼠M D A 含量下降2 3.4 7%,雄鼠M D A 含量下降21.51%,但差异不显著(P>0.05)。与衰老对照组相比,衰老优食I、II组小鼠MDA含量均显著下降,其中衰老优食I组雌雄小鼠MDA含量分别下降21.37%、30.53%(P<0.05),衰老优食II组雌雄小鼠MDA含量分别下降31.45%、36.39%(P<0.05)。宋奇等[14]研究发现复合组饮食模式能使衰老小鼠脑组织MDA含量下降35.26%,略低于本实验中衰老优食II组雄鼠脑组织MDA含量的下降程度。据报道,持续6 周灌胃200 mg/(kgmb·d)的秀珍菇多糖可使D-半乳糖致衰老小鼠脑组织中MDA含量下降29.24%[36]。刘贵珊等[37]研究发现灌胃剂量为100 mg/(kgmb·d)的白藜芦醇能使衰老模型小鼠脑组织的MDA含量显著下降23.76%,均低于本实验中衰老优食I组对雄鼠、II组雌鼠和雄鼠的调节效果。表明优食I、II均可降低年轻小鼠和衰老小鼠脑组织脂质过氧化水平,衰老优食I、II组中脂质过氧化水平降低的效果更加明显。
GSH-Px作为机体内的一种过氧化氢分解酶,可以清除细胞代谢产生的羟自由基和过氧化物,GSH还可促进H2O2的分解,使细胞膜免受过氧化物的损伤,维持细胞膜结构和功能的完整性[38]。由图3C可知,与年轻对照组相比,衰老对照组雌鼠和雄鼠脑组织GSH-Px活力分别显著下降35.74%、30.26%(P<0.05),说明衰老小鼠脑组织抗氧化能力严重损伤。与衰老对照组相比,衰老优食I、II组小鼠脑组织GSH-Px活力均显著提高,其中衰老优食I组雌鼠和雄鼠分别提高71.57%、67.36%(P<0.0 5),衰老优食I I 组雌鼠和雄鼠分别提高58.75%、46.14%(P<0.05)。与年轻对照组相比,年轻优食I组GSH-Px活力也显著提高,其中雌鼠GSH-Px活力提高36.64%(P<0.05),雄鼠GSH-Px活力提高37.02%(P<0.05)。包晓玮等[39]研究发现摄入沙棘多糖可有效提高衰老小鼠脑组织GSH-Px活力(12.38%~46.04%),低于本实验中优食I、II对自然衰老小鼠脑组织GSH-Px活力的调节效果。结果表明,优食I、II均可有效提高年轻小鼠与衰老小鼠体内GSH-Px活力,减缓机体氧化损伤,优食I改善效果更好。
2.4 巴马长寿特征饮食模式对小鼠海马区的保护作用
海马区是脑组织边缘系统的一部分,直接参与学习记忆过程。CA1区与海马区生理功能的发挥密切相关,对外界病理因素最为敏感,也是病理变化最早出现的部位,所以海马CA1区常作为脑损伤研究的一个典型区域[40]。大脑衰老与神经系统慢性炎症存在因果关系,老年性慢性损伤打破神经元所处的微环境稳态,导致炎症细胞因子和相关抑制因子的平衡失调,引起神经元变性、坏死和凋亡[41]。由图4可知,年轻对照组海马CA1区锥体细胞有3~4 层,排列整齐,细胞形态完整,核仁清晰。年轻优食I、II组海马CA1区锥体细胞有4~5 层,与年轻对照组相比,排列更为整齐紧密,细胞结构形态较完整,核仁清晰,神经细胞数量增多,细胞凋亡及核固缩现象极少。衰老对照组海马CA1区锥体细胞排列疏松散乱,层次不清,部分细胞出现核固缩现象,部分神经细胞形状发生改变,呈现不规则齿状形态,形态正常的细胞极少。与衰老对照组相比,衰老优食I、II组海马CA1区锥体细胞排列更加整齐,细胞形态结构较完整,边界清晰,少见核固缩,细胞凋亡情况得到明显改善。衰老优食I组比衰老优食II组神经细胞多,出现核固缩、核溶解及细胞变性坏死的情况减少。陈燏[42]发现活性肽-N对减缓衰老小鼠海马CA1区细胞神经元变性、坏死和凋亡的发生起有效作用。比较而言,巴马长寿特征饮食模式也具有预防衰老小鼠脑组织海马区损伤的作用。

图 4 巴马长寿特征饮食模式对各组小鼠海马区的影响(400×)Fig. 4 Effects of Bama longevity characteristic dietary patterns on brain hippocampal area of mice in each group (400 ×)
本实验在前期研究结果的基础上,进一步优化了饮食模式,并对抗衰老效果进行验证。结果显示优食I、II均能有效增强年轻小鼠及自然衰老小鼠的学习记忆能力和抗氧化能力。雌雄小鼠仅衰老优食II组雌雄小鼠之间最终体质量存在显著性差异,其余指标雌雄之间差异均不显著;其中,定位航行实验表明,优食I改善雌鼠与雄鼠的学习记忆能力较好;空间探索实验表明,在雌鼠分组中,优食I改善年轻雌鼠与衰老雌鼠的学习记忆能力的效果较好,在雄鼠分组中,优食I、II均改善了年轻雄鼠与衰老雄鼠的学习记忆能力,但各饮食干预组间改善效果差异不大;脑组织SOD活力、GSH-Px活力、MDA含量的综合测定结果表明,优食I对雌鼠和雄鼠的抗衰老效果均较好;优食I、II对年轻小鼠海马CA1区均有一定的保护作用,优食I对衰老小鼠海马CA1区保护效果更好。综合实验结果分析,发现优食I改善小鼠学习记忆能力与抗衰老的效果略优于优食II,初步表明巴马长寿饮食模式具有良好的借鉴潜力和进一步推广的价值。
3 结 论
本实验从探索巴马长寿特征饮食的抗衰老效果出发,设计了两种优化的巴马长寿饮食模式,并采用年轻小鼠和自然衰老小鼠进行验证。结果发现,巴马长寿特征饮食能够显著延缓衰老小鼠体质量的下降趋势,有效缩短年轻小鼠与衰老小鼠逃避潜伏期、提高穿越平台次数、延长目标象限停留时间及目标象限路程。显著提高年轻小鼠与衰老小鼠的脑组织SOD活力和GSH-Px活力,降低MDA含量,并改善脑组织海马区神经元细胞变性、凋亡的现象。以上结果表明,优化的巴马长寿饮食模式对年轻小鼠及衰老小鼠均具有明显的抗衰老效果。巴马饮食模式对雌雄小鼠的影响趋势基本一致,且优食I对增强雌鼠与雄鼠的学习记忆能力、改善抗氧化效果较好。初步发现巴马长寿特征饮食模式对衰老小鼠的抗衰老调节效果强于年轻小鼠。
总体而言,优食I、II对增强小鼠学习记忆能力和预防脑组织损伤都发挥了较为显著的效果,其中优食I的效果略优于优食II,这将为巴马长寿特征饮食走向成熟和实用提供重要的支撑。
