SIRT3多酚激活剂的筛选及其对UVB诱导HaCaT细胞衰老的修复作用
2021-03-31YOSHINORIKatakura扈洪波尹淑涛
陈 慧,YOSHINORI Katakura,扈洪波,尹淑涛,赵 冲,
(1.中国农业大学食品科学与营养工程学院,北京 100083;2.九州大学农学院生物科学与生物技术系,日本 福冈 8128581)
在哺乳动物中,Sirtuins家族中有7 个成员,沉默信息调节因子2相关酶类(silent mating type information regulation 2 homolog,SIRT)1~7,它们分别定位于细胞的不同位置,而SIRT3是唯一定位于线粒体的去乙酰化酶,它可以通过控制蛋白的乙酰化/去乙酰化水平调节线粒体中酶的活性,影响线粒体功能及细胞生理状态[1]。SIRT3不仅影响能量代谢过程,包括三羧酸循环、氧化磷酸化、脂肪酸氧化及酮体的生成,还参与维持线粒体的氧化还原稳态[2]。线粒体内电子传递过程中因电子泄漏产生的活性氧可损伤线粒体内外的大分子及细胞膜结构,是目前公认的与衰老相关的病理机制之一[3]。事实上,实验和基因遗传研究证据都表明SIRT3活性与延缓衰老有关。关于意大利南部人群的研究表明,苏格兰人SIRT3基因的单核苷酸多态性(G477T)3号位点外显子和数目可变串联重复序列(variable number of tandem repeats,VNTR)5号位点内含子序列与寿命延长有关[4-5]。VNTR具有增强子特性,能够决定SIRT3基因的转录活性,而缺乏VNTR增强子活性的老人寿命明显较短。因此,SIRT3在延缓衰老中具有重要的作用,增强SIRT3的转录活性有利于延缓衰老的发生。
多酚类化合物是一类具有良好抗氧化活性的次生代谢产物,广泛存在于各种可食用植物中,如葡萄、石榴、茶叶、咖啡豆等。绿茶多酚通过上调SIRT3蛋白表达水平,降低超氧化物歧化酶(superoxide dismutase,SOD)2的乙酰化水平,从而增强SOD2的抗氧化活性,有效缓解高脂饮食诱导的氧化应激造成的肾脏组织损伤[6]。此外,绿茶多酚可降低正常大鼠肾皮质4-羟基壬烯酸水平,其可能的机制与上调肾皮质SIRT3的表达有关[7]。石榴皮多酚Pomegraniin A可减少细胞内活性氧的生成,依赖于SIRT3介导的去乙酰化作用而增强SOD2的抗氧化活性[8]。所以,多酚类化合物是筛选SIRT3激活剂的重要来源之一。根据结构特点,本实验选取了常见的食物原料葡萄、茶叶、石榴、青稞中的7 种代表性多酚类化合物,包括白藜芦醇、山柰酚、石榴皮鞣素、安石榴苷、矢车菊素、飞燕草素葡萄糖苷、漆树黄酮,以及咖啡豆中的咖啡醇作为筛选SIRT3激活剂的候选化合物(表1)。

表 1 具有SIRT3潜在激活作用的多酚类化合物Table 1 Polyphenols with potential effect on SIRT3 activation
前期研究表明,这8 种化合物在人结肠癌细胞Caco2中对SIRT3的转录激活作用有不同的影响[8],本实验将进一步探究这8 种化合物对于人正常皮肤永生化角质形成细胞(human immortalized keratinocytes,HaCaT)中的SIRT3转录活性的影响,并且以中波紫外线(ultraviolet radiation B,UVB)诱导的HaCaT细胞衰老模型,探究SIRT3多酚激活剂是否可以通过SIRT3介导的抗氧化应激途径减少UVB诱导的HaCaT细胞氧化应激损伤,从而修复细胞衰老。
1 材料与方法
1.1 材料与试剂
HaCaT购于日本理研生物资源中心。
白藜芦醇、山柰酚、石榴皮鞣素、安石榴苷、漆树黄酮、咖啡醇、矢车菊素、飞燕草素葡萄糖苷美国Sigma公司。
DMEM培养基日本Nissui公司;0.25%(质量分数)胰蛋白酶消化液、胎牛血清美国Life Technologies公司;总R N A 提取试剂盒 瑞士Roche 公司;pEGFP-C3载体日本Takara公司;BES-H2O2-Ac过氧化氢荧光探针日本WAKO公司;SOD2测定试剂盒、谷胱甘肽(glutathione,GSH)/氧化型谷胱甘肽(oxidized glutathione,GSSG)测定试剂盒、SA-β-gal活性检测试剂盒日本Dojindo公司。
1.2 仪器与设备
CO2培养箱美国Thermo公司;Thermal Cycler Dice Real Time System TP-800聚合酶链式反应(polymerase hainreaction,PCR)仪日本Takara 公司;IN Cell Analyzer 1000全自动活细胞图像分析系统 美国GE Healthcare公司;CL-1000紫外交联仪美国UVP公司。
1.3 方法
1.3.1 构建SIRT3-EGFP报告基因系统
SIRT3-EGFP报告基因系统按照先前建立的方法[8]进行构建。以人类基因组DNA为模板进行PCR扩增人类SIRT3启动子(-653—-1),将其装入无启动子的pEGFP-C3表达载体中,得到特定的pSIRT3p-EGFP质粒。利用构建的pSIRT3p-EGFP质粒转染HaCaT细胞,用于评价人类SIRT3启动子的活性。利用IN Cell Analyzer 1000全自动活细胞图像分析系统监测EGFP荧光强度的变化,可定量测定SIRT3启动子的活性。
1.3.2SIRT3基因表达水平的测定
细胞内RNA的提取按照总RNA提取试剂盒说明书进行操作。cDNA的合成参照Fujiki等[9]的方法。利用半定量实时荧光定量PCR(quantitative realtime PCR,qPCR)法监测细胞SIRT3基因的mRNA表达水平。以β-actin为内参基因。SIRT3和β-actin基因的PCR引物序列分别为:SIRT3前引物序列为5’-CTGTACAGCAACCTCCAGCA-3’,后引物序列为5’-CTCCTTGGCCAAAGTGAAAA-3’;β-actin前引物序列为5’-TGGCACCCAGCACAATGAA-3’,后引物序列为5’-CTAAGTCATAGTCCGCCTAGAAGCA-3’。实验重复3 次。
1.3.3 细胞培养及细胞衰老模型的建立
采用含10%胎牛血清的DMEM高糖培养基,置于37 ℃、5% CO2的细胞培养箱中培养HaCaT细胞。将处于对数生长期的细胞接种于细胞培养板上进行实验。当细胞培养至刚开始出现融合生长时进行UVB照射。吸出培养基,加入少量磷酸缓冲盐溶液覆盖细胞,利用紫外交联仪对细胞进行紫外线处理,照射剂量为10 mJ/cm2,共照射2 次,每隔24 h照射1 次。
1.3.4 细胞内活性氧相对含量的测定
细胞内活性氧(reactive oxygen species,ROS)的含量采用过氧化氢特异性荧光探针BES-H2O2-Ac法测定。吸出培养基,用pH 7.4的4-羟乙基哌嗪乙磺酸(4-(2-hydroxyethyl)-1-piperazineethanesulfonic acid,HEPES)缓冲液洗涤细胞2 次,然后加入终浓度为5 μmol/L的 BES-H2O2-Ac和Hoechst 33342染料,37 ℃培养箱内孵育30 min。消化并收集细胞,HEPES润洗2 次后采用IN Cell Analyzer 1000全自动活细胞图像分析系统进行检测。
1.3.5 细胞抗氧化活性的测定
通过测定细胞SOD2相对活力及GSH/GSSG比值评价细胞的抗氧化活性。按照相应试剂盒说明书的操作进行测定。
1.3.6 细胞内SA-β-gal相对活力的测定
采用SA-β-gal相对活力检测试剂盒,按照说明书的操作进行,采用IN Cell Analyzer 1000全自动活细胞图像分析系统进行检测。
1.4 数据统计分析
利用SPSS 19.0数据处理软件进行统计学分析,采用单因素方差分析进行组间比较,Tukey法进行事后检验,结果以平均值±标准差表示,以P<0.05为差异有统计学意义。
2 结果与分析
2.1 多酚类化合物对HaCaT SIRT3转录活性的影响

图 1 SIRT3多酚激活剂筛选系统Fig. 1 Screening system for SIRT3 activators from polyphenols
通过建立HaCaTSIRT3-EGFP报告基因系统(图1),本实验共评价了8 种化合物对SIRT3转录活性的影响。这些化合物包括白藜芦醇、山柰酚、石榴皮鞣素、安石榴苷、漆树黄酮、咖啡醇、矢车菊素、飞燕草素葡萄糖苷。依据前期的研究结果[10],安石榴苷等几种多酚化合物在10 μmol/L时显著修复了UVB对HaCaT细胞活力的损伤,因此本实验中的所有细胞实验也均采用了此浓度。通过对EGEP进行荧光定量分析(图2),结果表明,与二甲基亚砜(dimethyl sulfoxide,DMSO)组(对照组)相比,白藜芦醇、山柰酚、安石榴苷、漆树黄酮和咖啡醇显著增强了EGFP荧光强度。石榴皮鞣素、矢车菊素和飞燕草素葡萄糖苷对SIRT3的转录活性影响不显著。

图 2 多酚类化合物对EGFP相对荧光强度的影响Fig. 2 Effect of polyphenols on relative fluorescence intensity of EGFP
本研究进一步利用qPCR技术,检测了白藜芦醇、山柰酚、安石榴苷、漆树黄酮和咖啡醇对HaCaT内源性SIRT3基因表达水平的影响(图3),发现SIRT3基因表达水平均有显著上调,与它们增强EGFP水平的结果具有一致性。因此,白藜芦醇、山柰酚、安石榴苷、漆树黄酮和咖啡醇能上调HaCaT中SIRT3基因的表达。
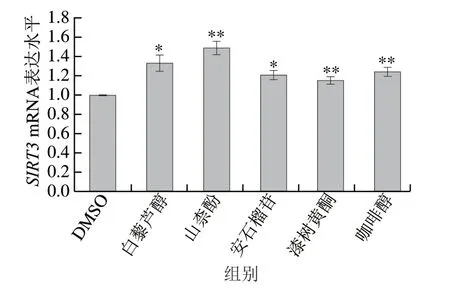
图 3 多酚类化合物对SIRT3 mRNA表达水平的影响Fig. 3 Effect of polyphenols on SIRT3 mRNA expression
2.2 SIRT3多酚激活剂对UVB诱导的细胞内ROS相对含量的影响

图 4 SIRT3多酚激活剂对UVB诱导的细胞内ROS相对含量的影响Fig. 4 Effect of SIRT3-activating polyphenols on intracellular ROSlevels induced by UVB exposure
紫外线照射是皮肤损伤的重要因素之一。UVB是波长在280~320 nm的中波紫外线,它可以穿透表皮层进入真皮层,从而引起DNA的损伤或是ROS的产生,引发基因突变及衰老的发生[11]。为了确定合适的诱导细胞发生衰老的UVB照射剂量,实验中设置4 个照射剂量组,分别为0、6、8、10 mJ/cm2。
图4A结果显示,UVB照射剂量为10 mJ/cm2时,与空白组相比,细胞内ROS相对含量显著增加(P<0.05),6、8 mJ/cm2的UVB照射剂量对细胞内ROS相对含量没有显著影响。因此,UVB照射剂量为10 mJ/cm2可作为诱导细胞衰老以及筛选抗自由基多酚化合物的最佳剂量。HaCaT在10 mJ/cm2的UVB照射剂量处理之后,SIRT3多酚激活剂白藜芦醇、山柰酚、安石榴苷、漆树黄酮及咖啡醇均以10 μmol/L的浓度干预48 h,按照1.3.4节中的方法测定细胞内ROS相对含量,结果如图4C所示。为了排除化合物自身对细胞内ROS的影响,同时也检测了无UVB照射且其他条件相同的情况下细胞内ROS相对含量(图4B)。结果显示,当无UVB照射时,相比于DMSO组,白藜芦醇、山柰酚、安石榴苷、漆树黄酮及咖啡醇处理之后,细胞内ROS相对含量没有显著变化,表明这些化合物不会改变正常细胞内ROS的水平。当照射剂量为10 mJ/cm2时,白藜芦醇、安石榴苷、漆树黄酮及咖啡醇均显著降低了UVB诱导细胞产生的ROS相对含量,且差异具有统计学意义(P<0.01),山柰酚处理组与对照组中细胞内ROS相对含量无显著差异。总而言之,除山柰酚外,其他SIRT3多酚激活剂均能降低UVB诱导的细胞氧化应激水平。
2.3 SIRT3多酚激活剂对UVB诱导的细胞SA-β-gal活性的影响
SA-β-gal是一种溶酶体水解酶,其最佳酶活性是在pH 4.0的条件下,而衰老细胞在pH 6.0的条件下此酶活性会显著增强,因此SA-β-gal活性是作为评价细胞衰老水平的关键指标[12]。通过测定细胞SA-β-gal活性,可进一步验证10 mJ/cm2的UVB照射剂量是否成功诱导细胞衰老模型的形成。

图 5 UVB照射诱导的细胞衰老Fig. 5 Cellular senescence induced by UVB irradiation
如图5所示,细胞从左往右分布,表明细胞体积逐渐增大。与未经UVB照射处理的细胞相比,10 mJ/cm2照射剂量处理下的细胞体积变大,SA-β-gal染色阳性细胞明显增多,即处于衰老状态的细胞数量增多。所以10 mJ/cm2照射剂量的UVB处理可以诱导细胞衰老的发生。本研究分别评价了前期筛选得到的SIRT3多酚激活剂白藜芦醇、山柰酚、安石榴苷、漆树黄酮及咖啡醇对细胞衰老的影响,测定它们对UVB处理之后HaCaT SA-β-gal活性的影响。
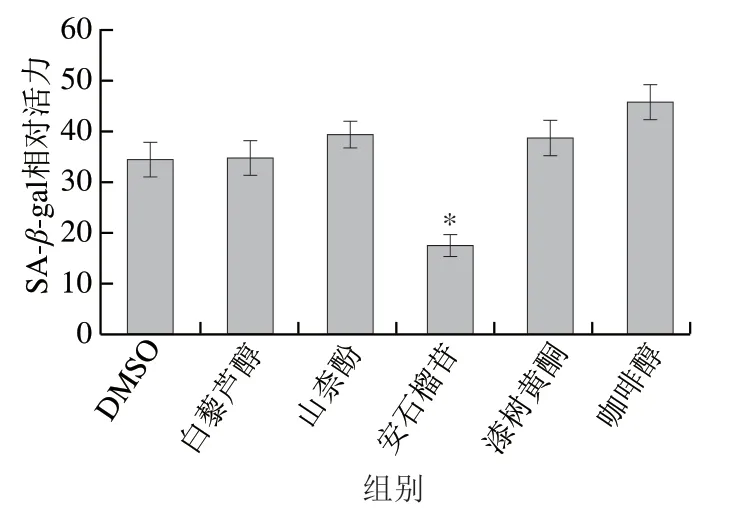
图 6 激活SIRT3的多酚类化合物对UVB诱导的细胞SA-β-gal活性的影响Fig. 6 Effect of SIRT3-activating polyphenols on intracellular SA-β-gal activity induced by UVB
图6表明,在这5 种化合物中,安石榴苷显著降低了细胞SA-β-gal活力(P<0.05),而其他4 种化合物对细胞SA-β-gal活力均没有显著影响。以上研究结果表明,安石榴苷能有效抑制UVB诱导的皮肤细胞衰老。
2.4 SIRT3多酚激活剂对细胞SOD2相对活力和GSH/GSSG比值的影响

图 7 激活SIRT3的多酚类化合物对UVB诱导的细胞SOD2活性的影响Fig. 7 Effect of SIRT3-activating polyphenols on intracellular SOD2 activity induced by UVB
SOD与GSH是内源性抗氧化系统中重要的抗氧化酶及抗氧化物质。SOD2是细胞线粒体内一种重要的抗氧化蛋白,通过催化超氧阴离子形成细胞毒性较弱的H2O2,H2O2进一步分解,从而降低活性氧对细胞的损伤作用。研究表明SIRT3的激活有助于增强SOD2的活性,从而降低细胞内ROS水平,维持细胞氧化还原平衡[13]。GSH在谷胱甘肽过氧化物酶的作用下,将H2O2转化成对细胞无毒性作用的H2O,而GSH自身则被氧化成GSSG[14]。因此,GSH/GSSG比值可以反映细胞的氧化应激水平。GSH/GSSG比值也同样受到SIRT3的调控,SIRT3通过直接去乙酰化作用,增强线粒体异柠檬酸脱氢酶2活性,提高线粒体内烟酰胺腺嘌呤二核苷酸磷酸(nicotinamide adenine dinucleotide phosphate,NADPH)水平,而NADPH可介导谷胱甘肽抗氧化系统的活性来维持氧化还原平衡[15-16]。
由图7可知,白藜芦醇与咖啡醇处理组细胞的SOD2活力显著增强,而其他多酚类化合物对SOD2活力没有显著性影响。

图 8 激活SIRT3的多酚类化合物对UVB诱导的细胞GSH/GSSG比值的影响Fig. 8 Effect of SIRT3-activating polyphenols on intracellularGSH/GSSG ratio induced by UVB
图8中激活SIRT3的多酚类化合物均提高了细胞GSH/GSSG比值,且与DMSO组相比有显著性差异,其中安石榴苷与山柰酚的作用效果最佳,GSH/GSSG比值均提高了4 倍以上。
3 讨 论
衰老是生命有机体的自然规律和必然结果,而皮肤作为人体抵御外界环境的最外层屏障,容易受到外界因素的直接干扰,如长期紫外线的照射则会促进皮肤老化[17]。紫外线诱导皮肤发生老化的原因之一是过量ROS的产生,而线粒体是ROS产生的主要部位[18-20]。SIRT3属于哺乳动物SIR2同源基因,定位于线粒体并调节线粒体功能,包括代谢、能量稳态和调节氧化应激反应[13]。多项研究表明SIRT3介导的线粒体内ROS稳态的调节有助于缓解衰老以及过度氧化应激造成的组织损伤[21-23]。SIRT3作为抗氧化调节信号通路的上游靶点,激活SIRT3的活性物质则具有潜在的抗衰老作用。
实验结果显示,8 种多酚化合物中白藜芦醇、山柰酚、安石榴苷、漆树黄酮和咖啡醇可显著上调SIRT3基因表达水平(图2、3),并进一步评价了这5 种SIRT3多酚激活剂对UVB引起细胞产生过量ROS的清除作用。显然,除了山柰酚之外,对SIRT3有激活作用的化合物均显著减少了UVB诱导的细胞内ROS水平(图4C)。Vitale等[24]研究发现在UVB处理HaCaT之前,经过白藜芦醇预处理的HaCaT内产生的ROS减少。白藜芦醇不仅可以防止UVB照射引起的皮肤氧化损伤,而且对损伤后的皮肤还具有修复作用。安石榴苷、漆树黄酮和咖啡醇在多种细胞模型和体内动物实验中均表现有抗氧化活性[25-28],本实验中它们均显著降低了UVB处理后HaCaT内ROS水平。由此可见,白藜芦醇、安石榴苷、漆树黄酮和咖啡醇是极具潜力的抗氧化活性物质。此外,在10 mJ/cm2UVB照射剂量下,HaCaT氧化应激水平增加,细胞发生衰老(图5)。在白藜芦醇、山柰酚、安石榴苷、漆树黄酮、咖啡醇的干预下,安石榴苷处理组细胞的SA-β-gal活性显著下降,表明安石榴苷能促进UVB所诱导细胞衰老的修复。激活SIRT3的多酚类化合物对细胞抗氧化系统的修复具有不同程度的影响(图7、8),表明这些多酚类化合物除了依赖于SIRT3-SOD2途径增强细胞抗氧化活性外,可能还存在其他的机制,如直接清除自由基、作为氧化还原酶底物以及其他氧化调节信号通路如Nrf2/Keap1-ARE、MAPK及PI3K/Akt等[29-31]。自由基的过量产生是导致细胞衰老的因素之一,安石榴苷的抗衰老作用离不开其抗氧化作用,但也可能存在其他的抗衰老机制,如SIRT1介导的核苷酸切除修复途径[10],其他SIRT3多酚激活剂在增强细胞抗氧化系统活性的同时并没有改善细胞的衰老现象。此外,杨明美等[32]的研究表明安石榴苷对UVB诱导的HaCaT损伤具有预保护作用,主要是通过抑制UVB诱导的MAPK亚族中ERK、JNK和p38的活化,从而减少细胞凋亡。安石榴苷不仅可以缓解UVB照射引起的皮肤受损,而且对皮肤的损伤及老化具有一定的修复作用。
综上所述,通过SIRT3-EGFP报告基因系统筛选得到5 种多酚类化合物具有增强SIRT3基因表达的作用,分别是白藜芦醇、山柰酚、安石榴苷、漆树黄酮和咖啡醇;白藜芦醇、安石榴苷、漆树黄酮以及咖啡醇均能有效降低UVB诱导的细胞内ROS水平;这5 种多酚均显著提高了GSH/GSSG比值,白藜芦醇与咖啡醇显著增强了SOD2活性;安石榴苷不仅可以激活SIRT3,修复细胞的抗氧化系统,缓解UVB诱导的HaCaT衰老,其抗衰老机制可能与SIRT3-NADPH-GSH/GSSG抗氧化途径有关。本研究更加确证了安石榴苷在抗衰老方面的作用并初步探究了其机制,今后将进一步从动物体内水平评价安石榴苷在抗衰老方面的效果,并从分子水平深入阐明其作用机制,为安石榴苷在功能食品、护肤产品等方面的应用提供充分的理论依据。
