海洋生物毒素的分类、毒害作用机制及检测技术研究进展
2021-03-31陈巧莉洪晴悦魏鲟钰方楚楚阚建全
陈巧莉,杨 兵,洪晴悦,魏鲟钰,方楚楚,阚建全
(西南大学食品科学学院,农业农村部农产品贮藏保鲜质量安全风险评估实验室(重庆),中国匈牙利食品科学合作研究中心,重庆 400715)
海洋生物毒素是目前关注度颇高的一类有害物质,其可在贝类、鱼类等海洋生物体内积累,再通过食物链进入人体,当毒素摄入量累积到一定量时,极易引起人体中毒。据了解,每年全球约有6 000多起中毒事件与贝类毒素有关,致死率达1.5%[1]。其中由麻痹性贝类毒素(paralytic shellfish poison,PSP)引起的中毒事件比率占到87%,该毒素是全球分布最广、事故发生率最高、危害程度最大的一类毒素;其次是腹泻性贝类毒素(diarrhetic shellfish poison,DSP),约占5%[2-3]。中国食品科技网(http://www.tech-food.com/news/series/1300/)的报道显示,每年夏秋季,在我国沿海城市发生的食物中毒事件中,有40%是由DSP引起的。2008年,由大连出口日本的油炸牡蛎被检出DSP达到0.1 MU/g[4];2011年5月宁波市爆发了由DSP引起的“淡菜”中毒事件,导致上百人中毒[5];2017年6月,福建漳州164 人由于食入被PSP污染的贻贝、牡蛎等贝类导致食物中毒,出现头晕、呕吐、四肢瘫痪等症状[6]。近年来,全球由海洋毒素引起的食物中毒事件数量仍在逐年增加,仅美国每年就有7 600万 人发生海洋生物毒素中毒,其中5 000 人死亡[7]。海洋生物毒素对于人类的影响不只是短期内的急性中毒,其在体内长期积累还会引发肿瘤和癌症,对人类健康造成了潜在危害。因此,深入了解海洋生物毒素的分类、毒害作用机制以及相应的检测技术,对人类的生命安全具有重要意义。
1 海洋生物毒素的概述
海洋生物毒素是一类存在于海洋生物体内的小分子化合物,大多由藻类、浮游植物或微生物产生,主要有以下特点[8]:1)化学结构独特且多样:结构类型异于其他毒素,部分结构为自身特有;2)生物活性高:可高度选择并亲和受体分子;3)毒性强:一般有剧毒,极易引起人类中毒;4)作用机理特殊:主要通过特异性作用于神经受体或离子通道,调控相关细胞活动产生作用。目前已发现1 000余种海洋生物毒素,已知结构的约有几十种,其可在鱼类、贝类等滤食性海洋生物体内累积且不对此生物体产生毒害作用,同时由于毒素热稳定性好,不能被加热或常规烹饪方式所破坏,因此其经过食物链被人类食用后极易引起人类中毒,严重时可致死,相关毒素传递过程见图1。海洋生物毒素来源多、分布广,根据不同的分类标准,可被分为不同种类,具体分类及部分典型海洋生物毒素的化学结构式分别见表1、2。

图 1 海洋生物毒素传递过程Fig. 1 Transfer of marine biotoxins through the food chain

表 1 主要海洋生物毒素的分类Table 1 Classification of major marine biotoxins
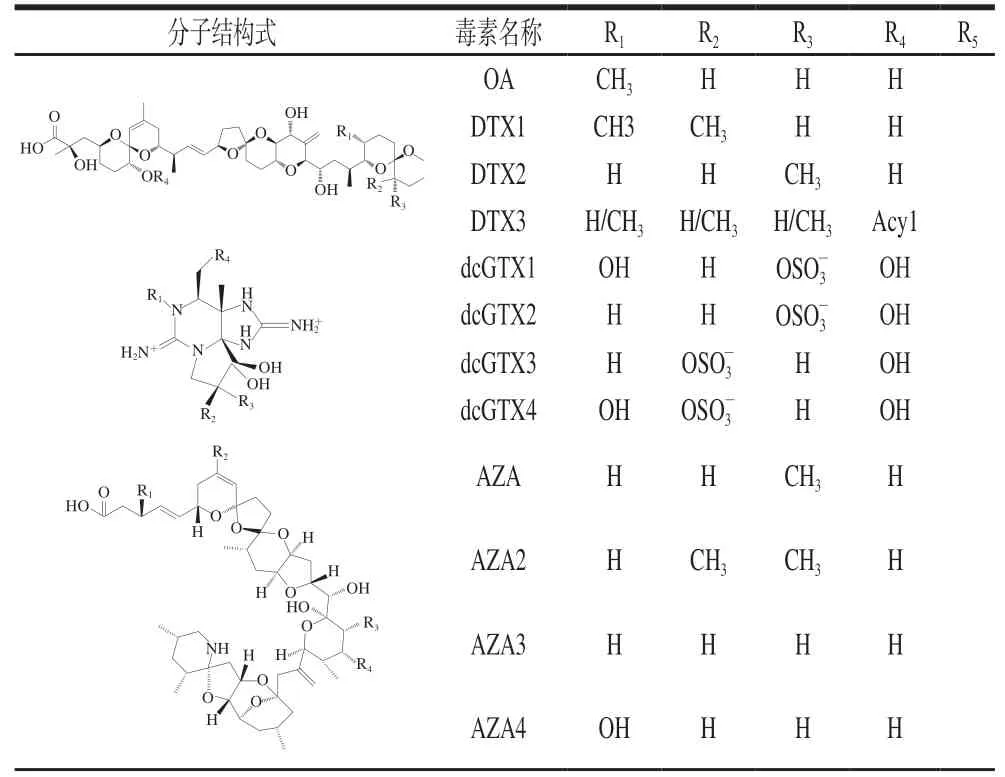
表 2 部分典型海洋生物毒素的化学结构式Table 2 Chemical structures of typical marine biotoxins

续表2
2 海洋生物毒素的毒害作用机制
海洋生物毒素主要通过特异性作用于靶受体,改变相关离子通道功能,阻碍其电信号传递,紊乱生物体的生理功能,从而产生毒理作用。离子通道本质是亲水性蛋白质微孔道,其作为细胞和外界环境进行信息传递的媒介,对维持正常生命活动起着重要作用。其中海洋生物毒素的作用离子通道主要有两种[11]:一是电压门控离子通道(如Na+、K+、Ca2+通道);二是配体门控离子通道(如乙酰胆碱受体通道和谷氨酸受体通道),其靶标示意图见图2。
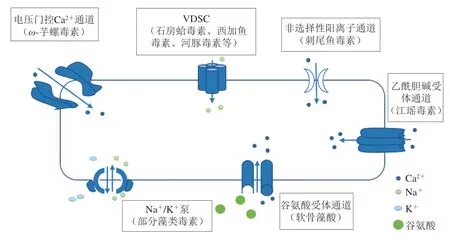
图 2 海洋生物毒素主要靶标示意图Fig. 2 Schematic diagram of the major targets of marine biotoxins

图 3 海洋生物毒素的Na+通道结构和结合位点Fig. 3 Sodium channel architecture and binding sites of marine biotoxins

表 3 几种重要海洋生物毒素的毒害作用机制Table 3 Toxic mechanisms of several important marine biotoxins
对于大部分海洋生物毒素而言,其主要通过VDSC产生毒害作用。该离子通道由α、β1和β2 3 个亚基组成,α与β1非共价结合,α与β2共价结合[10]。由图3可知,α亚基包括4 个同源域(I~IV),每个同源域包含6 个跨膜片段(S1~S6)和一个连接内外部的多肽环[9],其中带正电的S4段和连接同源域III和IV的亲水性片段可分别激活和抑制VDSC。同时在VDSC上至少存在6 个不同的毒素靶受体结合位点,不同毒素与不同位点作用时,会产生不同的毒害作用,主要包括钠通道阻滞剂、钠通道激活剂和钠通道抑制剂[20]。
其中钠通道阻滞剂是一类与Na+通道位点1特异性结合的毒素,主要包括PSP和TTX等。PSP通常与神经细胞膜结合,造成细胞膜电压门控的Na+通道高亲和力障碍,影响或阻止Na+内流,从而使正常的动作电位无法形成,特异性干扰神经肌肉传导过程,使随意肌松弛麻痹,进而导致一系列中毒症状[21]。Sapse等[22]研究表明,Na+通道被STX抑制的原因是通道外膜胍基和羧基相互作用而不能结合Na+。此外,STX除了作用于Na+通道外,也能结合Ca2+、K+通道,是一种多受体靶位的海洋生物毒素。TTX的作用机制与PSP相似,为细胞膜Na+通道的选择性快速阻断剂,其活性基团是1、2、3位的胍胺基和C4、C9、C10位的羟基[23],受体位于可兴奋细胞膜外侧、Na+通道外口附近,TTX与钠通道受体部位1结合后,阻止Na+接近通道的外口,使Na+不能通过通道进入细胞内。NSP则是通过作用于Na+通道位点5而产生毒害作用,它与PSP阻断Na+内流相反,NSP的活性成分PbTX可以诱导Na+内流,从而导致肌肉和神经细胞去极化,但其效果能被作用于Na+通道位点1的毒素(如STX和TTX)完全消除。对于钠通道失活剂,主要是作用于Na+通道位点6的δ-CNTX。CNTX一般由10~31 个氨基酸残基组成,含有2 对或3 对二硫键,目前已鉴定出了50多种CNTX。根据其作用受体的不同,将其分为δ-CNTX、μ-CNTX、α-CNTX以及ω-CNTX等多种类型,其中δ-CNTX特异性作用于神经元电压依赖性Na+通道,延缓Na+失活,延长动作电位持续时间;而μ-CNTX的作用机制与PSP和TTX相似,能与Na+通道位点1特异性结合,阻断Na+内流,抑制动作电位的产生;α-CNTX特异性阻断突触后膜乙酰胆碱受体;ω-CNTX特异性阻断神经元电压敏感性钙离子通道,从而产生作用[24]。几种重要海洋生物毒素的相关特性见表3、4。

表 4 不同类别CNTX的毒害作用机制Table 4 Toxic mechanisms of different conotoxins
3 海洋生物毒素检测技术
3.1 生物分析法
3.1.1 小鼠生物分析法
小鼠生物分析(mouse bioassay,MBA)法是检测海洋生物毒素毒性大小的常见技术之一。采用MBA法分析DSP时,样品提取步骤繁琐且提取液易受其他基质干扰,导致检测误差较大。故为更好地完善MBA法在DSP检测上的应用,Lee等[32]将提取溶剂丙酮换成二乙基醚,消除了PSP干扰,但该法易损失低极性的DSP;而后改用添加己烷冲洗脂防酸的方法提取,检测灵敏度提高,OA检出限为0.8 μg/g。当加拿大首次爆发ASP中毒事件后,MBA法开始被用于检测ASP。向小鼠腹腔注射DA后,其出现身体失衡、走动蹒跚及痉挛等症状,检出限为40 μg/g;其中当毒素含量较高时(>100 μg/g),中毒症状与剂量之间有良好的相关性。
3.1.2 其他生物体分析法
生物分析法的检测对象除了小鼠外,还可选取家蝇、蝗虫、水蚤等生物进行毒素检测。采用家蝇生物分析法检测PSP,主要是将PSP的酸性提取液注入家蝇体内,然后观察记录家蝇的活动特征和死亡时间。该法与MBA法十分相似,用其检测贝样中STX,检出限为0.2 μg/g[33]。Hess等[34]采用水蚤生物分析法检测OA和DTX,检出限仅约为MBA法的1/10。在CFP的生物测试中,研究人员尝试采用多种生物进行测试,其中受试动物主要有小鸡、猫、卤虫、蚊子和双翅目幼虫等,其中小鸡、猫、双翅目幼虫用有毒鱼肉直接喂养,卤虫利用毒素提取溶液培养,蚊子采用毒素提取溶液注射,最后通过观察受试动物中毒情况来判断毒性,但这些方法均存在伦理道德问题的困扰且受自身弊端所限,无法推广使用。
3.1.3 细胞毒性分析法
细胞毒性分析法也称组织培养分析法,其毒性分析途径主要有3 个:1)采用显微观察受试细胞(如神经母细胞瘤细胞、鼠干细胞等)的形态变化[35-36];2)四甲基偶氮唑盐显色反应[37];3)采用荧光比色法测定F-actin蛋白的表达水平[38]。采用细胞毒性分析法检测PSP时,其原理基于箭毒和藜芦定对神经母细胞瘤细胞Na+通道具有协同开放作用,可促进Na+内流,改变细胞内外渗透压,最终使细胞形态肿胀甚至裂解死亡[39];而PSP作为Na+通道阻断剂对这种细胞肿胀起拮抗作用,且拮抗程度与毒素的剂量密切相关。Yamamori等[40]应用该原理,以小鼠神经细胞作为受试细胞,对PSP的关键组分STX进行细胞毒性测定。结果表明,STX检出限为0.4 μg/g,同时该团队采用神经细胞生物分析装置分析贝类中STX,检出限为0.02 μg/g,灵敏度远高于MBA法。
3.1.4 免疫分析法
Garthwaite等[41]建立一个可对PSP、DSP、ASP和NSP进行分析的酶联免疫分析(enzyme-linked immunosorbent assay,ELISA)筛选系统,其灵敏度高,同时使用乙醇提取可得到较高回收率。Kawatsu等[42]开发了一种基于单克隆抗体的间接竞争ELISA检测贝类中DA,检出限为0.04 μg/g,加标平均回收率为103%;Wang Li等[43]对该法进行优化并用其检测海鲜中的OA,检出限为0.45 ng/mL,与高效液相色谱(high performance liquid chromatography,HPLC)-荧光法结果的相关性为0.934 7,且有效避免了贝类基质的干扰。Zhou Yu等[44]基于单克隆抗体的胶体金免疫色谱条法检测河豚鱼组织中TTX,检出限为40 ng/mL。Liu Binghui等[45]采取同样的方法检测OA,10 min内即可完成检测,检出限为5 ng/mL;同时该作者结合ELISA分别对20 个海鲜样品中OA进行检测,两种方法数据吻合度高,具有较高的灵敏度和准确性,可用于快速筛查贝类样品中OA。随着技术发展及检测需要,大量简便快捷的商业化试剂盒应运而生。Harrison等[46]采用4 种商业化试剂盒(1 种ELISA试剂盒、1 种蛋白磷酸酶(protein phosphatase 2A,PP2A)试剂盒及2 种侧流免疫测定试剂盒)检测贝类DSP。研究表明,4 种试剂盒的检测结果与HPLC所测结果都具有较好的相关性,除PP2A试剂盒外,另外3 种试剂盒结果均存在假阴性。
3.1.5 磷酸酶抑制法
磷酸酶抑制法操作时需选择一种合适的物质(经酶催化后可在特定吸光度下发生显色反应)作为反应底物,最早且最常使用的底物为硝基苯磷酸盐(p-nitrophenyl phosphate,p-NPP),当待检毒素中含有衍生物时,结果易产生假阴性。Ramstad等[47]优化荧光检测法,将衍生物进行转换,假阴性概率降低,准确度和灵敏度提高,同时该学者也发现丝氨酸-苏氨酸PP2A溶液性质不稳定,最好现配现用。为防止酶溶液活性降低,学者们利用包埋法和金属配位化学法将PP2A与磁性颗粒(magnetic particles,MPs)结合,以提高酶溶液稳定性[48]。2018年,陈佳琦等[49]采用溶胶-凝胶(Sol-gel)技术对PP2A进行包埋并将其固定于微孔板底部,建立新的贝类毒素检测法(图4)。采用该法检测OA,检出限为0.05 μg/g,加标回收率为68.8%~119.4%。通过包埋处理一方面保证了PP2A活性(可于-18 ℃下至少保存4 个月);另一方面简化了试剂配制步骤,省时高效。不同生物分析法在海洋生物毒素检测应用上的比较,简单归纳如表5所示。
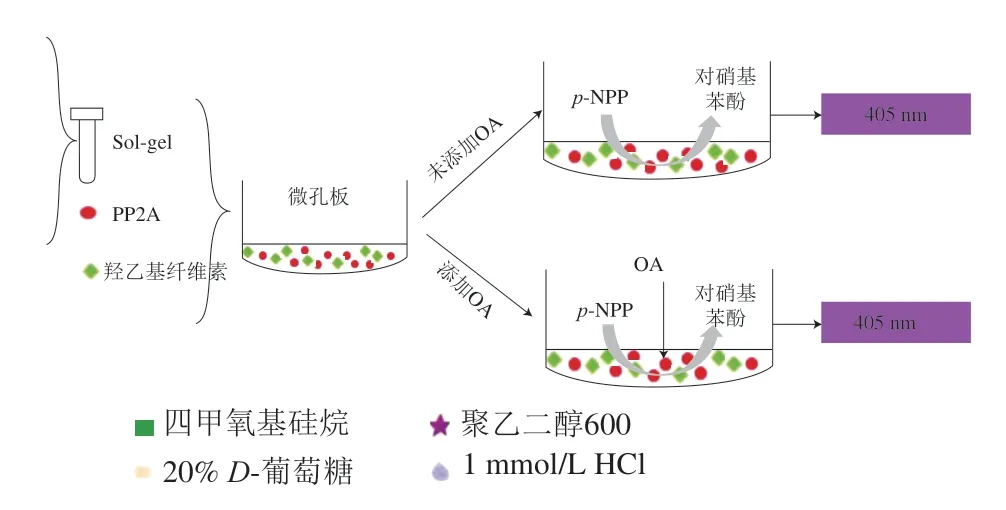
图 4 基于Sol-gel包埋的PP2A抑制比色法原理图[49]Fig. 4 Principle of the colorimetric assay of protein phosphatase 2A inhibition based on immobilization in sol-gel[49]

表 5 生物分析法在海洋生物毒素检测中的应用Table 5 Application of bioassays in the detection of marine biotoxins
3.2 物理化学分析法
3.2.1 高效液相色谱法
HPLC法包括HPLC-紫外检测法(HPLC-ultraviolet,HPLC-UV)、HPLC-荧光检测法(HPLC-fluorescence detector,HPLC-FLD),HPLC-质谱检测法(HPLC-mass spectrometry,HPLC-MS)等,其中在海洋生物毒素检测上最早得以应用的是HPLC-UV。
1989年,Lawrence等[50]首次采用HPLC-UV检测贻贝组织中的DA。该法采用体积分数50%甲醇溶液提取组织匀浆,并用强阴离子交换固相萃取(strong anion exchange-solid phase extraction,SAX-SPE)进行净化,检出限约为0.5 μg/g,但因粗提液纯度较低且含有色氨酸,结果极易出现假阳性。Donovan等[51]研究提出,采用甲醇-水提取组织样品后在可进行梯度洗脱和UV检测的反相C18色谱柱上分离,DA检出限降低到0.1 μg/g,回收率从89%提高到100%;该法减少了手动清洁样品步骤且有效避免了色氨酸的干扰。后来,López-Rivera等[52]省略SAX-SPE纯化步骤,通过控制流动相pH值实现从基质干扰物和色氨酸中分离出DA及其异构体,并对其进行等度色谱分离。当pH值为2.5时,DA平均提取率达98.5%,检出限为25 ng/mL。此方法已成功检测多种贝类毒素,操作简单、耗时少且灵敏度高。
对于部分海洋生物毒素来说,其自身对紫外的吸收较弱且无法产生荧光,但在碱性条件下先氧化再酸化可产生荧光物质,对此常用HPLC柱后衍生法进行检测分析。柱后荧光检测常用的衍生物主要有9-蒽基重氮甲烷(9-anthryldiazomethane,ADAM)、1-芘重氮甲烷、1-溴代乙酰基芘和4-溴甲基-7-甲基香豆素等[53]。其中使用频率最高的是ADAM,与其他试剂相比,其可在温和条件下进行快速定量反应,具有较高的选择性和灵敏度;但该试剂易分解,从而导致不完全衍生化并干扰分析,故其必须在低温下保存。为提高试剂稳定性,Nogueiras等[54]对ADAM合成方法进行改进并在流动相中添加终体积分数为15%的甲醇溶液,采用优化后的HPLC-FLD对OA进行检测,色谱分离度提高,检出限由1.0 ng/g降低到0.714 ng/g;但由于该法洗脱耗时长、仪器设备昂贵且对技术人员专业要求高,故其应用受到一定限制。基于此,江天久等[55]将两次等度洗脱合并为一次梯度洗脱,实现了一次进样即可同时定性定量待测样品中GTX和STX组分,极大缩短样品分析时间,其中dcGTX3的最低检出限为7 pg/g,GTX5的最高检出限为52 pg/g。Vale[56]采用同样的方法测定贻贝中OA及DTX-1,检出限分别为0.8 pg/g和1.3 pg/g。
随着质谱技术的高速发展,HPLC-MS逐渐成为毒素分析的一种主流技术。该技术克服传统HPLC的缺点,允许在没有毒素标品及衍生物的情况下,对毒素进行定性定量分析,具有灵敏度高、耗时短、检出限低、重现性好等优点。Stobo等[57]利用HPLC-MS检测OA、DTX-1、DTX-2、YTX、PTX-1、PTX-2、AZA-1、AZA-2和AZA-3。该法采用无水甲醇-水(80∶20,V/V)提取贝类中毒素,再利用C8反相柱对毒素进行梯度洗脱分离。结果显示,OA、PTX-2和AZA-1的检测范围为0.013~0.250 μg/g,YTX的检测范围为0.1~0.4 μg/g。Braña-Magdalena等[58]优化样品前处理条件,建立超高效液相色谱-MS/MS检测方法。该法可在酸性条件下通过快速极性切换鉴定出14 种亲脂性海洋毒素。在快速极性切换中,动态多反应监测优于静态多反应监测,显现出检出限更低、重现性更好且样品通量更大等优点;同时结合与基质匹配的标准品对贻贝提取液中毒素进行准确定量,分析时间少于3 d,其中DTX1、DTX2、YTX和AZA1的回收率均为80%~120%,相对标准偏差≤8%。de la Iglesia等[59]利用快速液相色谱-串联四级杆质谱(rapid resolution liquid chromatography-mass spectrometry,RRLC-MS/MS)的方法快速分离贝类中ASP。该法可直接分析粗提物,无需进一步纯化,整个过程不到3 min即可完全分离出DA及其异构体,检出限为0.05 μg/g;与LC-UV检测结果一致(R2=0.975 1),可用于基质较复杂的毒素检测。
3.2.2 薄层色谱法
薄层色谱法(thin-layer chromatography,TLC)是食品分析领域中广泛使用的技术,过去常用其筛查农业产品中是否存在霉菌毒素[60],如今,TLC逐步应用到海洋毒素的检测分析中。Quilliam等[61]开发了一种结合SPE纯化的TLC用于半定量分析贝类组织中DA,使用手持式短波紫外线灯检测发现DA含量低至10 μg/g,同时采用茚三酮喷涂硅胶TLC板发现茚三酮与DA的仲胺反应生成鲜明的黄色产物。该TLC简单快速,且不需要使用昂贵的设备,故适合未配备LC系统的实验室进行贝类组织的常规筛查。Indrasena等[62]联合火焰热离子检测器(flame thermionic detector,FTID)建立针对PSP检测的TLC。结果显示,FTID响应随着检测器电流和扫描时间的延长增加,当检测器电流提高到3.3 A时,FTID响应比FID高出130 倍;采用该法检测GTX 2/3、STX、neo-STX,其检出限分别为0.4、2.1 μg/g和0.8 μg/g。
3.2.3 毛细管电泳法
毛细管电泳法(capillary electrophoresis,CE)常用检测器有紫外检测器、激光诱导荧光(laser induced fluorescence,LIF)检测器和电化学检测器,其中最早得以应用的是UV检测器。Bouaicha等[63]首先用配有UV检测器的胶束电动毛细管色谱法鉴定贻贝中OA与DTX-2,但因缓冲液选择不佳,致使实验结果不理想。Kinoshita等[64]优化传统UV法后测定贝类中OA和DTX-1,两者检出限均为3.25 μg/mL,而后又通过控制缓冲液pH值,开发了准静态扫描富集分析技术,实现增大进样量的同时将STX和DA的检测灵敏度分别提高了950 倍和810 倍。Gago-Martínez等[65]建立一种用于分析DA的毛细管电泳色谱法(capillary electrochromatography,CEC)。研究发现,电流流过色谱柱时由于产热易出现气泡,产生基线噪音,从而难以获得稳定的流动相条件;此外,采用电动注射,样品基质易受电导率影响,稳定性和可重复性低。为更好地完善CEC,Wu Weimin等[66]结合CEC的高效性和HPLC的高选择性提出了加压毛细管电泳色谱法(pressurized capillary electrochromatography,pCEC),其HPLC泵连接到毛细管的入口端,用溶剂向毛细管柱提供辅助压力从而抑制气泡形成,并采用螺旋式进样器实现定量进样。在最佳条件下,该法6 min即可分离出DA,检出限为2 mg/g。因毛细管柱的光路长度较短,故其检测灵敏度较低。为此,Cheng Yongqiang等[67]开发了一种低试剂消耗且稳定灵敏的pCEC-LIF技术,60 s内即可完全分离DA,检出限可达15 ng/g,灵敏度高于pCEC-UV且流动相消耗仅为常规HPLC的1/800。
3.2.4 拉曼光谱法
近年来,表面增强拉曼光谱(surface-enhanced Raman spectroscopy,SERS)凭借高选择性检测样品中目标分子而备受关注。Yao Yiping等[68]通过紫外共振拉曼法检测DA,当激发波长为242 nm和257 nm时,其检出限分别为1 μg/mL和2.5 μg/mL。研究表明,基于Ag纳米粒子的胶体水溶胶对STX进行SERS快速检测,5 s即可完成40 ng/mL STX样品的光谱收集,其检出限为3 ng/mL;同时该作者采用1 min的总积分时间(每次10 s,6 次累积)收集SERS光谱以提高信噪比,减少了样品处理和底物制备工作。基于此,Müller等[69]分别以纯Ag纳米粒子和氨基化的Ag纳米粒子为基质,以蒸馏水和海水为溶剂,对贝类中DA进行SERS检测。结果显示,采用氨基化的Ag纳米粒子效果优于未氨基化的Ag纳米粒子,采用海水溶解的检出限低于蒸馏水溶解的检出限,分别为0.033 ng/mL和0.33 ng/mL。为进一步缩短检测时间,Huai Qiyong等[70]采用SERS结合激光镊子拉曼光谱检测STX,该法2 s内即可获得拉曼光谱峰,检出限为2 ng/mL。Traynor等[71]应用滴涂沉积拉曼技术检测低浓度样品中的DA,其拉曼光谱信号清晰且无噪音,检出限为25 ng/mL。
物理化学法主要依赖于色谱分离技术和紫外、荧光、质谱定性定量技术,其在海洋生物毒素检测方面的应用简单归纳如表6所示。
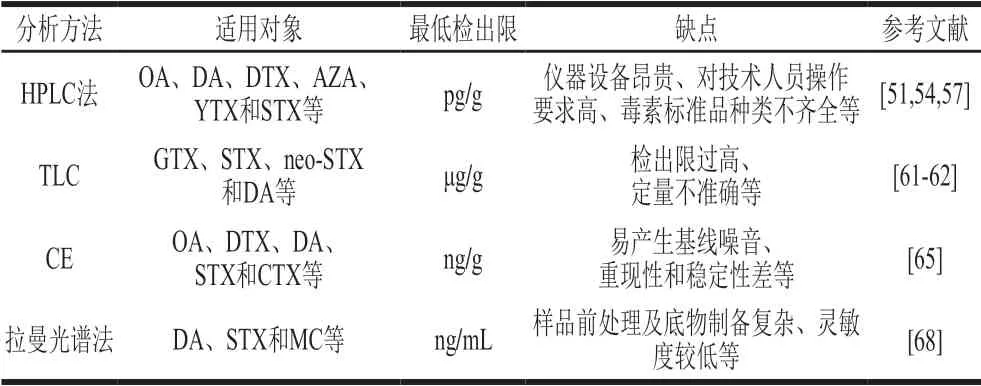
表 6 物理化学法在海洋生物毒素检测中的应用Table 6 Applications of physicochemical methods in the detection of marine biotoxins
3.3 电化学生物传感器法
3.3.1 免疫传感器
免疫传感器的设计关键是表面免疫固定技术的选择。在多数情况下,牛血清白蛋白(bovine serum albumin,BSA)或卵清蛋白常被用作毒素固定在电极表面上的载体。Campàs等[72]将竞争ELISA与酶标记进行结合,开发用于检测贝类中OA(图5)。该法将碱性磷酸酶(alkaline phosphatase,ALP)和辣根过氧化物酶(horseradish peroxidase,HRP)作为标记物进行信号追踪,采用计时电流法对OA进行检测,其检出限分别为1.07 ng/mL和1.98 ng/mL;为进一步提高其灵敏度,该作者采用心肌黄酶优化ALP标记,检出限降低至0.03 ng/mL。与MBA法相比,该法不仅分析时间短、检出限低,而且有效避免了YTXs的干扰,防止出现假阳性。对于低分子质量毒素(如PbTX等),通常只有一个羟基可用于交联,这阻碍了其在免疫传感器上的固定化。Micheli等[73]对首次开发的PbTX电化学免疫传感器进行改造,获得PbTX-BSA结合物,并将该结合物固定在丝网印刷电极(screen-printed carbon electrode,SPCE)表面进行竞争性分析,检出限为6 ng/mL。Hayat等[74]研究发现,在电极表面涂覆蛋白质载体会降低传感器灵敏度及电子传递速度。因此,该团队研究建立了两种毒素固定方法(基于重氮偶联反应机理在SPCE表面直接固定OA;采用链霉亲和素包被免疫磁珠(immunomagnetic beads,IMBs)固定OA)。结果显示,前者检出限为1.44 pg/mL,低于欧盟指定的检出限(2.4 ng/mL)[72];后者检出限为0.38 ng/mL,毒素回收率为96%,且不受基质效应的干扰。另外,研究人员用树状大分子固定PbTX-2,同时结合金纳米粒子(gold nanoparticles,AuNPs)进行检测。结果表明,三维网络的应用大大提高免疫固定化率,此外,利用AuNPs提高了传感器灵敏度,检出限为0.01 ng/mL,远低于仅含AuNPs或树状大分子的免疫传感器(分别为0.5 ng/mL和0.1 ng/mL)[75]。研究表明,利用多壁碳纳米管(multi-walled carbon nanotube,MWCNT)修饰电极,可减少非特异性吸附,降低基质效应,提高该传感器的适用性。2015年,Reverté等[76]开发了结合AuNPs和聚乙烯的电化学生物传感器用于检测河豚中TTX,检出限为0.07 μg/g,低于免疫比色法(检出限0.23 μg/g),同时基质效应降低。随后Leonardo等[77]将IMBs与八电极阵列相结合,实现了AZAs的多重电化学检测,检出限比免疫比色分析降低了2.6 ng/mL。
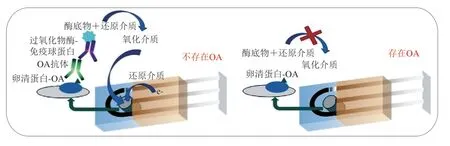
图 5 基于竞争性间接检测OA的电化学免疫传感器[78]Fig. 5 Electrochemical immunosensor for okadaicacid detection based on a competitive indirect assay[78]
3.3.2 酶传感器
迄今为止,只有PP2A和磷酸二酯酶已被确定为特定的海洋毒素生物识别分子,其中DSP和MC、YTX可对其活性产生抑制作用。采用酶传感器法检测DSP的主要挑战是聚丙烯的不稳定性及样品基质对酶活性的影响。目前,为提高酶稳定性,通常将酶包埋后再把聚丙烯固定在微量板上对毒素进行检测,同时使用固相萃取分离样品以降低基质效应。2007年,Campàs等[78]首次将聚丙烯固定在SPCE上,采用单磷酸淀粉测定酶活性,开发相应的酶传感器。采用该传感器对OA进行检测,其检出限为6.42 ng/mL;同时对甲藻提取物进行分析,结果与HPLC-MS法测定的结果吻合度高。这种固定方法虽然保证了酶稳定性,但同时酶与底物、毒素之间的特异性识别受限。为克服这种弊端,可采用氨基酸残基与金属亲和作用进行固定化,将酶固定在Ni改性的IMBs上。Gu Huajie等[79]开发了将MWCNT膜结合到电极表面的生物传感器,由于MWCNT侧壁与酶上芳香环之间的氢键和π-π堆积作用,故酶的固定化过程是稳定的。采用该法检测贝类中OA,检出限为2.75 μg/g。Ikehara等[80]基于MC对PP2A的抑制作用,研发了用于检测MC的安培生物传感器。该法将经包埋后的PP2A固定在经石墨烯修饰的SPCE上,以单磷酸儿茶酚基酯、磷酸α-萘基磷酸酯及4-甲基伞形基磷酸酯作为磷酸化底物,通过电化学方法检测PP2A活性,从而判断毒素活性。采用该法对水华样品MC进行分析,当35%和100% PP2A被抑制时,其检出限分别为0.037 μg/mL和1 μg/mL。Smienk等[81]将OA的蛋白磷酸酶抑制与丙酮酸氧化酶的磷酸盐离子消耗相结合进行检测,检出限为0.1 ng/mL,仅约为比色免疫法的1/50。
3.3.3 适配体传感器
适配体传感器中的适配体作为特异性识别受体,具有以下特点:1)选择过程在体外,避免了动物实验且成本低;2)高度稳定,可长期储存;3)极易被功能基团修饰。Eissa等[82]研制无标记阻抗传感器检测OA。该法将适配体固定在金电极上,通过与毒素结合的适配体构象改变而引起的阻抗信号变化来监测海洋毒素,其检出限为70 pg/mL;在贝类样品分析中,毒素回收率达92%。2015年,Eissa等[83]首次从大量体外随机序列中成功筛选出对PbTX-2具有高亲和力的DNA适配体,对加标贝类提取物中的PbTX-2进行检测,检出限为106 pg/mL,回收率达110%,且未发现与其他海洋毒素的交叉反应,该法将有助于食品样品中PbTX-2的常规检测。为准确检测较低浓度的PTX,Gao Shunxiang等[84]结合生物层干涉法引入基于HRP适配体的信号增强技术,10 min即可实现对海鲜中PTX的实时检测,检出限为0.04 pg/mL;该传感器重现性高、稳定性好且可特异性区分PTX与其他海洋生物毒素。
3.3.4 细胞传感器
STX、TTX和PSP均可通过抑制流经Na+通道的离子电流而干扰Na+通道功能。基于此,Wang Qin等[85]利用心肌细胞建立阻抗生物传感器检测STX和TTX,该生物传感器可同时监视心肌细胞的生长和跳动状态,对STX和TTX的检出限分别为0.087 ng/mL和0.089 ng/mL。同年,该作者联合心肌细胞和微电极阵列快速检测STX和PbTX-2。结果显示,5 min即可完成检测,STX和PbTX-2的检出限分别为0.35 ng/mL和1.55 ng/mL。Zou Ling等[86]利用神经母细胞瘤细胞设计了阻抗生物传感器(cell impedance biosensor,CIB)检测PSP。研究表明,该传感器灵敏度和特异性高,检出限低至0.03 ng/mL,低于MBA法检出限(200 ng/mL)和分析化学家协会HPLC官方方法检出限(1.2 ng/mL)。此外,该作者还基于人类HeLa和HepG2细胞系分别建立CIB,以动态、实时的方式检测DSP,其检出限分别为10.2 μg/L和3.3 μg/L,均低于传统的细胞测定法(HeLa细胞:21.2 μg/L;HepG2细胞:9.8 μg/L),且与MBA、LCMS/MS法的测定结果之间具有良好的相关性[87]。
电化学生物传感器主要是利用特定生物分子与海洋毒素间的高亲和力,通过信号转化实现海洋毒素的高灵敏检测。由于相关设备的微型化、便携化和自动化,使得生物传感器在现场检测和在线监控方面具有很好的应用前景,其在海洋生物毒素检测上的应用,简单归纳如表7所示。

表 7 电化学生物传感器在海洋生物毒素检测中的应用Table 7 Applications of electrochemical biosensors in the detection of marine biotoxins
4 结 语
作为海洋生物生产的天然活性产物,海洋生物毒素是自然界已知化合物中结构最复杂、毒性差别最大的种类之一。随着因赤潮引发的海产品毒素污染问题日益严重及各类食物中毒事件的频繁发生,人们更加意识到海洋生物毒素的潜在危害,该类毒素毒性强、致死量低,对人民健康及社会公共安全构成了极大威胁。因此,深入了解海洋生物毒素并及时监测对保障人民健康尤为重要。
目前,海洋生物毒素作用机理方面的研究虽然取得了突破性进展,但仍有一些毒素的作用机理尚不清楚,且尚无切实可行的方法去除海产品体内的毒素以防止其进入人体,所以深入学习海洋生物毒素的结构特点,强化研究其毒害作用机制,从而对海洋生物毒素进行风险评估是必需的。同时在海洋生物毒素检测上,一方面应简化样品前处理方式,提高待测样品及试液纯度,并开发特异性强的基因芯片和生物传感器,提高检测专一性与灵敏度;另一方面应加大商业化试剂盒、便携式检测工具及自动化检测仪器的开发,简化操作步骤,实现检测技术日常化。此外,为了保护消费者健康,适当的风险评估和海产品的监管控制极为重要,为此,我国应加强相关法律法规建设,健全市场监察制度,以更好地保障消费者的食品安全。
