IPA 模式对鲤生长、肌肉和血浆中游离氨基酸含量的影响
2021-03-31李晓东胡建勇
李晓东,胡建勇,高 攀,李 林,刘 晶
(新疆维吾尔自治区水产科学研究所,农业部西北地区渔业资源环境科学观测实验站,新疆乌鲁木齐 830000)
新疆地处我国西北地区,水资源时空分配不均,水产养殖受水资源的制约和用水政策影响较大,尤其是池塘养殖业受到的不利影响更为深远;提升渔业养殖用水效率,实施高效节水养殖已成为新疆池塘养殖业从业者所面临的难题。近年来,本地区开展了以节水、高效为重点的设施化池塘养殖技术的试验,相比传统池塘养殖,集约化池塘内循环流水养殖系统(intensive pond aquaculture,IPA)因水资源利用效率高、环境友好备受行业从业者关注。而养殖效益作为衡量水产养殖业的主要指标,受技术、管理等影响较大,研究IPA 模式水流刺激对养殖鱼类生理生化的影响,对于揭示养殖品种的能量利用及提升经济效益具有重要意义。现有证据表明西伯利亚鲟Acipenser baerii 和俄罗斯鲟A.gueldenstaedti 在循环水养殖条件下均可快速生长,但西伯利亚鲟具有更强的抗氧化能力和消化能力[1];而在池塘养殖模式下,大口黑鲈Micropterus salmoides 等肉营养和肉质的表现比循环水养殖的差[2]。
蛋白质在鱼类营养中具有重要作用,而氨基酸作为蛋白质的基本组成成分,其在调控鱼类生理活动和行为习性中起关键作用,其含量亦受摄食及鱼体自身蛋白质代谢的影响。血液循环系统通过红细胞与血浆的相互作用在氨基酸转运中起关键作用,其与多种组织细胞内氨基酸含量有密切关系,而肌肉作为鱼体的主要组织,是游离氨基酸的主要储存场所,尤其以白色肌肉更为甚之[3-4]。鉴于此,本研究以鲤C.carpio 为对象,通过基于IPA 原理的浮式池塘内循环系统和普通池塘养殖试验,比较不同养殖模式下鲤鱼肌肉和血浆中游离氨基酸变化情况,探讨IPA 模式水流对鱼类的影响,在理论上丰富了鱼类运动与营养代谢方面的内容,实践上可为今后改善养殖条件、提高养殖鱼类的生长速度、完善品质和营养价值提供科学依据。
1 材料与方法
1.1 试验条件
试验地点位于新疆水生野生动物救护中心。以普通标准化的土池塘作为对照塘,各2 口,水面面积均为0.3 hm2;以IPA 浮式养殖系统为试验塘,由2 口面积均为0.3 hm2的池塘(A 池、B 池)组成,如图1 所示,构建浮式养殖平台系统(以下简称“平台系统”)用于养殖试验,其所需水源从B 池抽取,排放尾水依次进入A 池、B 池;在A、B 池中投放一定数量的鲢鳙等滤食性水生动物;设置植物浮床种植水生植物,实现水体净化,经过一定的流程后实现养殖水体循环利用。
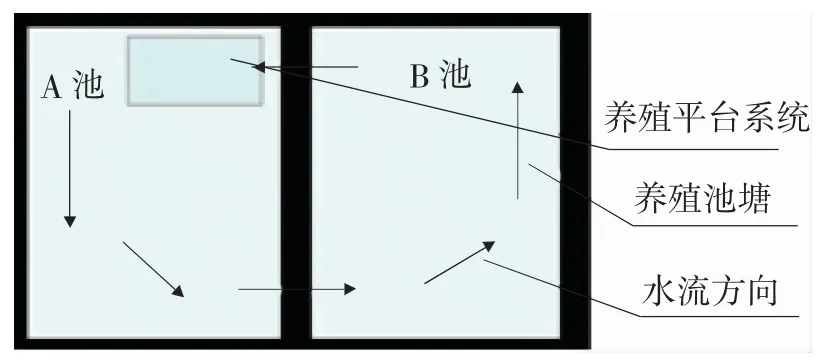
图1 基于IPA 原理的养殖系统Fig.1 Breeding system based on IPA principle
平台系统操作平台包括浮体单元结构和养殖单元结构。浮体单元框架由40 mm×40 mm×3 mm 的镀锌角铁焊接而成,并铺设格栅板,浮体为厚度25 cm 的泡沫板。平台系统养殖池为自制帆布池,直径3 m,圆柱体墙高1 m,底部圆锥体高0.5 m,在圆锥体最低处设置直径为60 mm 的排污口。在帆布池圆柱体与圆锥体连接处铺设微孔曝气管,通过罗茨风机供气持续增氧,使池内水体形成由四周向中心的涡旋状态,以便将残饵和粪便集中到底部圆锥排污口,再通过排污管道到达集污池,沉淀过滤后,尾水进入池塘,通过池塘内净化后再次进入帆布池,形成循环。
1.2 试验鱼放养及管理
易捕鲤C.carpio var.Yibu 为从中国水产科学研究院黑龙江水产研究所引进的水花苗种培育而成,建鲤C.carpio var.Jian 为亲本自繁水花培育而成。对照池放养模式分别为:主养易捕鲤(1.5×104尾·hm-2)、套养鲢鳙(鲢:1.5×103尾·hm-2,鳙:7.5×102尾·hm-2);主养建鲤(1.5×104尾·hm-2)、套养鲢鳙(鲢:1.5×103尾·hm-2,鳙:7.5×102尾·hm-2)。平台系统试验池分别单养易捕鲤、建鲤,每种鱼使用3 个养殖池,放养密度均为10 kg·m-3水体,即每个养殖池投放60 kg,外塘放养适量鲢鳙鱼,利用植物浮床种植水蕹菜等水生植物。养殖时间56 d,养殖期间,投喂浮性颗粒饲料,饲料来源于成都海大生物科技有限公司生产的鱼种专用料。其营养成分如表1 所示。

表1 饲料主要营养成分Tab.1 Main nutritional components of feed
养殖期间采用饱食投喂。养殖平台系统保持持续进水和增氧状态,增氧的强度以使养殖池中的粪便等颗粒物向鱼池中心聚集为准,以便其及时通过底部排污口排出;养殖平台外塘的增氧设施为微孔曝气增氧系统,每天根据安装的物联网系统设置的水中溶氧情况,适时自动增氧。养殖期间,水温维持在23~28 ℃,pH 7.3~7.8,溶氧≥5.8 mg·L-1,氨氮≤0.1 mg·L-1。
1.3 样品采集与指标测定
1.3.1 样品采集
试验结束,饥饿24 h,分别从对照池塘随机选取15 尾鱼,作为对照组样本,然后从平台系统每个养殖池随机选取5 尾试验鱼,分别混合后获得易捕鲤和建鲤的试验组样本,测量其体重、体长、全长等指标,有关计算公式如下:

式中:WGR 为增重率,%;SR 为成活率,%;SGR 为特定生长率,%;FER 为饲料转化效率,%;Wi为试验开始时鱼体重,g;Wf为试验结束时鱼体重,g;t 为养殖试验天数,d;F 为摄食量,g;P 为粗蛋白含量,%;Wt为鱼体重量,g;Wh为肝脏质量,g;Wb为内脏质量,g;We为肠系膜脂肪重量,g。
分别从每个养殖池随机选取3 尾鱼,利用浸润肝素钠(5 mL)采血管尾静脉采血法抽取血液1 mL,置于洁净的1.5 mL 离心管中,以常温4 000 r·min-1离心8 min,取上层血浆于-80 ℃冰箱保存备用。在采血结束后,分别取下鱼体背部两侧白色肌肉,搅碎混匀后取混合样品50 g,在-80 ℃条件下作短暂保存。
1.3.2 游离氨基酸含量测定
委托上海百趣生物医学科技有限公司进行血浆和肌肉中游离氨基酸含量的测定。称取样品于EP 管中,加入1 000 μL 提取液(体积比,乙腈-甲醇-水,2:2:1,-20 ℃),涡旋30 s 混匀;加入钢珠,45 Hz 研磨处理4 min,冰水浴条件下超声5 min,重复此步骤3 次;-20 ℃静置1 h;取出样品4 ℃,12 000 r·min-1离心15 min;取80 μL 上清液至LC 进样瓶中,用于LC-MS/MS 分析。另取上清液分别稀释10 倍、100 倍后用于LC-MS/MS 分析。
1.4 数据处理与分析
实验数据用Excel 2010 和SPSS 24.0 软件进行统计分析,显著性方差分析法采用单因素方差分析进行显著性检验。
2 结果与分析
2.1 不同养殖模式对2 种鲤生长及饵料利用的影响
如表2,与对照组比较,IPA 模式下易捕鲤、建鲤体增重均不同程度增加(P<0.05)。其中,易捕鲤提增重率达到了110.57%,建鲤增重率达到了92.98%。在特定生长率方面,试验组均显著高于对照组(P<0.05),且IPA 模式下易捕鲤较建鲤高13.73%(P<0.05);各组养殖成活率均达到97%以上;从饲料转化效率看,对照组均高于试验组(P<0.05),而2 种鱼在同一模式下,差异不明显。
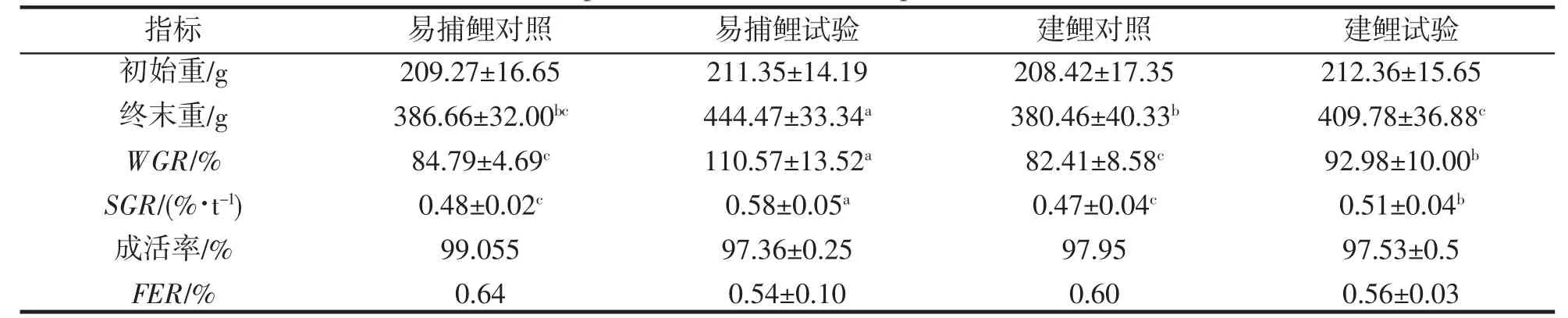
表2 不同养殖模式对2 种鲤生长与摄食的影响Tab.2 Effects of different culture modes on growth and feeding of two species of C.carpio var.Yibu and C.carpio var.Jian
2.2 不同养殖模式下,2 种鲤鱼白色肌肉中游离氨基酸含量变化
本试验共检测了色氨酸(Trp)、苯丙氨酸(Phe)、缬氨酸(Val)、甲硫氨酸(Met)、异亮氨酸(Ile)、精氨酸(Arg)、组氨酸(His)、亮氨酸(Leu)、苏氨酸(Thr)、赖氨酸(Lys)、酪氨酸(Tyr)、脯氨酸(Pro)、甘氨酸(Gly)、谷氨酸(Glu)、天冬氨酸(Asp)、天冬酰胺(Asn)、丙氨酸(Ala)、谷氨酰胺(Gln)、丝氨酸(Ser)等19 种游离氨基酸。由图2 可知,建鲤白色肌肉游离氨基酸中苏氨酸、甘氨酸、丝氨酸、赖氨酸、天冬氨酸、天冬酰胺在试验组中含量与对照组中含量差异显著(P<0.05),其中前3 种呈显著降低,后3 种呈显著增加;而易捕鲤肌肉游离氨基酸中仅赖氨酸和谷氨酸在试验组中含量与对照组中含量差异显著(P<0.05),其中赖氨酸呈现显著增加,谷氨酸呈现显著降低。通过计算肌肉中的总游离氨基酸(total free amino acid,TFAA)和游离氨基酸中必需氨基酸含量(essential amino acid,EAA)、支链氨基酸(branched-chain amino acids,BCAA)、芳香族氨基酸(aromatic amino acid,AAA)含量,2 种鲤鱼TFAA、EAA、BCAA、AAA 均表现出差异不显著(图3)。

图2 池塘与IPA 养殖模式下2 种鲤鱼肌肉中游离氨基酸含量Fig.2 Contents of free amino acids in white muscle of C.carpio var.Yibu and C.carpio var.Jian under pond and IPA culture mode

图3 池塘与IPA 养殖模式下2 种鲤鱼白色肌肉中TFAA、EAA、BCAA、AAA 含量Fig.3 Contents of TFAA、EAA、BCAA、AAA in white muscle of C.carpio var.Yibu and C.carpio var.Jian under pond and IPA culture mode
2.3 不同养殖模式下,2 种鲤鱼血浆中游离氨基酸含量变化
本试验在2 种鲤鱼血浆检测的前述19 种游离氨基酸中,建鲤仅有丙氨酸差异不显著,其他18 种氨基酸试验组含量较对照组含量呈现显著增加(P<0.05);而易捕鲤中除天冬氨酸、天冬酰胺、丙氨酸外其他16种氨基酸试验组含量较对照组含量呈现显著降低(P<0.05)(图4)。通过计算肌肉中的总游离氨基酸(total free amino acid,TFAA)和游离氨基酸中必需氨基酸含量(essential amino acid,EAA)、支链氨基酸(branched-chain amino acids,BCAA)、芳香族氨基酸(aromatic amino acid,AAA)含量,2 种鲤鱼TFAA、EAA、BCAA、AAA 均表现出差异显著(P<0.05),其中建鲤呈显著增加而易捕鲤呈显著降低(图5)。
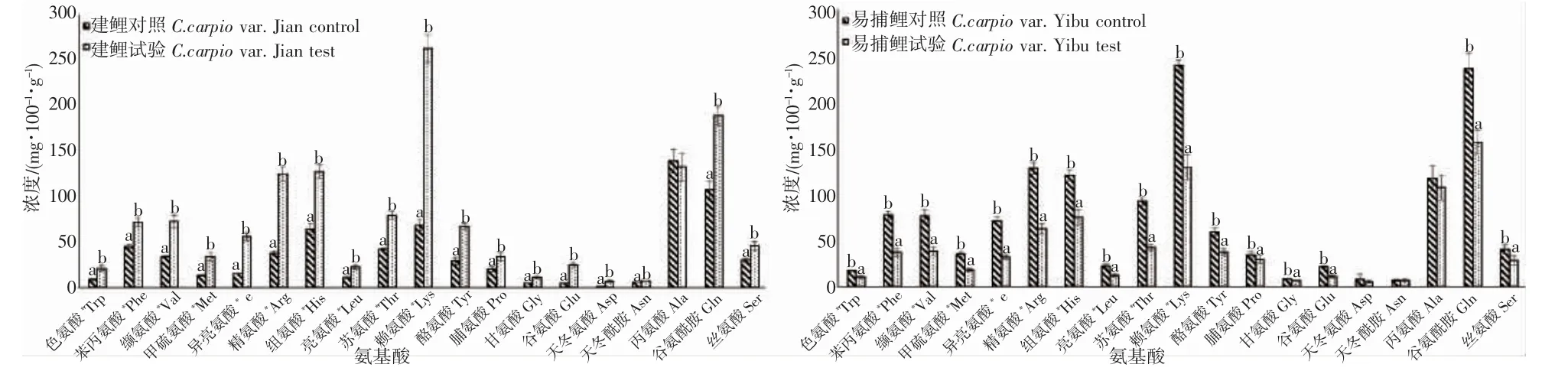
图4 池塘与IPA 养殖模式下2 种鲤鱼血浆中游离氨基酸含量Fig.4 Contents of free amino acids in plasma of C.carpio var.Yibu and C.carpio var.Jian under pond and IPA culture mode

图5 池塘与IPA 养殖模式下2 种鲤鱼血浆中游离氨基酸含量Fig.5 Contents of TFAA、EAA、BCAA、AAA in plasma of C.carpio var.Yibu and C.carpio var.Jian under pond and IPA culture mode
3 讨论
3.1 养殖模式对2 种鲤生长的影响
鱼类通过摄食获取的蛋白质消化为游离氨基酸后通过肠道吸收经血液循环系统运输至各个器官用于多种组织蛋白合成、糖异生、脂类合成及参与能量代谢[4-6]。但对于养殖而言,如何使摄食蛋白最大化的用于鱼类生长进而提升养殖效益是生产者所关注的焦点,而鱼体肌肉蛋白作为鱼体肌肉的主要组成部分其与评价鱼类经济价值的重要指标含肉率及营养成分密切相关,受养殖模式、养殖品种影响[7-9]。
养殖环境或条件能显著影响鱼类的生长性能,在集约化水产养殖生产中,由于养殖密度增加,带来养殖对象拥挤胁迫,从而影响生长[10-11]。本试验结果显示,IPA 模式下,易捕鲤和建鲤的生长性能均显著高于池塘养殖模式,这与大口黑鲈M.salmoides 等[12-13]鱼类研究结果一致;而与黄颡鱼(Pelteobagrus fulvidraco)等[10]鱼类研究结果相反;另外,本研究中,无论IPA 模式还是池塘模式,易捕鲤生长性能均不同程度高于建鲤,这可能与品种自身特性有关。
3.2 养殖模式对两种鲤肌肉游离氨基酸含量的影响
游离氨基酸作为合成肌肉蛋白的条件因子,同样受品种、养殖模式的影响,笔者发现,在IPA 和静水池塘养殖模式下,2 种鲤鱼肌肉游离氨基酸总含量均差异不显著,这与Piaractu mesopotamicus[14]在较低流速下(流速等于体长)所获得的结果一致,但该鱼在高流速情况下(流速等于2 倍体长)肌肉中游离氨基酸总含量比对照组显著增加,这从另一方面说明鱼类肌肉中的游离氨基酸含量与鱼类生存环境密切相关,这在异育银鲫Carassius auratus gibelio[15]的研究中有类似的结果。就鱼类肌肉中的不同种类游离氨基酸含量而言,亦受养殖模式、品种影响,罗非鱼Oreochromis mossambicus 在池塘和水库养殖模式下,前者肌肉游离氨基酸中天冬氨酸、丝氨酸、谷氨酸、甘氨酸、丙氨酸含量显著高于后者[16];草鱼Ctenopharyngodon idella 经投喂蚕豆脆化养殖后肌肉游离氨基酸中的丙氨酸、异亮氨酸、赖氨酸含量高于普通草鱼但甘氨酸、亮氨酸含量低于普通草鱼[17];同在池塘养殖模式下,南方大口鲶Silurus soldatovi meridionalis 和鲶鱼S.asotus 肌肉中的游离氨基酸含量具有差异性,前者苏氨酸、甘氨酸、丙氨酸含量高于后者而异亮氨酸、亮氨酸低于后者[18]。同样,笔者发现在2 种养殖模式下2 种鲤鱼肌肉中的不同种类游离氨基酸含量受养殖模式及养殖品种影响,建鲤和易捕鲤虽在养殖中均当做鲤鱼新品种,但二者遗传背景差异极大[19-20],这种差异可能是导致同一养殖模式下2 种鲤鱼肌肉游离氨基酸种类及含量彼此差异的内在因素。
3.3 养殖模式对2 种鲤血浆游离氨基酸含量的影响
血液循环系统作为动物营养物质运输的唯一通道,其血浆中游离氨基酸水平与鱼类新陈代谢水平密切相关,在鱼类能量代谢中扮演着重要的角色。在碱性胁迫下,瓦氏雅罗鱼Leuciscus waleckii 通过调控机体代谢提升血浆中的游离氨基酸水平以满足机体所需能量,以维持机体正常生理机能[21]。本试验结果显示,在血浆中,建鲤在IPA 模式下除丙氨酸含量与对照差异不显著外其他氨基酸含量均显著增加,而易捕鲤除丙氨酸、天冬氨酸、天冬酰胺含量与对照差异不显著外其他氨基酸含量均显著下降。因此,我们推测建鲤在池塘模式下而易捕鲤在IPA 养殖模式下所需能量较高,血浆中游离氨基酸中的丙氨酸、天冬氨酸转运至肝脏参与糖异生而满足其生理能量需要[3],现有研究发现老鼠经长时间运动后其血浆中游离的丙氨酸和酸性氨基酸及其酰胺类氨基酸浓度下降[22];并且我们通过二者的选育背景可知[19-20],大头鲤C.pellegrini作为选育易捕鲤的亲本,其为中上层鱼类且易捕鲤在亲缘关系中偏向该鱼而建鲤是底栖鱼类[23-25],因此,这种生态位的差异可能是2 种鲤鱼在不同养殖模式下能量利用差异的根本原因,因为流水模式能否促进鱼类生长及提升能量利用效率在多种鱼类的研究中结果大相径庭[26]。
4 结论
IPA 养殖模式下,易捕鲤和建鲤均表现出更好的生长性能,但易捕鲤表现得更优;在游离氨基酸含量方面,2 种鲤鱼肌肉中仅有少部分种类的氨基酸含量受养殖模式的影响,而在血浆中则绝大多数种类的游离氨基酸含量受养殖模式的影响,并且血浆中的绝大多数游离氨基酸含量的变化在2 种鲤鱼中呈现出相反的趋势。
