猪RXRB基因SNPs检测及其与生长育肥和繁殖性状的关联分析
2021-03-30彭雅鑫赵诗瑜徐在言
彭雅鑫,刘 军,赵诗瑜,徐在言,左 波*
(1.华中农业大学 农业部猪遗传育种重点实验室,武汉 430070; 2.华中农业大学动物医学院 基础兽医系,武汉 430070)
随着高通量测序技术的飞速发展和测序成本的降低,国内外许多研究人员利用猪的高密度芯片对猪重要经济性状进行了GWAS研究,鉴定出大量的SNPs标记、QTLs和候选基因,为猪的遗传育种提供了必要的分子基础[1]。其中,SNP分子标记多态性高、密度大、遗传稳定性高、易于实现自动化高通量基因分型,在表型与基因型关联性研究中起重要作用[2],因而被广泛应用于人类和动植物各项遗传学研究,包括遗传图谱构建、连锁分析、关联分析、基因组预测等[3]。分子遗传标记与动物分子育种技术加快了品种改良和新品系培育速度[4]。目前,SNP的应用已成为了研究猪遗传育种领域不可或缺的工具之一。
视黄酸X受体β(retinoid X receptor beta,RXRB)基因定位在猪7号染色体上,由10个外显子和9个内含子组成。视黄素X受体(retinoid X receptor, RXR)是一种能使视黄酸受体(retinoic acid receptor, RAR)发挥正常作用的辅助蛋白,它与RAR可形成异源二聚体,使RAR与其配体更容易结合,从而增强RAR的转录和与配体的亲和力[5-7],也可以通过与其他核激素受体形成二聚体来激活多种功能,从而促进不同信号通路的活动[8]。RXR作为一种转录因子,属于核转录调节因子超家族一员,该家族还包含了维生素D受体、甲状腺激素受体、类固醇激素受体以及所谓的孤儿受体。自1990年RXR被分离并鉴定为核受体超家族成员以来,人们对核受体的生理调节产生了新的认识,从生物学上讲,RXR通过与过氧化物酶体增殖物激活受体(PPAR)和肝X受体(LXR)等其他核受体结合形成异二聚体,发挥关键作用[9-10]。研究发现,RXR既可以与其他核受体形成异源二聚体启动转录,也可以以同源二聚体形式启动转录[11]。通过不同的结合体在细胞质和核中定位不同,从而在调控细胞增殖、分化和凋亡中发挥重要作用[12]。目前,已知RAR受体家族是由全反式视黄酸(all-trans retinoic acid, at-RA)和9-顺式视黄酸(9-cis-RA)激活的,而RXR受体家族仅由9-cis-RA激活,表明9-cis-RA对RAR/RXR的形成是必需的[13]。
RXRB作为视黄酸的一个编码基因,可以介导视黄酸的生理活性。Kastner等[14]研究发现,在RXRB基因突变和缺乏RXRB的小鼠中约有50%在出生前或出生时死亡,而幸存的雄性小鼠因其精子发生异常而不育。另外,RXRB无效突变导致Sertoli细胞脂质代谢异常和精子发生异常[15]。Mascrez等[16]进一步研究发现,Sertoli细胞中的胆固醇稳态取决于TIF2共激活因子和RXRB/LXRB异二聚体。另有研究报道,在Sertoli细胞中RXRB基因的体细胞靶向性失活可导致精子释放失败,胆固醇蓄积并随后使睾丸变性[17]。在表达模式上,有研究发现,RXRB基因mRNA在不同日龄大白猪的心、肾、脾、大肠、子宫、卵巢中持续表达,其中在大肠、子宫和卵巢中持续高表达[18]。黄锐等[19]以长白山野猪和东北民猪为材料,检测了RXRB基因在不同骨骼肌组织中mRNA表达量,结果发现,该基因在两个品种猪肌肉组织中的表达量普遍高于非肌肉组织,表明RXRB可能是影响猪肉品质的候选基因之一。Pena等[20]利用高密度SNP阵列对382头伊比利亚猪进行GWAS分析,筛选到了与肌内脂肪中饱和脂肪酸和不饱和脂肪酸含量密切相关的候选基因RXRB。以上这些研究都表明了RXRB基因可能与动物的生长繁殖性能相关。本研究将RXRB基因,作为候选基因研究其多态性与猪重要经济性状的相关性,以期筛选到与猪生长、繁殖性状显著相关的SNPs,为今后种猪遗传改良提供新的遗传标记位点。
1 材料与方法
1.1 试验猪群及性状测定
本研究样本采集及数据收集于浙江省某企业。选取来自不同血缘世代且生长健康的后备大白猪作为研究对象,将猪群按品系分为美系大白猪和法系大白猪,其中美系大白猪共459头(公猪85头,母猪374头),法系大白猪共503头(公猪18头,母猪485头),上述试验猪群的饲养环境和管理方式一致。通过对试验猪群进行前腔静脉采血,并利用血液基因组DNA中量提取试剂盒(离心柱型)提取基因组DNA,将样品DNA保存于-80 ℃超低温冰箱中备用。测定的表型性状主要包括:达100 kg体重日龄(d)、活体背膘厚(mm)、初生重(kg)、体长(cm)、眼肌面积(cm2)、左乳头数和右乳头数。其中,当猪的体重达到(100±5) kg时,利用B型超声设备(ESAOTE,Mylob Touch VET)测定猪活体背膘厚和眼肌面积,活体背膘厚和眼肌面积测定位置在猪倒数第3、4根肋骨距离背中线4~5 cm处。所有测量数据由育种软件GBS 5.0校正后得到。
1.2 引物设计及PCR扩增
根据NCBI中GenBank上提供的猪RXRB基因序列(登录号为NC_010449.5),应用Primer Premier 5.0软件进行引物设计,并由上海生工生物工程技术有限公司合成。所用引物及目的片段长度如表1所示。PCR扩增反应总体积为20.0 μL:DNA模板1.0 μL,2×Taq PCR Mix 10.0 μL,ddH2O 8.0 μL,正、反向引物(10 μmol·L-1)各0.5 μL。 PCR反应程序:95 ℃预变性5 min;95 ℃变性40 s,退火 30 s(退火温度见表1),72 ℃延伸,共36个循环;最后72 ℃延伸5 min。PCR产物于1.5%琼脂糖凝胶电泳检测,以5 μL的DNA Marker DL2000作为参照。电泳结束后利用凝胶成像系统观察扩增结果。
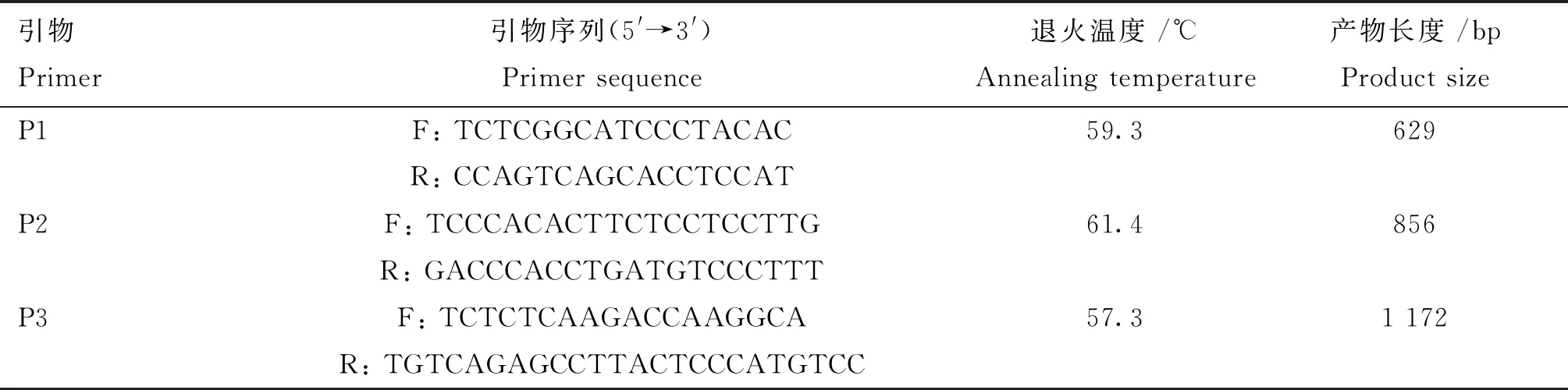
表1 RXRB引物序列
1.3 PCR产物酶切反应体系及条件
在本研究中检测到的10个SNPs中,仅多态性位点rs326226767存在合适的酶切位点,可利用PCR-BglⅠ-RFLP方法对该位点进行基因分型。其余9个SNPs则利用直接测序法进行基因分型。测序结果用Chromas软件查看。酶切反应体系及条件:PCR产物酶切反应体积为20.0 μL,其中10×FastDigest Green Buffer 2.0 μL,限制性内切酶0.5 μL(5 U), ddH2O 7.5 μL,PCR 产物10.0 μL,将样品混匀后离心,37 ℃酶切1 h。酶切产物于1.5%琼脂糖凝胶电泳检测,以5 μL的DNA Marker DL2000作为参照。电泳结束后利用凝胶成像系统观察基因型。
1.4 数据处理与统计分析
1.4.2RXRB基因各SNPs位点的连锁不平衡分析 本研究利用Haploview 4.2软件分析RXRB基因SNPs位点之间的连锁不平衡水平并计算出各单倍型频率。
1.4.3 分子标记的基因效应分析 本研究利用SAS 8.0软件中的混合线性模型(Mixed)进行多态性位点不同基因型和单倍型组合与猪生长繁殖性状表型值之间的关联分析,结果以“平均值±标准误”表示,P<0.05判定为差异显著,P<0.01判定为差异极显著。应用Excel软件分别计算基因型频率和等位基因频率,并进行χ2检验,分析其是否偏离Hardy-Weinberg平衡状态。分析模型:Tijkl=μ+Gi+Fj+Sk+Bl+eijklm。式中,Tijkl为性状表型值;μ为平均值;Gi为基因型效应;Fj、Sk、Bl为固定效应,分别为家系、性别、批次效应,eijklm为残差效应。
2 结 果
2.1 PCR扩增与酶切产物的电泳检测
将引物P1、P2和P3分别在美系大白猪和法系大白猪DNA混合池中进行PCR扩增,并将PCR产物送至上海生工生物工程技术有限公司进行测序。结果发现,在美系大白猪中,引物P1扩增产物检测到4个SNPs,分别为第一外显子区域的rs340542491、rs324141460和第一内含子区域的rs330162688、rs325538588;引物P2扩增产物中检测到1个SNP(rs326226767),位于第七外显子区域,且该位点由碱基G突变成碱基A,进而导致限制性内切酶BglⅠ酶切位点的改变,可采用PCR-BglⅠ-RFLP方法来进行基因型分型,酶切电泳结果见图1。在法系大白猪中,引物P3扩增产物检测到5个SNPs,分别为第八内含子区域的rs691889709、rs336609453,第九外显子区域的rs80789331,第九内含子区域的rs332169586,第十外显子区域的rs323107853。上述10个SNPs的测序峰图如图2所示。
2.2 大白猪RXRB基因10个SNPs的遗传多态性分析
利用直接测序法分别检测了459头美系大白猪中引物P1扩增区域内的4个SNPs和503头法系大白猪中引物P3扩增区域内的5个SNPs,同时利用PCR-BglⅠ-RFLP技术对418头美系大白猪中引物P2扩增区域内的1个SNP(rs326226767)进行了基因分型。上述10个SNPs均检测到3种基因型,基因型与等位基因频率分布见表2。X2适合性检验结果表明,上述10个SNPs在大白猪群体中均处于Hardy-Weinberg平衡状态(P>0.05)。
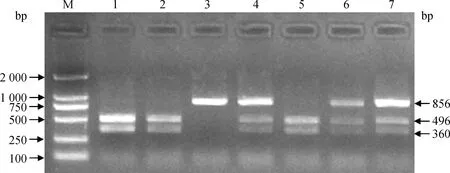
M. DNA相对分子质量标准;1、2、5. GG基因型;3. AA基因型;4、6、7. GA基因型 M. DL2000 marker; 1, 2, 5. GG genotype; 3. AA genotype; 4, 6,7. GA genotype图1 RXRB基因引物P2扩增片段的PCR-Bgl Ⅰ-RFLP酶切分型结果Fig.1 The PCR-Bgl Ⅰ-RFLP results of amplified fragments by primer P2 in RXRB gene

图2 RXRB基因SNPs测序结果Fig.2 SNPs sequencing results in RXRB gene
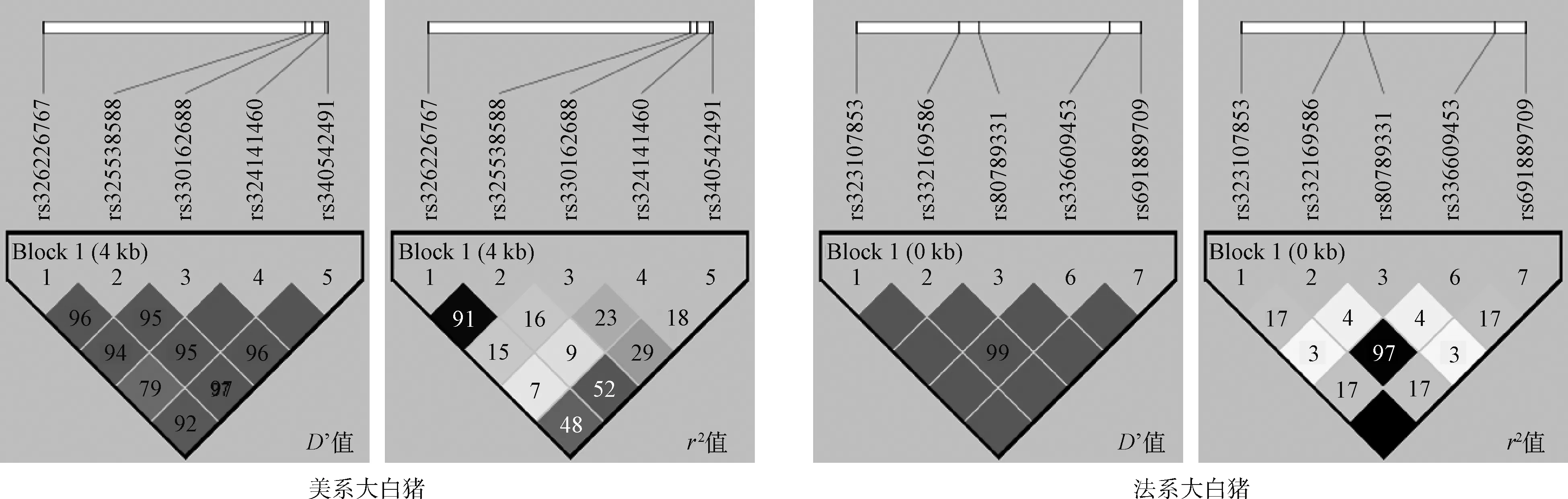
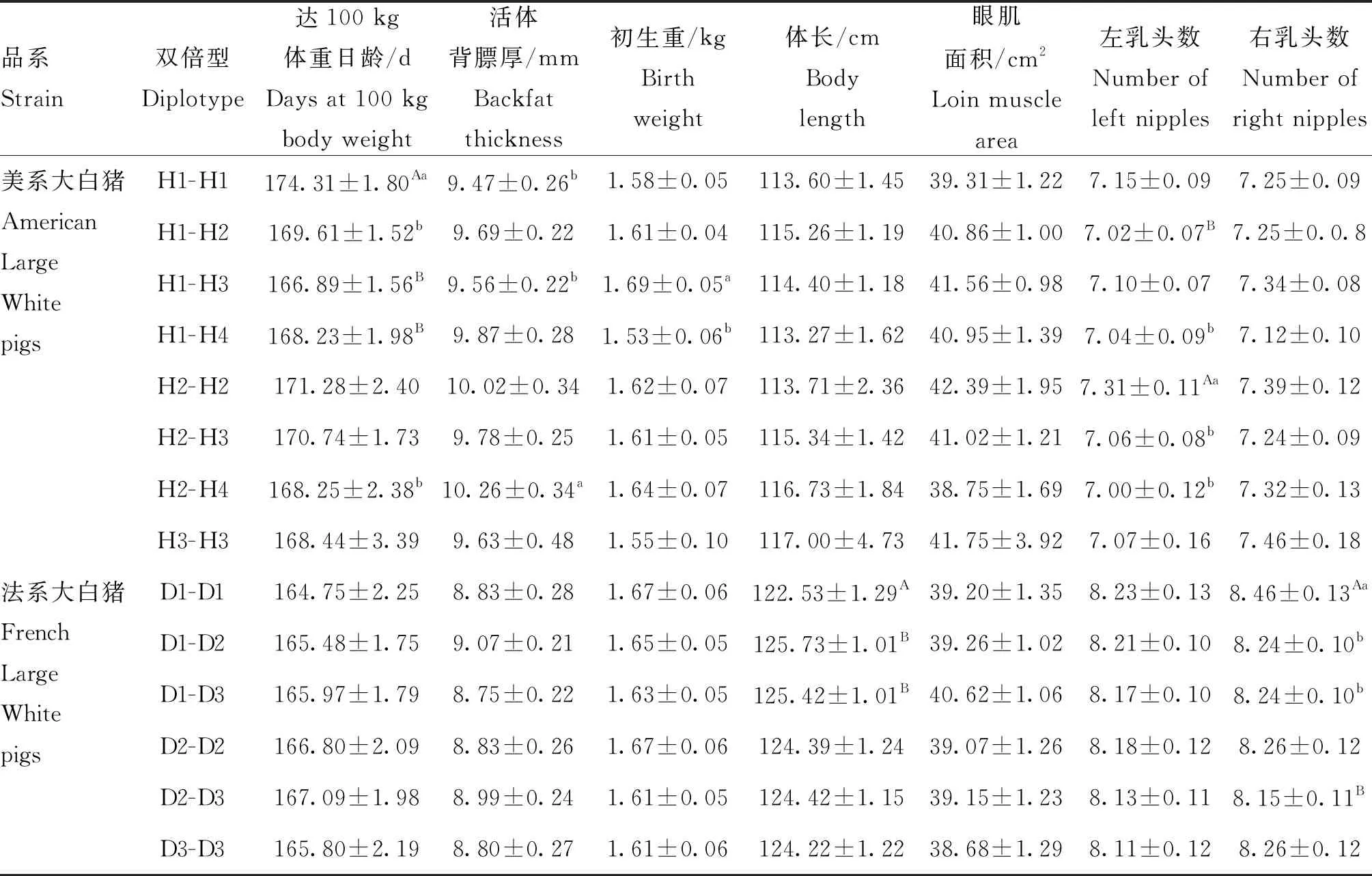
从群体遗传学角度分析大白猪RXRB基因SNPs的基因型和等位基因,由表2可知,除位点rs80789331的多态性含量(PIC)为0.133,属于低度多态(PIC<0.25),其余9个SNPs均属于中度多态(0.25 从大白猪RXRB基因多态性与经济性状的关联分析(表3)可以看出,在达100 kg体重日龄中,位点rs340542491、rs330162688和rs326226767均存在显著的关联性(P<0.05);在活体背膘厚中,位点rs340542491和rs330162688的GG基因型个体的背膘厚度均显著大于GA和AA基因型(P<0.05),GA和AA基因型个体间无显著差异(P>0.05),表明了等位基因G会降低瘦肉率,为不利等位基因,同时,位点rs336609453和rs332169586也存在显著的关联性(P<0.05);在初生重中,位点rs340542491和rs325538588存在显著的关联性(P<0.05),且GA基因型个体相比于其他基因型的初生重更大,在实际生产过程中初生重越大的仔猪通常具有更高的成活率,即GA基因型为有利基因型,同时,位点rs691889709和rs323107853也存在显著的关联性(P<0.05);在体长中,位点rs324141460的GA基因型个体显著大于GG基因型(P<0.05);在眼肌面积中,位点rs325538588的AA基因型个体显著大于GG和GA基因型(P<0.05),位点rs80789331的AA基因型个体显著大于CC和CA基因型(P<0.05);在乳头数中,位点rs340542491和rs330162688的AA基因型个体的左乳头数均极显著高于GA基因型(P<0.01),位点rs324141460的AA基因型个体的左、右乳头数均极显著高于GG和GA基因型(P<0.01),位点rs336609453的AA基因型个体的右乳头数显著高于AG基因型(P<0.05), 位点rs332169586的GG基因型个体的右乳头数显著高于GA基因型(P<0.05),通常情况下,母猪的乳头数越多,其繁殖性能越强。另外,通过对两个品系猪表型值数据的统计分析发现,法系大白猪的平均体长和平均乳头数均要高于美系大白猪,这可能是不同的选育方向造成了两个品系猪群的差异。 表2 RXRB基因10个 SNPs 位点的基因型及等位基因频率 利用Haploview 4.2软件分别对美系大白猪和法系大白猪RXRB基因内处于Hardy-Weinberg平衡状态的10个SNPs进行连锁不平衡及单倍型分析。如图3所示,在美系大白猪中的5个SNPs可组成一个单倍型模块,其中,rs326226767-rs325538588处于强连锁不平衡状态(D’=0.96,r2=0.91>0.33),rs330162688-rs324141460处于完全连锁状态(D’=1),rs324141460-rs340542491处于完全连锁状态(D’=1);在法系大白猪中的5个SNPs也可组成一个单倍型模块,其中,rs691889709-rs323107853处于完美连锁状态(D’=1,r2=1),这也解释了该2个 SNPs基因型频率和关联分析结果一致性问题。如表4和表5所示,美系大白猪和法系大白猪中的SNPs各能形成4种单倍型,分别将4种单倍型进行组合,剔除频率小于0.03的组合后,在美系大白猪中可产生8种双倍型,法系大白猪中可产生6种双倍型,并分别进行下一步的关联分析。 由表6可知,美系大白猪RXRB基因产生的8种 双倍型在达100 kg体重日龄、活体背膘厚、初生重和左乳头数等性状上存在极显著(P<0.01)或显著差异(P<0.05),对于达100 kg体重日龄、活体背膘厚和初生重性状,在生产实践中H1-H3为有利双倍型;对于左乳头数性状,H2-H2为有利双倍型。而法系大白猪RXRB基因产生的6种双倍型在体长和右乳头数性状上存在极显著(P<0.01)或显著差异(P<0.05),其中D1-D1个体能极显著提高右乳头数(P<0.01),但极显著降低了体长(P<0.01), 因此需要根据实际情况进行选留。 根据D’值和r2判断位点之间是否存在连锁,其中D’=1称之为完全连锁,D’=0为无连锁或连锁平衡,r2=1称之为完全连锁,r2>0.33 提示为强连锁,r2=0为无连锁或连锁平衡 The linkage among SNPs was evaluated by the value of D’ and r2, where D’ = 1 indicated full linkage, D’ = 0 indicated no linkage or linkage equilibrium, r2 = 1 indicated full linkage, r2>0.33 indicated strong linkage, r2=0 indicated no linkage or linkage equilibrium图3 RXRB基因10个SNPs位点连锁不平衡分析Fig.3 The linkage disequilibrium analysis among 10 SNPs of RXRB gene 表4 RXRB基因单倍型及其频率 表5 RXRB基因单倍型组合及其频率 在自然选择下,人工选择干预、遗传漂变等因素都会导致动物的一些核苷酸发生改变,从而使生物的遗传性状变得更加丰富多样[21]。群体遗传变异度的大小代表着群体遗传丰富度的高低,一般来说,群体遗传变异度越高,则群体遗传丰富度也越高,多态信息含量(PIC)常用来指示这一指标[22]。本研究中,除rs80789331外,其余9个SNPs均属于中度多态(0.25 相关研究表明,RXRB基因作为核转录调节因子超家族一员,在生物体的胚胎发育、器官形成、细胞分化、细胞凋亡和维持生殖功能等方面具有重要作用[26]。李华振等[27]总结前人研究结果得出,RXRs参与组成的二聚体对动物繁殖发挥着多种重要的调控作用,但目前RXRs组成的二聚体在发情周期和季节性发情中具体的分子机制不够明晰。在支持细胞中,RXRB基因的表达能够维持胆固醇的稳态与精子形成[28]。成年哺乳动物体内都存在白色脂肪(WAT)和棕色脂肪(BAT),WAT的主要作用是将体内多余能量以脂肪的形式储存起来,过多的WAT会形成肥胖,而BAT能够将脂肪转化为热量,加强新陈代谢,促进白色脂肪消耗[29]。有研究表明,在大鼠脂肪组织中,WAT和BAT表达RAR和RXR亚型有着不同的方式,并且在不同的哺乳动物中都有相似的表达差别[30-31]。本研究发现,在美系大白猪群体中检测到的RXRB多态性位点rs340542491和rs330162688均与活体背膘厚性状显著相关,且GA和AA基因型均为有利基因型;在法系大白猪群体检测到的RXRB多态性位点rs336609453和rs332169586均与活体背膘厚性状显著相关,且杂合子基因型均为不利基因型,以上4个 SNPs位点均可以作为降低大白猪活体背膘厚,提高瘦肉率的潜在分子标记。除此之外,我们发现在美系大白猪中RXRB基因rs325538588位点的AA基因型个体的眼肌面积显著大于GG和GA基因型个体,但AA基因型个体的初生重显著小于GA基因型个体,虽然AA基因型能显著增加眼肌面积,但是会降低初生重,可能会影响仔猪成活率,因此在生产实践中,需要根据实际情况进行选留。 有研究发现,PPAR-γ/RXR异二聚体在鼠胎盘发育中起着关键的调节作用[32]。RXR基因在哺乳动物下丘脑-垂体-卵巢轴中表达,能作为连接动物繁殖发育和生理发情过程的关键转录因子[33]。另有研究发现,RXR基因表达与绵羊的繁殖有关,可能参与绵羊季节性发情上游基因调控[34]。另有研究报道,产仔数与总乳头数呈正相关[35]。通过与繁殖性状的关联分析发现,在美系大白猪中RXRB基因多态性位点rs340542491、rs324141460和rs330162688与左乳头数性状均达到极显著相关,AA基因型均为有利基因型;在法系大白猪中RXRB基因多态性位点rs336609453和rs332169586与右乳头数性状均达到显著相关,以上5个SNPs 可作为提高母猪乳头数性状的候选位点,为母猪繁殖力提供新的分子标记和理论依据。 表6 RXRB基因单倍型组合与生长育肥和繁殖性状的关联分析 在以往的研究中,一般认为基因突变发生在内含子不会影响生物性状,发生在其他区域则可能影响生物性状,但随着研究者们的深入研究发现,真核生物中内含子参与基因剪切,内含子突变可能导致剪切准确性或效率发生变化,从而导致氨基酸编码改变,最终改变真核生物表型,如IGF2基因第三内含子3072位点的G/A突变可影响其与ZBED6转录因子的结合,进而改善巴马猪的肉产量[36]。即使内含子突变没有造成对应氨基酸的改变,但其可能会改变调控剪接的外显子基序,导致剪接位点失活;另外,有些内含子含有增强子序列,其可促进基因的专一性转录,从而对动物的表型产生影响[37]。本研究在两个品系猪群中共鉴定出5个位于RXRB内含子区域的SNPs(rs330162688、rs325538588、rs691889709、rs336609453和rs332169586),并且这5个SNPs分别与大白猪性状表型值有显著或极显著的关联。这5个SNPs是因果突变位点,还是仅与因果突变位点紧密连锁的分子标记,还需进行后续功能验证来阐明其遗传机理。 动物基因对表型的影响可能受到多个突变位点的共同作用[38]。研究发现,由于强关联SNPs直接可以互相随机替代,单个SNP分析作用较小,而单倍型可以提供比单个SNP更为丰富的信息量,单倍型分析对于单染色体上杂合SNP的定位、疾病基因的挖掘和疾病治疗新方法的寻找有重要作用[39]。构建单倍型前需要进行LD分析,连锁不平衡常用D’和r2度量,当D’=0,r2=0时说明处于完全连锁平衡状态,当D’=1,r2=1时说明处于完全连锁不平衡状态。先前有研究表明,等位基因效应在不同品系猪中存在差异,推测是由于不同品系猪的连锁区间和随机突变不同所引起的[40-41]。在本研究的美系大白猪和法系大白猪中,分别对符合Hardy-Weinberg平衡的10个SNPs进行了连锁不平衡分析发现,美系大白猪中单倍型组合关联分析结果与单个SNP关联分析结果一致,均与达100 kg体重日龄、活体背膘厚、初生重和乳头数性状达到显著相关;但法系大白猪中单倍型组合关联分析结果显示出不同双倍型个体间的体长具有极显著差异,这与单个SNP关联分析结果不一致,考虑到该研究的样本量,有些单倍型所占比例太小,产生的试验结果具有一定的误差,后期还需进一步扩大样本量来验证。 本研究检测到RXRB基因内的10个SNPs,对大白猪达100 kg体重日龄、活体背膘厚、初生重和乳头数等性状均具有显著的遗传效应,表明RXRB基因可以作为影响猪生长繁殖性状的候选基因,上述10个SNPs可以作为猪育种改良的分子标记,同时为深入研究该基因功能具有一定的参考意义。2.3 大白猪RXRB基因多态性与生长育肥和繁殖性状的关联分析

2.4 RXRB基因10个SNPs连锁不平衡及单倍型分析



3 讨 论
3.1 RXRB基因群体遗传特征分析
3.2 RXRB基因多态性与生长繁殖性状的关联分析
3.3 RXRB基因单倍型分析
4 结 论
