铜阳极泥分铜液综合回收稀贵金属
2021-03-30张福元张金池张广安赵卓
张福元,张金池,张广安,赵卓
(安徽工业大学冶金工程学院,安徽马鞍山243032)
稀贵金属Te、Au、Ag、Pt、Pd 具有诸多优异的理化性能,在冶金、化工、医疗、电子、能源、航空航天等领域具有广泛应用[1-4]。铜阳极泥作为阳极铜电解精炼的副产物,是回收Se、Te、Au、Ag、Pt、Pd等多种高价值稀贵金属的重要原料[5-7]。火法-湿法联合的半湿法工艺[8]是国内外较为成熟并广泛使用的处理工艺,江西铜业集团有限公司和大冶有色金属集团控股有限公司均采用该工艺。首先进行硫酸化焙烧蒸硒,蒸硒渣采用硫酸浸出脱铜,酸浸脱铜过程中部分Se、Te 进入分铜液,贵金属Au、Ag、Pt、Pd也存在不同程度的分散[9]。分铜液成为易被忽视的中间产品,高效回收其中的稀贵金属具有重要意义。
目前,从酸性溶液中回收Te、Au、Pt、Pd 的方法主要有碱中和法、置换法、亚硫酸还原法和离子交换法等工艺。碱中和法[10]过程简单,能有效回收分铜液中的碲,但中和渣中碲品位较低、含杂高;铜置换法[11]常用于回收分铜液中的碲,铜粉成本较高、消耗量大,缩核反应产物Cu2Te 易“包裹”铜芯、降低铜粉的使用效率,关键是后续铜、碲分离复杂;锌粉置换法[12]是工业上常用于还原溶液中贵金属的方法,但对碲还原效果差,贵金属还原不彻底、精矿品位偏低;郑雅杰等[13]采用SO2从硫酸铜母液中回收碲,Na2SO3[14]和Na2S2O5[15]回收沉金后液中的稀贵金属,此类方法实质均为H2SO3还原,稀贵金属还原率接近100%,但SO2易外逸污染环境;离子交换法选择性好,但主要针对盐酸、硫代硫酸盐和氰化物体系[16-18],对硫酸体系研究较少。
上述部分方法对碲具有一定回收效果,但难以适用于高硫酸体系的分铜液中贵金属的回收。碲是一种对贵金属选择性强的良好捕集剂[19],碲共沉淀法因具有贵金属分离效果好、回收率高等优点广泛应用于微量或痕量贵金属的分离富集[20-22]。因此,本文采用Fe2+原位还原分铜液中稀贵金属Te、Au、Pt 和Pd,同时利用新生态胶体状Te 对贵金属Au、Pt和Pd的捕集作用达到高效回收稀贵金属的目的。该工艺简单、环境友好、成本较低,可实现分铜液中稀贵金属的高效综合回收,对硫酸体系中稀贵金属的回收有一定参考意义。
1 实验
1.1 实验原料
分铜液来自某铜冶炼厂的稀贵车间,为深蓝色澄清溶液,pH为0.6,其主要成分如表1所示。
由表1 可知,分铜液中主要元素Cu 的含量为64.88g/L,As 的含量为1.12g/L,其中,As(Ⅲ)占63.39%,As(Ⅴ)占36.61%,As 主要以低价态形式存在;稀贵金属Te、Au、Ag、Pt和Pd的含量分别为 1.01g/L、 0.37mg/L、 0.17g/L、 1.24mg/L 和2.12mg/L,具有一定的回收价值。
1.2 实验过程
量取一定体积分铜液于烧杯中,将烧杯置于水浴锅中加热至目标温度,在搅拌条件下按照实验所需缓慢加入还原剂FeSO4·7H2O,保温反应至预定时间后,真空抽滤进行固液分离,滤饼用蒸馏水洗至中性后烘干并制样,滤液定容。
1.3 分析方法
采用美国Agilent 720ES型电感耦合等离子体发射光谱仪(ICP) 分析溶液成分,射频功率1.20kW,等离子体流量15.0L/min,辅助流量1.50L/min,喷雾器流量0.75L/min;采用美国赛默飞世尔ARL ADVANT’X Intellipower™3600 型扫描X射线荧光光谱仪(XRF)对沉淀渣进行定性半定量成分分析;采用德国Bruker D8ADVANCE型X射线衍射仪(XRD)分析沉淀渣的物相组成,靶材为Cu 靶,功率为3kW,加速电压40kV,电流强度为40mA,扫描速度为4°/min,测角仪精度为0.0001°,2θ 准 确 度≤0.02°;采 用 日 本JEOL 的JSM-7900F热场发射扫描电子显微镜(SEM)观察产物微观形貌和分析元素组成,加速电压20kV,放大倍数999×,工作距离为9.9mm;Au、Ag、Pt 和Pd 参照GB/T 7739.1—2019 采用火试金-ICP 分析检测;采用碘量法测定Cu 含量;采用溴酸钾滴定法测定As含量;采用重铬酸钾返滴定法测定Te含量。

表1 分铜液的主要成分分析结果
2 热力学分析
2.1 分铜液中贵金属的溶解
铜阳极泥与浓H2SO4混合进行硫酸化焙烧,铜和大部分银转化为可溶性的硫酸盐,硒以SeO2形式逸出,碲被氧化为TeO2留在渣中。在硫酸浸铜过程中,大部分银和少量碲进入分铜液,为避免银的分散,加入NaCl 使分铜液中的Ag+以AgCl 沉淀形式进入酸浸渣[9],过量的Cl-导致部分AgCl 形成可溶性络合物重新进入分铜液,主要化学反应如式(1)~式(3)所示。
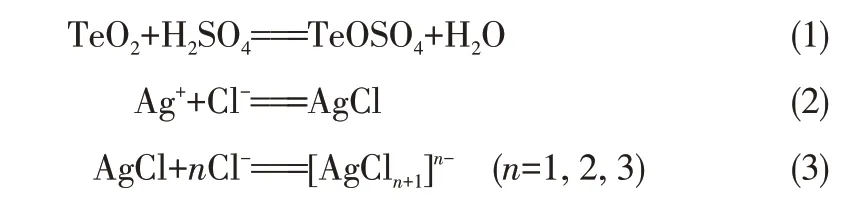
此外,向铜电解液中添加30~50mg/L HCl 用于沉淀高硫酸浓度下溶解的微量Ag+,导致铜阳极泥中夹带少量Cl-,在较高的酸度和氧气存在条件下,Au、Pt 和Pd 与Cl-发生络合,微量溶解到分铜液中,可能的化学反应如式(4)~式(6)所示。
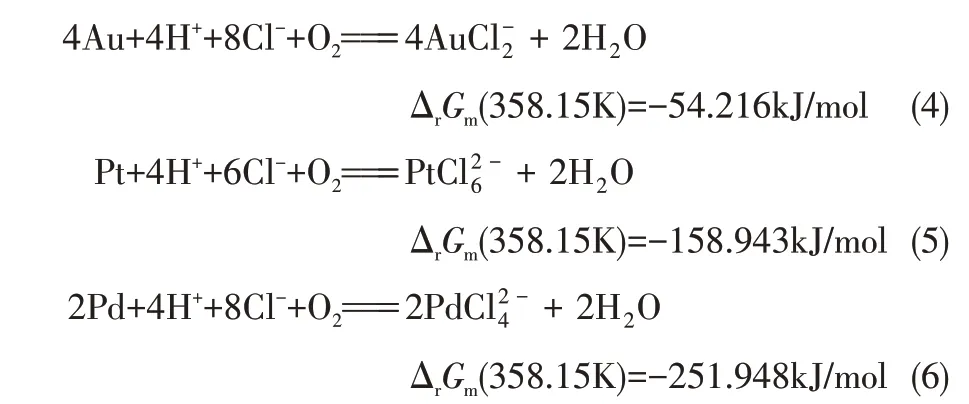
由式(4)~式(6)可知,Au、Pt、Pd氧化溶解反应的ΔrGm(358.15K)均远小于0,反应能够自发向右进行。根据反应的ΔrGm负值越大,反应的自发性越大,Pd 溶解反应的ΔrGm最负,为-251.948kJ/mol,最易被氧化溶解,其次为Pt(-158.943kJ/mol),最后是Au(-54.216kJ/mol),这与金属活动性顺序一致。
2.2 分铜液的电位调控
亚铁的电极反应及标准电极电位如式(7)所示。
根据Nernst 方程可知,硫酸体系中Fe2+的实际电极电位如式(8)所示。


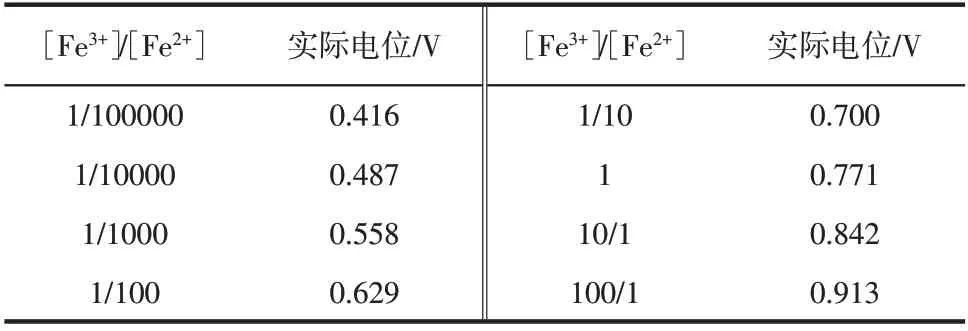
表2 Fe2+实际电位与[Fe3+]/[Fe2+]的关系(358.15K)
根据相关热力学参数[23-24]计算并绘制358.15K条件下As-Fe-H2O系φ-pH图,如图1所示。

图1 As-Fe-H2O系φ-pH图
由图1 可知,在强酸性、较高电位环境中,Fe3+和H3AsO4能够稳定存在;当溶液pH 在0.3~5.2时,Fe3+与H3AsO4结合生成稳定的FeAsO4,且在该范围内随溶液酸度的降低,FeAsO4的稳定区域逐渐扩大;当溶液pH>5.2时,Fe3+形成Fe(OH)3而不是FeAsO4。分铜液的pH 为0.6,As 主要以H3AsO4和H3AsO3的形态存在[25],因此能够发生Fe3+和H3AsO4形成FeAsO4的反应。当分铜液中引入Fe2+后[Fe2+]增加,在高温条件下Fe2+可通过溶解氧氧化或还原金属离子得到Fe3+,由于溶液中As(Ⅴ)(5.5×10-3mol/L)的存在,新生的Fe3+与H3AsO4结合生成稳定的FeAsO4,而FeAsO4因溶解度较低(Ksp=10-21.17~10-25.83)从溶液中沉淀,使溶液中[Fe3+]大大降低,[Fe3+]/[Fe2+]将大幅减小,Fe2+的实际电位大幅降低,从而达到还原稀贵金属的效果。
2.3 稀贵金属还原及碲捕集机理
在358.15K时,实验涉及电极反应的标准电极电位[24]如表3所示。
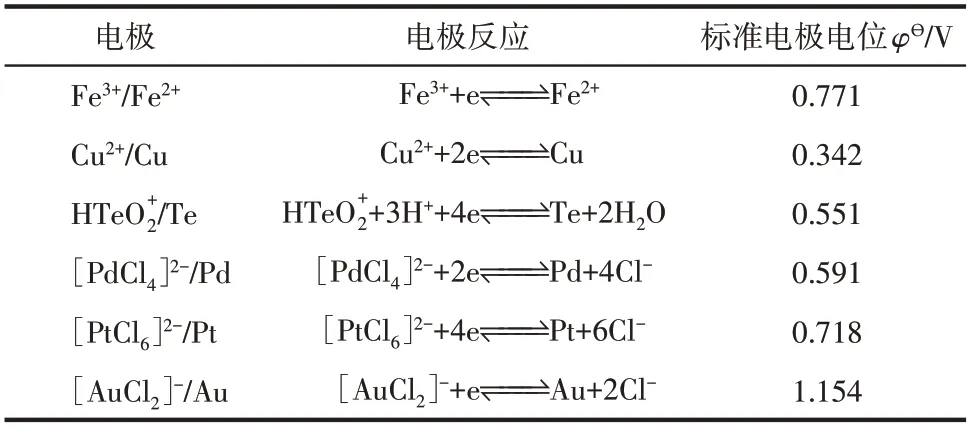
表3 分铜液中部分元素的标准电极电位
由表3可知,分铜液中金的还原电位最高,为1.154V,在溶液中氧化性最强,反应过程中优先被还原,铂的还原电位仅次于金,为0.718V,应在金之后被还原,同理,铂之后依次是钯(0.591V)、碲(0.551V)。根据分铜液中各离子的电极电位可知,离子的还原顺序为AuC、PtCl、PdCl、HTe,相关氧化还原反应如式(9)~式(12)所示。
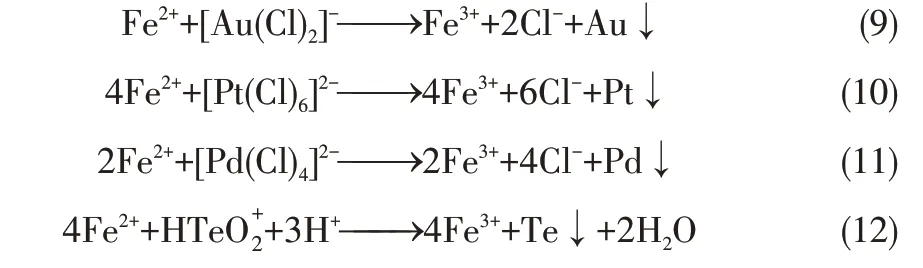
分铜液中贵金属Au、Pt 和Pd 的含量较低,仅通过还原剂Fe2+的还原作用难以实现贵金属的有效分离富集。但分铜液中存在一定浓度Te,利用Te对贵金属Au、Pt和Pd的捕集作用可实现分铜液中贵金属Au、Pt和Pd的高效分离富集。从地球化学角度来看,氧族元素Te的性质与S类似,但Te较S具有更多的核外电子层,原子半径更大,最外层电子所受的束缚力更小,更易作电子供体,为软碱。根据“软硬酸碱理论”,软碱Te 易与Au+、Pt2+、Pt4+、Pd2+等软酸结合。此外,Te 在酸性溶液中可形成Te、Te、Te等多聚离子,部分离子与贵金属离子如PdCl具有相同的空间结构,具有热稳定性差、变形能力强、空间位阻较小、反应活性较强的性质[19],有利于和贵金属结合形成碲化物。
3 结果与讨论
3.1 Fe2+浓度对多金属沉淀率的影响
量取分铜液250mL,在反应温度为85℃和搅拌速度为300r/min 的条件下反应2h,Fe2+浓度对Te、As、Au、Pt和Pd沉淀率的影响结果如图2所示。
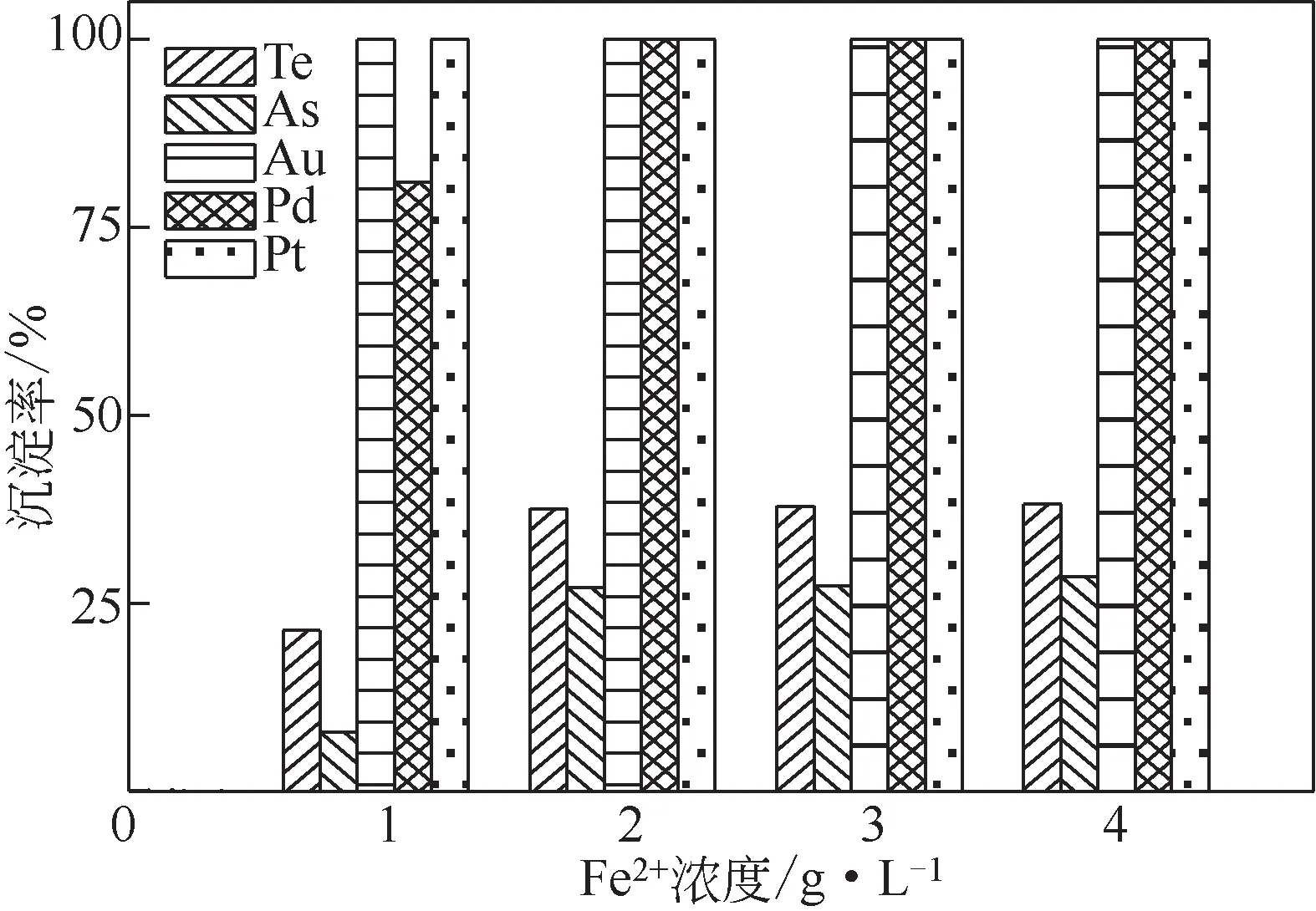
图2 Fe2+浓度对多金属沉淀率的影响
从图2可知,Fe2+浓度增加有利于Au、Pt、Pd、Te 和As 的沉淀。当溶液Fe2+浓度为1g/L 时,贵金属Au、Pt 的沉淀率均接近100%,Pd、Te 和As 的沉淀率分别为81.03%、21.39%和7.88%;当Fe2+浓度达到2g/L 时,贵金属Au、Pt、Pd 的沉淀率全都接近100%,Te和As的沉淀率分别提升至37.54%和27.11%。这是由于Fe2+浓度的增加使[Fe3+]/[Fe2+]减小,降低了Fe2+的还原电位,有利于溶液中Au、Pt、Pd 和Te 的还原。随着Fe2+浓度超过2g/L,Au、Pt、Pd、Te 和As 的沉淀率基本不变,其中贵金属Au、Pt 和Pd 的沉淀率全都接近100%,由2.3 节的分析得,Au、Pt、Pd 优先于被Te 还原,Te 沉淀率越高越有利于贵金属的捕集。因此采用Fe2+浓度为2g/L,后续条件优化实验仅考察碲的还原沉淀效果。
3.2 反应温度对Te、As沉淀率的影响
量取分铜液250mL,在Fe2+浓度为2g/L 和搅拌速度为300r/min 的条件下反应2h,反应温度对Te、As沉淀率的影响结果如图3所示。
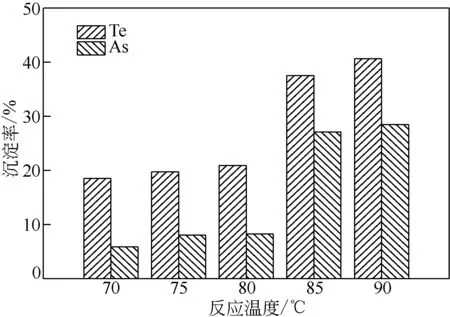
图3 反应温度对Te、As沉淀率的影响
由图3 可知,Te 和As 的沉淀率随反应温度的升高而增加。温度由70℃升至80℃时,Te 的沉淀率仅由18.56%缓慢增加至20.93%,As的沉淀率由5.87%缓慢增加至8.25%;当温度由80℃变化至85℃时,Te 的沉淀率迅速增加至37.54%,As 的沉淀率迅速增加至27.11%。这是由于温度升高使分子运动速率增大,活化分子占比增加,从而增加了有效碰撞的概率,有利于反应的进行。此外,高温条件更有利于As(Ⅲ)和Fe2+被溶解氧氧化为As(Ⅴ)和Fe3+,它们的结合可生成更多FeAsO4沉淀,从而使As 的沉淀率增加。温度继续升高至90℃,Te 和As 的沉淀率无明显增加。因此,后续实验在85℃条件下进行。
3.3 反应时间对Te、As沉淀率的影响
量取分铜液250mL,在Fe2+浓度为2g/L、反应温度为85℃和搅拌速度为300r/min的条件下,反应时间对Te、As沉淀率的影响结果如图4所示。
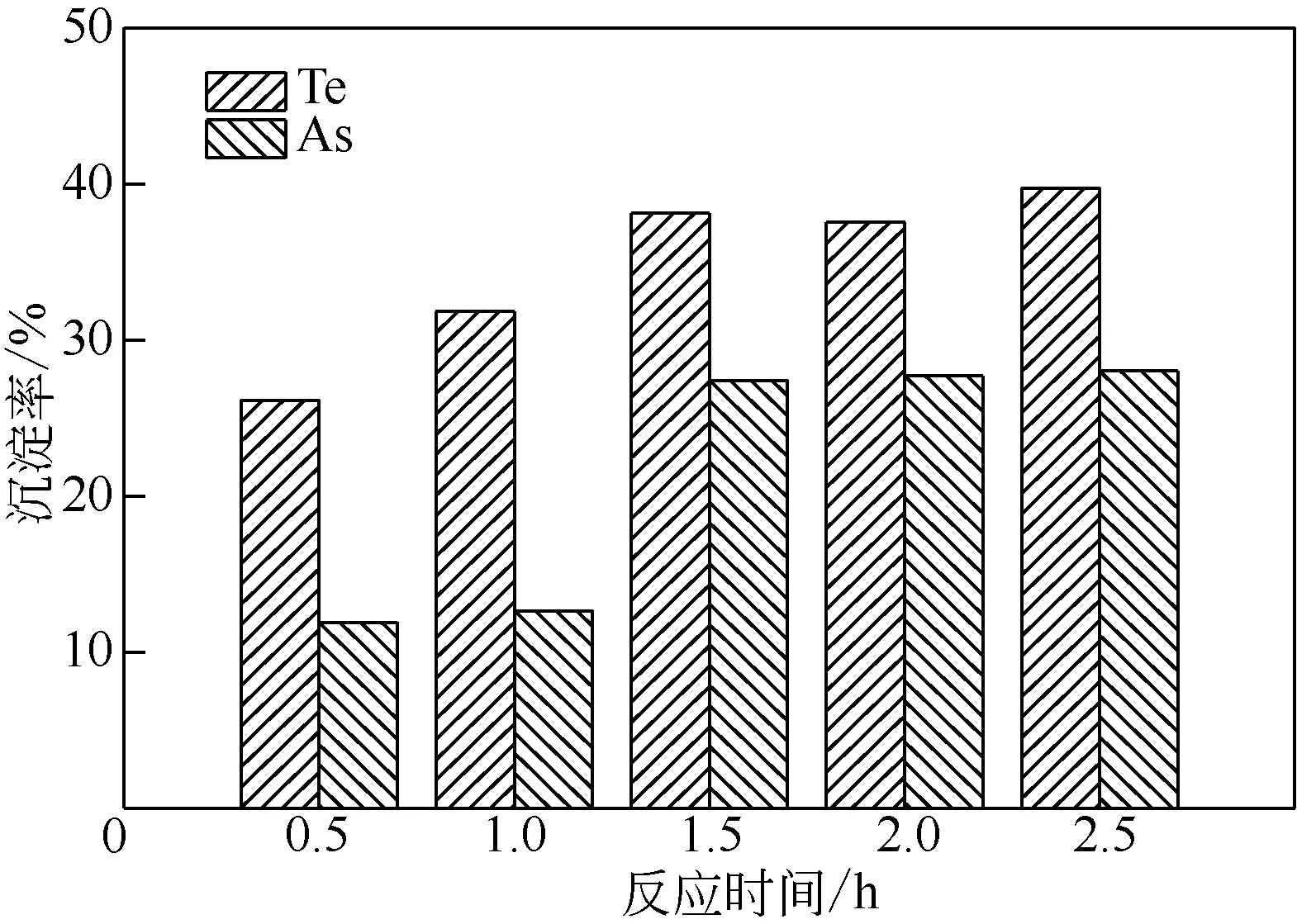
图4 反应时间对Te、As沉淀率的影响
由图4可知,Te、As的沉淀率随反应时间的延长而增加。反应至0.5h 时,Te、As 的沉淀率分别为26.14%、11.9%;延长反应时间至1h,Te 的沉淀率由26.14%增加至31.82%,而As的沉淀率仅由11.9%增加至12.65%;随反应时间延长至1.5h,Te的沉淀率增加至38.13%,As 的沉淀率显著增加,由12.65%升至27.41%;反应1.5h 之后,反应基本达到动态平衡。故选择1.5h为适宜反应时间。
3.4 搅拌速度对Te、As沉淀率的影响
量取分铜液250mL,在Fe2+浓度为2g/L 和反应温度为85℃的条件下反应1.5h,搅拌速度对Te、As沉淀率的影响结果如图5所示。
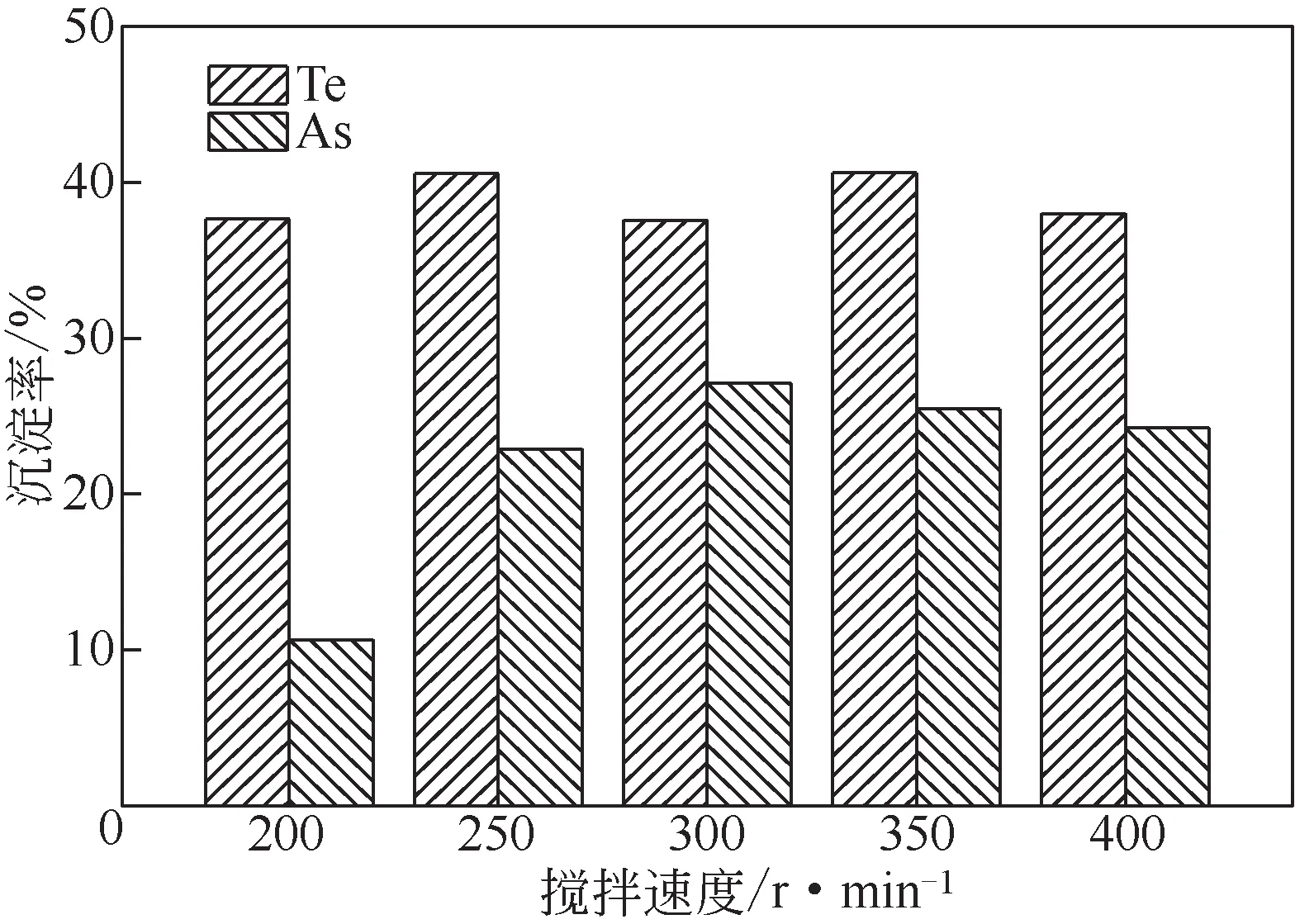
图5 搅拌速度对Te、As沉淀率的影响
由图5可知,随着搅拌速度的增大,Te沉淀率在38%~39%波动,As沉淀率随着搅拌速度的增大先增加后降低,当搅拌速度为300r/min 时,As 沉淀率达到最大值27.11%。搅拌速度的变化对Te 的沉淀基本没有影响,说明Te 的沉淀可能不受扩散控制,而较稳定的搅拌条件可能有利于FeAsO4的沉淀。综合考虑,搅拌速度选择300r/min较合适。
3.5 pH对Te、As沉淀率的影响
量取分铜液250mL,在Fe2+浓度为2g/L、反应温度为85℃和搅拌速度300r/min的条件下反应1.5h,溶液pH对Te、As沉淀率的影响结果如图6所示。
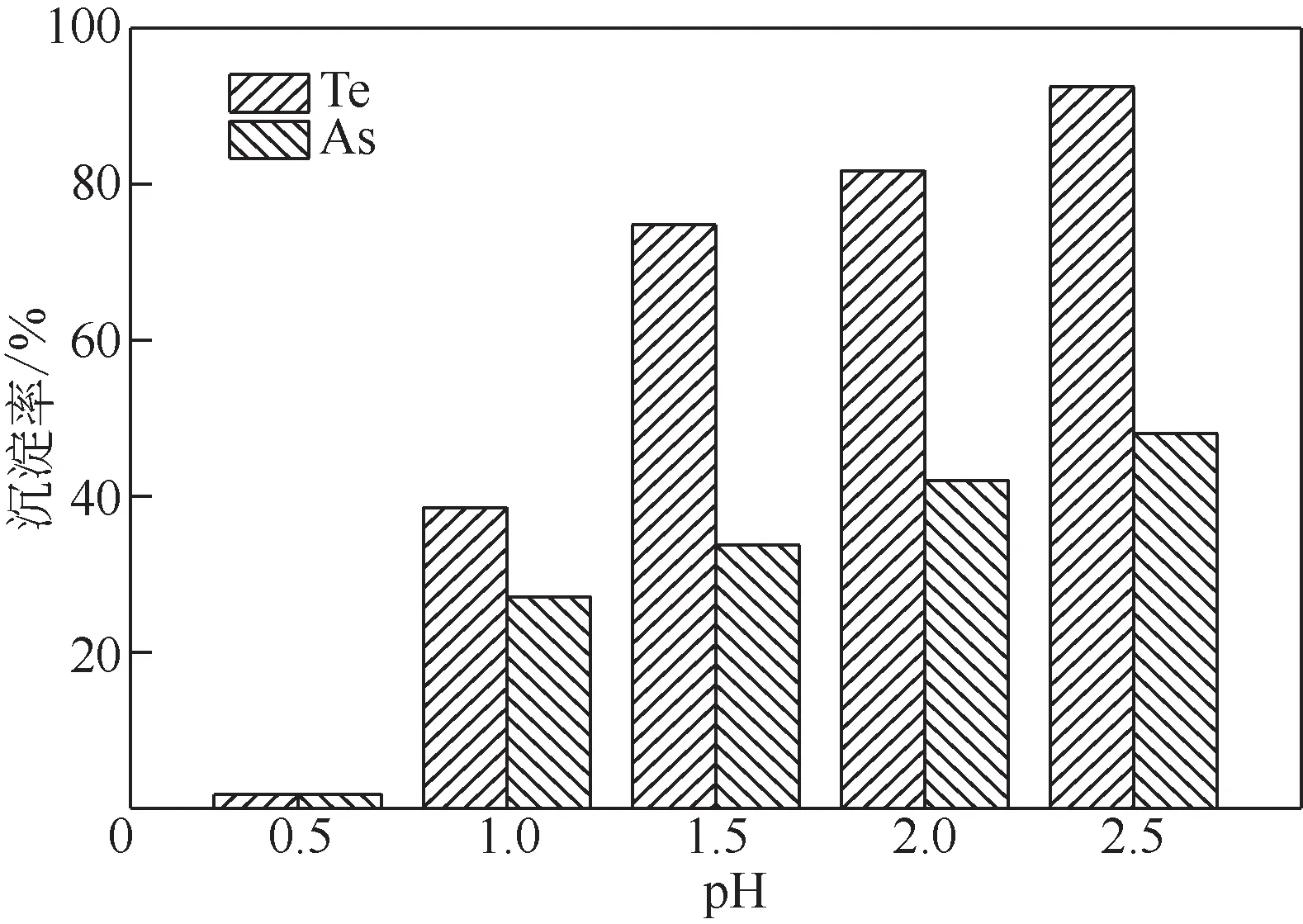
图6 pH对Te、As沉淀率的影响
由图6可知,溶液的pH增加有利于Te和As的沉淀,pH 由0.5 变化至2.5 的过程中,Te 的沉淀率由1.74%增加至92.44%,As的沉淀率由1.81%增加至48.04%。这可能是由于pH增加使Te以TeO2的形式从溶液中分离,从而导致Te的沉淀率大大增加。由图1知,pH增加导致FeAsO4的形成区间扩大,有利于FeAsO4的产生,从而使As的沉淀率增加。
综上可得,分铜液沉淀Te、As、Au、Pt、Pd的优化工艺条件为:反应温度85℃、搅拌速度300r/min、Fe2+浓度2g/L和反应时间1.5h。
3.6 优化条件放大实验
在上述优化工艺条件下,向25m3反应釜中泵入20m3分铜液进行三次工业放大实验,实验结果如表4所示。
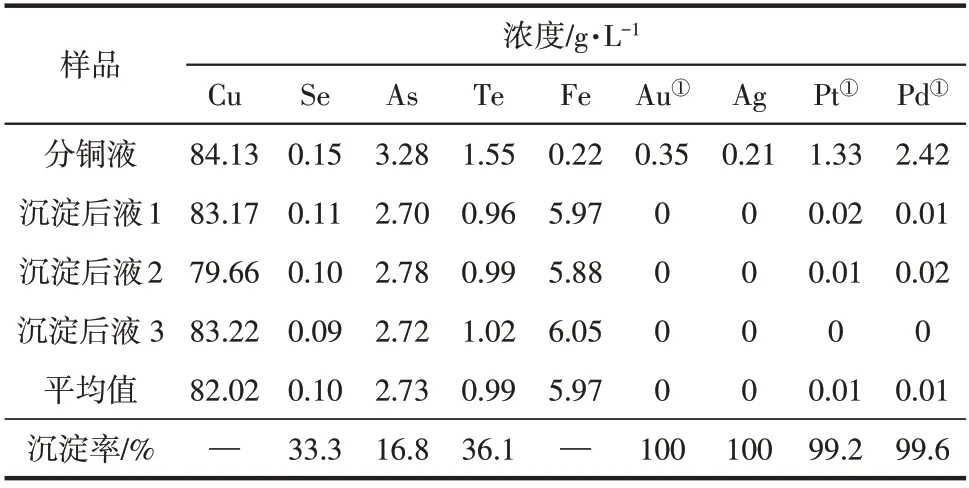
表4 优化条件实验结果
由表4 可知,优化实验中贵金属Au、Ag、Pt和Pd 的沉淀率分别达100%、100%、99.2% 和99.6%,稀散金属Se和Te的沉淀率分别为33.3%和36.1%,有害元素As 的沉淀率为16.8%,分铜液中的稀贵金属得到了较大程度的综合回收。
3.7 放大实验产物表征
沉淀渣的主要成分如表5所示,其XRD图谱和SEM图谱分别见图7和图8。

表5 沉淀渣的主要成分
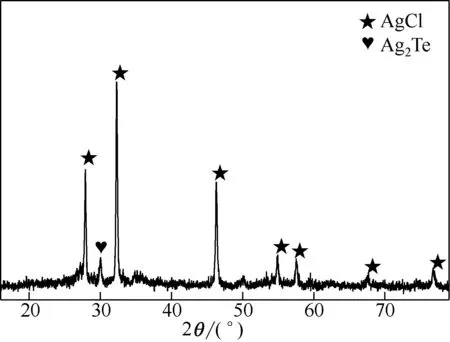
图7 沉淀渣的XRD图谱
由表5可知,沉淀渣中稀散元素Te、Se质量分数分别为18.24%、0.894%,有害元素As、贱金属Fe、轻金属Ti和重金属Bi质量分数分别为15.53%、8.74%、4.27%和8.22%,Cl 和S 质量分数分别为3.38%和0.538%,贵金属Au、Ag、Pt、Pd品位分别为124g/t、10.54%、1010g/t、320g/t,产物为高品位贵金属精矿。后续可通过碱性浸出选择性分离贵金属精矿中品位较高的Te、As,在回收有价金属Te 的同时富集贵金属Au、Ag、Pt、Pd,为贵金属的精炼提供便利条件。
从图7 中可以看出,沉淀渣中主要物相为AgCl,可能是FeAsO4吸附得到的,出现了Ag2Te的衍射峰,推测可能是新生态胶体Te 捕集得到的,其他成分如As、Fe、Bi、Se、Au、Pt 和Pd 等含量较低或为非晶态,未出现明显衍射峰。
图8(a)为沉淀渣的SEM 图像,(b)~(e)依次为Ag、Cl、As、Fe四种元素的面扫描图像。由图8(a)可以看出,渣主要以细小粉末状和块状颗粒的微观形态存在;由图8(b)和(c)可观察到,Ag 和Cl 两种元素具有明显一致的富集区域,几乎占据相同的分布区域,由于Ag和Cl是AgCl的组成元素,表明Ag主要以AgCl 的形式赋存于沉淀渣中,这与产物的XRD 结果一致;由图8(d)和(e)可以观察到,As 和Fe 在整个区域内较均匀分布,具有较一致的富集区域,而As和Fe是组成FeAsO4的元素,因此可判断主要以FeAsO4的形式赋存渣中。

图8 沉淀渣的SEM图像及Ag、Cl、As、Fe的面扫描图像
4 结论
(1)采用廉价的Fe2+为还原剂可实现铜阳极泥分铜液中稀贵金属Te、Au、Pt、Pd 的高效综合回收,在Fe2+浓度为2g/L、85℃和搅拌速度300r/min的优化条件下浸出1.5h,贵金属Au、Ag、Pt 和Pd 的沉淀率分别达100%、100%、99.2%和99.6%,Se、Te和As的沉淀率分别为33.3%、36.1%和16.8%。
(2)沉淀渣中As、Fe、Bi、Ti、Cl的质量分数分别为15.53%、8.74%、8.22%、4.27%和3.38%,稀 贵 金 属Te、Au、Ag、Pt、Pd 的 品 位 分 别 为18.24%、124g/t、10.54%、1010g/t、320g/t,说明产物为高品位贵金属精矿,其主要物相为AgCl,微观形态主要为细小粉末状和块状颗粒,SEM 面扫描图像说明Ag 和Cl、As 和Fe 分别主要以AgCl、FeAsO4形式赋存渣中。
