原发性干燥综合征合并间质性肺疾病的临床特点及影响因素分析
2021-03-30高鑫郑雅文赵志远苗裔刘莹
高鑫,郑雅文,赵志远,苗裔,刘莹
(郑州大学第一附属医院 呼吸与危重症内五科,河南 郑州 450052)
原发性干燥综合征(primary Sjögren syndrome,PSS)是以累及外分泌腺和腺外器官为主要特征的进行性自身免疫性疾病,肺部因富含脉管及结缔组织常常受累,且较无肺部受累患者病死率高[1]。PSS最常见的肺部表现为间质性肺疾病(interstitial lung disease,ILD)[2]。为此,本文回顾性分析郑州大学第一附属医院2016年1月至2019年12月收治的68例PSS-ILD患者和69例PSS患者的临床特点、实验室检查、影像学特点等资料,以期为早期诊断PSS-ILD提供更多依据。
1 对象与方法
1.1 研究对象将郑州大学第一附属医院2016年1月至2019年12月收治的68例PSS-ILD患者纳入PSS-ILD组,将同期住院的69例PSS患者纳入对照组。PSS和ILD分别满足美国风湿病协会分类(诊断)标准(2012年)[3]与美国胸外科协会/欧洲呼吸协会诊断标准(2013年)[4],排除合并其他自身免疫性疾病、肿瘤、严重肺部感染、肝炎、肝硬化、重度贫血及慢性心肾功能衰竭、既往接受过胸部放疗的患者。
1.2 数据收集及分析回顾性收集两组患者一般资料、临床症状、实验室检查结果、肺部高分辨率CT检查结果等资料。对患者的发病年龄、病程、临床特点、白细胞计数(white blood cell,WBC)、中性粒细胞计数(neutrophil,N)、红细胞沉降率(erythrocyte sedimentation rate,ESR)、C反应蛋白(C reactive protein,CRP)、降钙素原(procalcitonin,PCT)、血红蛋白(hemoglobin,Hb)、血小板(platelet,PLT)、自身抗体、肺部高分辨率CT检查结果等进行统计分析。

2 结果
2.1 一般资料PSS-ILD组患者年龄为27~80岁,PSS组患者年龄为27~73岁。PSS-ILD组患者发病年龄大于PSS组,且发病年龄≥65岁的患者占比更高,差异有统计学意义(P<0.05)。两组患者性别、病程差异无统计学意义(P>0.05)。见表1。

表1 两组患者一般资料比较
2.2 一般实验室检测结果PSS-ILD组患者WBC、N、补体C3、补体C4水平均高于PSS组,差异有统计学意义(P<0.05)。两组Hb、PLT、ESR、CRP、PCT以及免疫球蛋白G(immunoglobulin G,IgG)、免疫球蛋白A(immunoglobulin A,IgA)、免疫球蛋白M(immunoglobulin M,IgM)水平相比,差异无统计学意义(P>0.05)。见表2。
2.3 自身抗体检测结果PSS-ILD组患者抗SSA抗体和抗β2糖蛋白1抗体阳性率低于PSS组,差异有统计学意义(P<0.05),两组类风湿因子、抗核抗体、抗SSB抗体、抗ds-DNA抗体、抗Ro-52抗体、抗核糖体抗体、抗线粒体抗体M2亚型、抗Jo-1抗体、抗p-ANCA抗体、抗着丝点抗体、抗Scl-70抗体、抗Sm抗体水平相比,差异无统计学意义(P>0.05)。见表3。
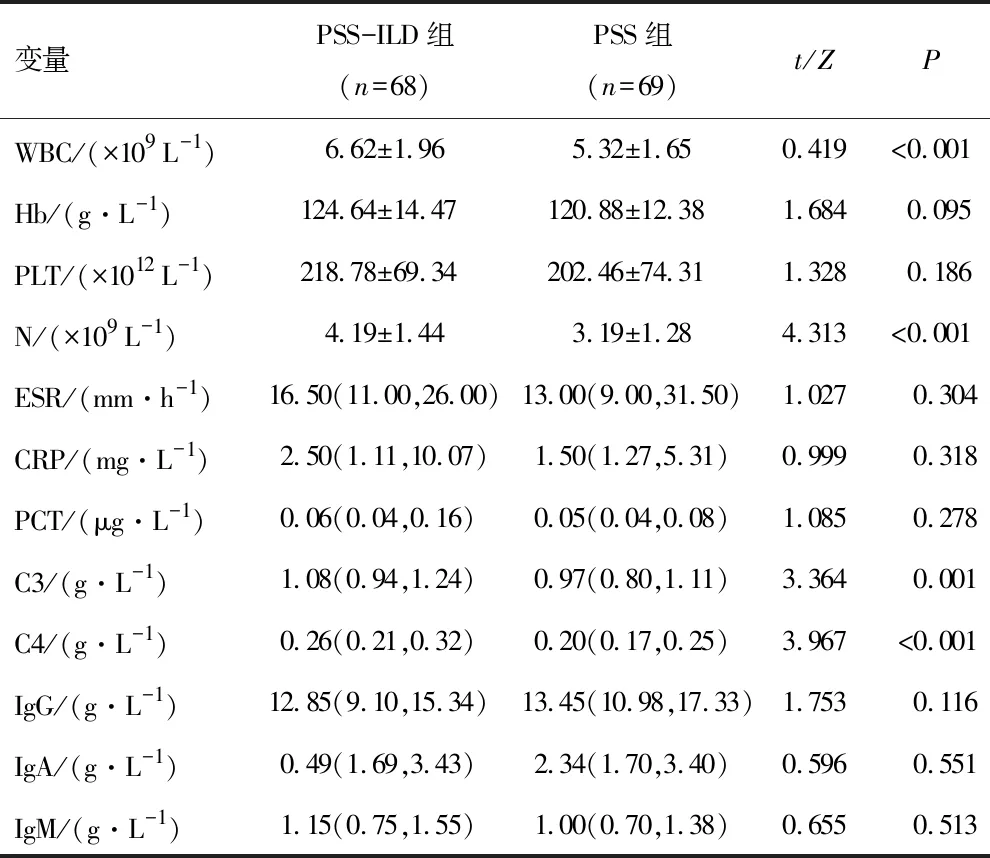
表2 两组患者一般实验室指标对比
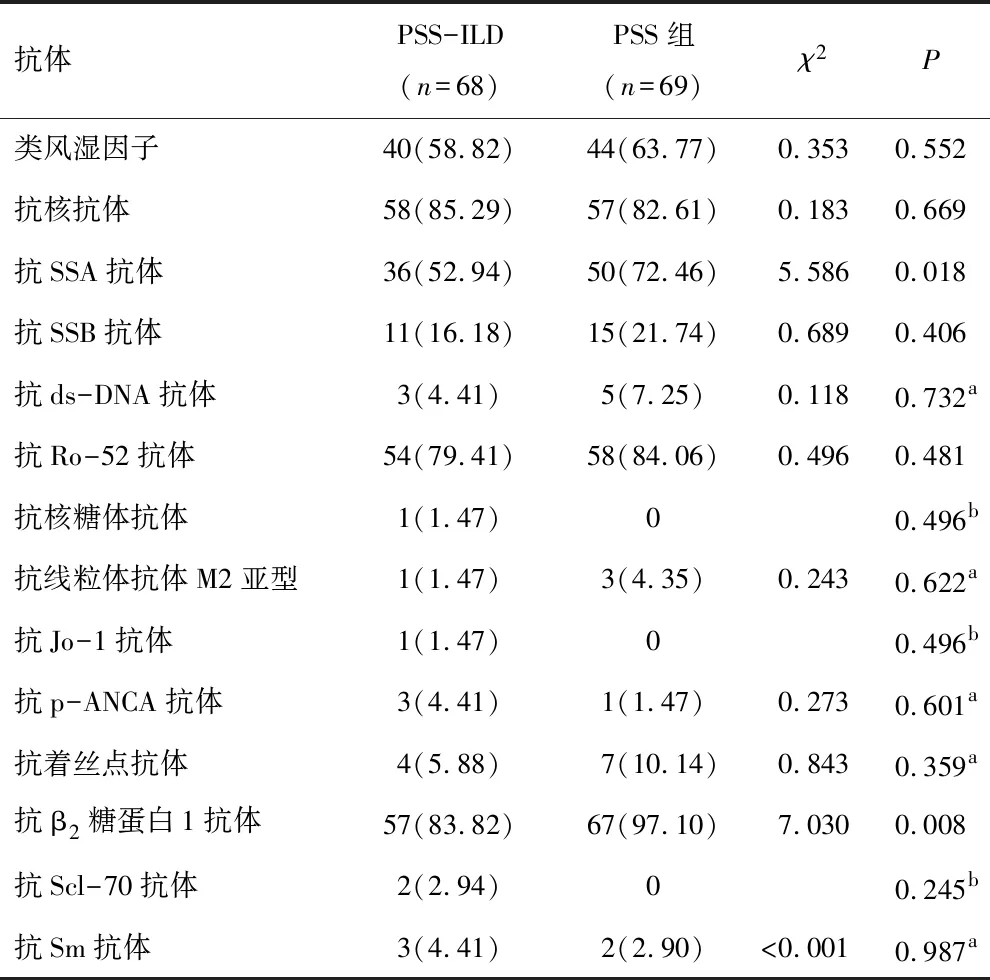
表3 PSS-ILD组与PSS组自身免疫抗体阳性率 对比[n(%)]
2.4 临床症状PSS-ILD组患者咳嗽、咳痰、胸闷、气喘的发生率高于PSS组,口干、眼干、关节肿痛的发生率低于PSS组,差异有统计学意义(P<0.05)。两组患者发热、腮腺炎、雷诺现象、龋齿、晨僵、皮疹、乏力、血液系统受累的发生率相比,差异无统计学意义(P>0.05)。见表4。
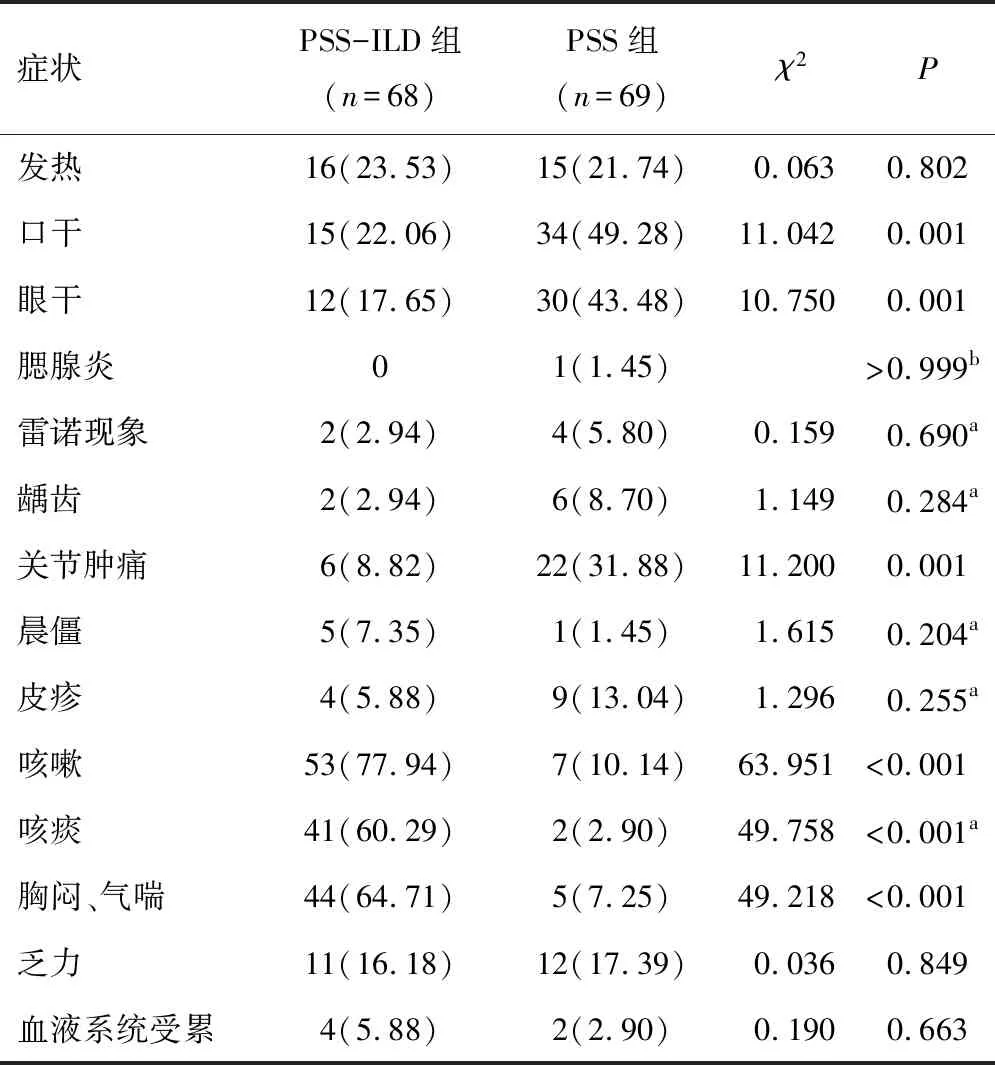
表4 PSS-ILD组与PSS组临床症状对比[n(%)]
2.5 肺部受累的多因素logistic回归分析把上述单因素分析时有统计学意义的变量纳入多因素二元logistic回归分析,结果显示,发病年龄≥65岁是PSS-ILD的独立危险因素(OR=5.033,P<0.05)。见表5。
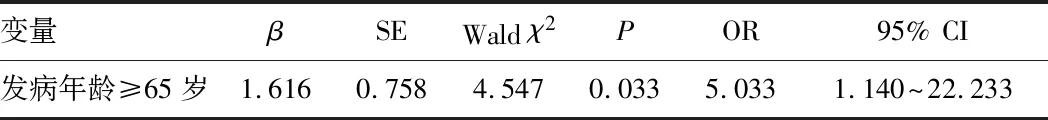
表5 PSS-ILD的多因素二元logistic回归分析
3 讨论
PSS是一种慢性自身免疫性结缔组织病,主要侵犯唾液腺和泪腺等外分泌腺,表现为淋巴细胞和浆细胞对靶器官的进行性浸润,造成靶器官功能障碍。PSS患者肺部受累较为常见,9%~75%的PSS患者中可见亚临床肺部受累,PSS累及肺部时主要表现为小气道疾病、ILD、肺动脉高压、胸膜病变等,其中最常见的是ILD[2,5-6],国内PSS-ILD发生率约为15.5%[7]。临床上,PSS-ILD患者肺部病变的急性恶化可导致呼吸衰竭并存活时间缩短,预后差,5 a生存率约为84%[8]。
目前PSS-ILD的发病机制尚不明确,本研究通过对比分析 PSS-ILD患者与PSS患者的实验室检查结果等,发现PSS-ILD组患者WBC、N、补体C3、补体C4水平均高于PSS组,PSS-ILD组抗SSA抗体阳性率更低。然而,国外也有研究表明,PSS-ILD组患者ESR、CRP、抗SSA抗体阳性率更高,补体C3水平更低[9],这种差异可能是因为2个国家的对照组患者可能有其他非肺系统损害所造成的偏倚。因此,抗SSA抗体阳性率在评估PSS-ILD方面仍存在争议。与此同时,本研究结果显示,PSS-ILD组与PSS组抗核抗体阳性率差异无统计学意义。国外文献报道,抗核抗体与PSS-ILD相关,也有学者认为抗核抗体与PSS-ILD无相关性[10-11]。抗核抗体阳性是否为PSS-ILD的危险因素,需进行更大样本、更多中心研究来进一步证实。因此,目前血清学检查中尚未发现被一致认为能预测PSS-ILD的标志物。
有研究表明,性别、年龄、吸烟是PSS-ILD的危险因素[12],也有文献报道,自PSS诊断时起,肺部受累率由第1年的10%上升至第5年的20%,提示疾病病程也是危险因素[10,13]。本研究结果显示年龄≥65岁可能是PSS-ILD的独立危险因素,这可能是因为随着年龄的增长,患者接触的可引起肺间质纤维化的物质更多,引发自身免疫功能改变,导致效应T细胞对自身抗原产生反应,最终导致ILD的发生。因此,在临床工作中,对于年龄较大的PSS患者应密切关注其肺部高分辨率CT影像的变化,以达到早诊断、早治疗的目的。在临床症状方面,PSS-ILD组患者更易出现咳嗽、咳痰、胸闷、气喘,这可能是由于气道内腺体分泌减少导致咳嗽,也可能与气道高反应性有关[14],胸闷、气喘可能与ILD引起的肺功能下降有关[15]。但有学者认为,在未合并ILD的PSS患者中咳嗽、胸闷、气促的发生率为40%~66%,因此咳嗽、胸闷、气促不能被视为PSS-ILD的特异性症状[11,16]。另外,本研究还显示,PSS组患者更易出现口干、眼干、关节肿痛症状。
本研究存在一定的局限性,PSS-ILD的肺部病理类型具有种类繁多、多种病理类型共存的特点,需肺活检来证实其病理类型,但肺活检为有创检查且花费较高,在临床应用受限,因此本研究中病例均无明确的病理诊断。随着经支气管镜冷冻技术在临床的逐渐普及,不久的将来可广泛应用于诊断PSS-ILD的病理类型。
综上所述,PSS患者合并ILD的概率较高,发病年龄小可能是其危险因素,对于出现咳嗽、咳痰、胸闷、气促的患者应予重视。另外,WBC、N、补体C3、补体C4水平升高对ILD可能具有一定的提示意义,肺部高分辨率CT是早期诊断的关键。
