一种氯霉素印迹聚合物的制备及其性能研究
2021-03-30蒋彩云刘家勋葛伟丽杨爱萍吉志林王玉萍
蒋彩云,刘家勋,吴 婷,葛伟丽,杨爱萍,王 新,吉志林,王玉萍
(1.江苏经贸职业技术学院健康学院,江苏省食品安全工程技术研发中心,江苏 南京 210007)(2.南京师范大学化学与材料科学学院,江苏 南京 210097)
氯霉素类抗生素属抑菌性广谱抗生素,广泛应用于各种传染性疾病的治疗[1-2]. 由于其对人体的毒性较大,能够抑制骨髓造血功能,引起包括白细胞减少、红细胞减少、血小板减少等在内的再生障碍性贫血,因此为了防止残留氯霉素通过食物链进入人体,该药已被禁用于动物性食品和水产品中[3-5].
目前,对于氯霉素残留的检测方法主要采用液相色谱法[6-9],该方法准确度高,但样品前处理过程较复杂,而分子印迹技术[10-14]是近几年发展起来的新兴技术,其技术原理为模板分子与功能单体特异性相结合形成印迹空穴,制备的印迹聚合物可用于选择性识别模板分子[15-17],并能够避免杂质物干扰. 因而分子印迹技术可应用于生物样品中残留抗生素检测的前处理过程,进一步提高抗生素的液相色谱检测效率.
本文以氯霉素为研究对象,采用热聚合法,以N-异丙基丙烯酰胺(NIPAM)为功能单体,成功制备出一种对氯霉素类抗生素具有选择性吸附效果的印迹聚合物(MIPs). 采用FE-SEM、FT-IR、TG、BET表征手段对其形貌、表面官能团、孔径及比表面积等方面进行表征. 实验考察了温度、pH、初始浓度、平衡时间等因素对MIPs吸附量的影响,并确定了等温吸附模型和吸附动力学方程. 此外,还探究了该印迹聚合物对氯霉素的选择性吸附效果.
1 材料与方法
1.1 试验试剂
N-异丙基丙烯酰胺(阿拉丁试剂有限公司,NIPAM);氯霉素(阿拉丁试剂有限公司,CAP),甲砜霉素(阿拉丁试剂有限公司,TAP),氟甲砜霉素(上海麦克林生化科技有限公司,FLR),氧氟沙星(阿拉丁试剂有限公司,OFL),四环素(阿拉丁试剂有限公司,CTY),乙二醇二甲基丙烯酸酯(阿拉丁试剂有限公司,EGDMA),偶氮二异丁腈(阿拉丁试剂有限公司,AIBN),四氢呋喃(国药集团化学试剂有限公司,THF),甲醇(国药集团化学试剂有限公司),乙酸(国药集团化学试剂有限公司),纯水(SAGA-10TY纯水仪,南京易普易达科技发展有限公司).
1.2 实验仪器
SHZ-88A型恒温水浴振荡器(太仓市仪器设备厂),DF-101SA-H恒温水浴锅(南京晚晴化玻仪器有限公司),LG16-B型离心机(北京雷勃尔离心机有限公司),TU-1901型双光束紫外可见分光光度计(北京普析通用仪器公司),Pyris 1热重分析仪(美国PERKIN-ELMR),HITACHI S4800高分辨热场发射扫描电子显微镜(FE-SEM 日本JEOL公司),Cary 5000傅里叶变换红外光谱(美国Agilent公司),ASAP2020比表面积测定仪(Micromeritics公司)
1.3 MIPs的制备
准确称取功能单体N-异丙基丙烯酰胺0.2 g与模板分子氯霉素0.1 g于离心管中预聚合,使用移液枪吸取溶剂四氢呋喃(THF)670 μL与上述离心管中,将所得溶液置于超声波清洗器中超声分散,直至模板分子与温敏单体完全溶解,并且溶液呈清澈透明状时取出,然后在上述分散液中加入交联剂乙二醇二甲基丙烯酸酯500 μL,使其易交联聚合,然后在上述混合溶液中加入引发剂偶氮二异丁腈0.05 g,并置于超声波清洗器中超声溶解,最后将含有混合溶液的离心管用保鲜膜包裹,置于60 ℃恒温水浴锅中反应2 h,即得到氯霉素印迹聚合物. 按照上述方法,不加CAP,制备非印迹聚合物(NIPs).
1.4 模板分子的去除
将上述所得产物研磨成粉末,采用体积比甲醇∶乙酸=9∶1溶液作为脱附溶剂,将MIPs用过滤纸双层包裹放置于索式提取装置中,再将索式提取装置的烧瓶部分置于油浴锅中,油浴温度为100 ℃,油浴脱附液若干小时,每隔固定时间更换脱附液,利用紫外可见分光光度计测定脱附液中CAP的浓度,直至回流出的脱附液在紫外可见分光光度计275 nm处检测不出氯霉素为止. 同时,将NIPs亦用体积比甲醇∶乙酸=9∶1溶液浸泡4 h以出去未反应单体. 最后用纯水洗涤NIPs与脱附完全的MIPs,除去有机溶剂并烘干留有备用.
1.5 材料表征
将制备得到的MIPs与NIPs采用高分辨率场发射电子扫描显微镜(FT-SEM)对其表面形貌进行表征,将粉末样品微量并均匀的平铺于具有导电胶的样品台上,然后对样品台各个表面进行喷金制样,工作电压为15 kV,工作距离为7.5 mm. 利用傅里叶变换红外光谱(FTIR)对其化学结构进行表征,以溴化钾为背景,将溴化钾与样品按照一定比例(一般为30~100∶1)混合研磨压片制样,扫描范围400~4 000 cm-1. 热重分析(TG)的测试条件为氮气氛围,升温速率10 ℃/min,温度范围为25~800 ℃. Brunauer-Emmett-Teller比表面积测定(BET)测试条件为氮气氛围,活化温度为25~250 ℃.
1.6 吸附实验
1.6.1 静态吸附实验
通过静态吸附实验,考察温度、溶液初始pH值、反应时间、CAP初始浓度等参数对吸附性能的影响.
MIPs与NIPs在25 ℃下的等温吸附实验如下:准确称取20 mg MIPs与NIPs分别加入到体积均为 10 mL,浓度为30 mg/L到900 mg/L范围的CAP溶液中,置于恒温水浴振荡器中吸附12 h后,离心收集上清液,最后利用紫外可见分光光度计测定上清液中CAP的浓度,最大吸收波长在275 nm处.
MIPs与NIPs的吸附动力学实验如下:准确称取20 mg MIPs与NIPs分别加入到体积为10 mL,初始浓度为30 mg/L的CAP溶液中,然后分别在吸附20 min、40 min、60 min、90 min、120 min、150 min、180 min后,离心收集上清液,利用紫外可见分光光度计测定上清液中CAP的浓度. MIPs与NIPs在时间t或平衡时的吸附量通过式(1)和(2)进行计算
(1)
(2)
式中,Qt(mg/g)和Qe(mg/g)分别是CAP 的t时刻吸附容量和平衡吸附量,C0(mg/L)和Ct(mg/L)分别是CAP 的初始浓度和时间t时的浓度,V(L)是溶液体积,M(mg)是吸附剂的质量.
1.6.2 选择性吸附实验
为了考察MIPs 和NIPs对CAP的特异识别性能,选择CAP的结构性类似物甲砜霉素、氟甲砜霉素和结构非类似物氧氟沙星、四环素进行单组分选择性吸附试验. 分别配制浓度为30 mg/L的CAP和以上 4种抗生素的溶液,向其中分别加入20 mg MIPs与NIPs,置于恒温水浴振荡器中反应12 h,离心收集上清液,用紫外分光光度计分别在275 nm、224 nm、225 nm、294 nm、357 nm处分别测定上清液中CAP、TAP、FLR、OFL、TCY的浓度.
2 结果与讨论
2.1 FE-SEM谱图分析
MIPs 和NIPs的形貌表征如图1所示,采用热聚合法制备出的MIPs和NIPs具有不同的形貌特征. NIPs的形貌是由尺寸在50~100 nm之间的小颗粒堆积形成的块状,并最终呈现出多层分布的镂空状;MIPs亦是由尺寸在50~100 nm之间的小颗粒堆积而成的块状,但不同的是,MIPs最终呈现的形态是块状表面散落的分布着不规则的小颗粒. 这可能是由于MIPs在制备过程由于交联剂的作用将模板分子与功能单体交联成结导致的,而NIPs由于在制备过程中没有加入模板分子,使其表面没有形成散落的颗粒.
2.2 FT-IR谱图分析
本文借助于功能单体NIPAM分子与模板分子CAP的氢键相互作用,从而使得合成的印迹聚合物具备氯霉素的空穴位点,进而利于印迹聚合物在后续吸附实验中能够与CAP特异性结合. 图2为MIPs 和NIPs的FT-IR光谱分析结果,如图所示,MIPs和NIPs在1 645 cm-1、1 560 cm-1、792 cm-1处均具有较强的NIPAM酰胺I带和酰胺II带的特征吸收峰[18-19];在1 155 cm-1、960 cm-1处均存在醇类羟基弯曲振动和C—O的伸缩振动峰,即为EGDMA的特征峰. 所不同的是,MIPs在2 974 cm-1和1 728 cm-1处存在烷烃类C—H基团的收缩振动峰和酮类羰基基团的收缩振动峰,且特征峰强度较NIPs明显增强. 这可能是由于MIPs聚合物中氯霉素的存在而导致红外谱图中存在特征峰强度的差异[20]. 综上结果表明,模板分子氯霉素在MIPs的制备过程中被成功聚合.
2.3 TG谱图分析
MIPs 和NIPs的热重图谱分析结果如图3所示,由图可知MIPs和NIPs均有两个重量损失阶段:(1)室温~300 ℃,MIPs和NIPs材料中结晶水的损失;(2)300 ℃~500 ℃,骨架结构的分解. 不同的是,NIPs在500 ℃时达到完全失重,而MIPs在800 ℃时仍然剩余8.5%的重量,这是由于MIPs在制备过程中加入了氯霉素,并且氯霉素与功能单体和交联剂形成了一种不易热分解的物质[21]. 由此表明,加入模板分子制备而成的MIPs具有更高的热稳定性,并且进一步证明模板分子被成功聚合.
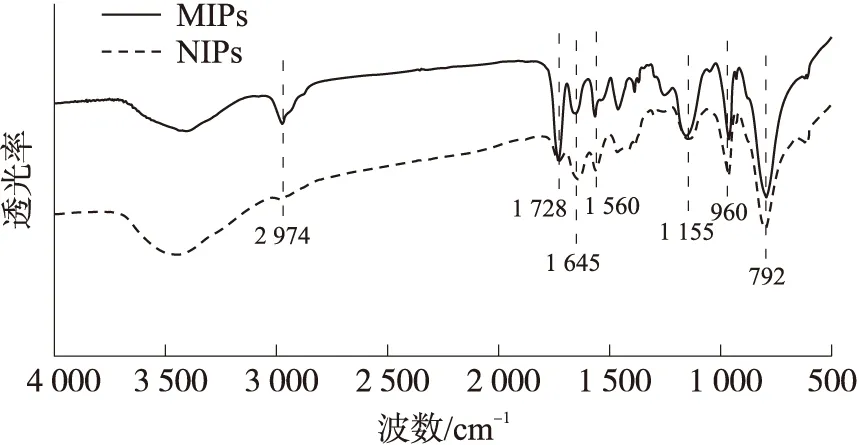
图2 MIPs 与NIPs的FT-IR表征Fig.2 FT-IR spectra of MIPs and NIPs
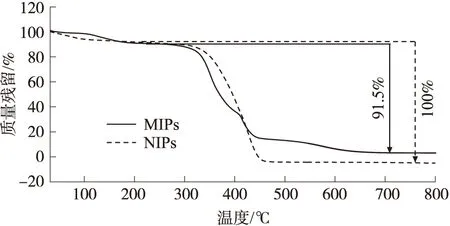
图3 MIPs 与NIPs的TG表征Fig.3 TG curves of MIPs and NIPs
2.4 BET谱图分析
MIPs与NIPs的氮气吸附-脱附曲线以及孔径分布图如图4所示,从图4可以看出,MIPs和NIPs的吸附-脱附等温线在0~1.0的相对压力范围内属于典型的IV型等温线,而曲线中的滞后环表明MIPs和NIPs存在介孔结构. MIPs的吸附-脱附等温线在低压(P/P0<0.8)阶段,氮气在MIPs内表面主要以单层吸附的方式附着,随着P/P0的逐渐升高,MIPs的吸附量随之增大. 根据氮气吸附-脱附曲线的最大吸附量可以看出MIPs具有较好的吸附容量. 根据孔径分布曲线可以看出,MIPs主要以介孔存在,并且孔径分布不均匀. MIPs与NIPs的比表面积分别为105.7 m2/g和32.13 m2/g,孔容分别为0.402 5 cm2/g和0.158 3 cm2/g. 实验结果表明,MIPs的比表面积是NIPs的3倍,出现这一结果的原因可能是由于经过脱附后的MIPs聚合物,其内部结构形成了较NIPs内部结构中没有的印迹空穴.
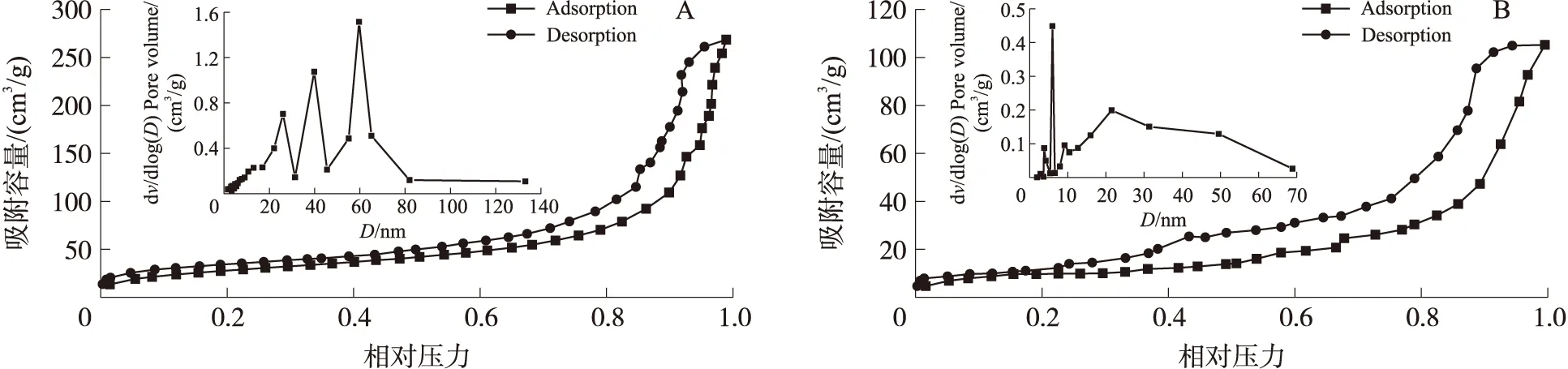
图4 MIPs(A)与NIPs(B)的吸附脱附等温曲线以及孔径分布图Fig.4 N2 and sorption-desorption isotherms and pore size distributions of MIPs and Nips

表1 MIPs 与NIPs的BET表征参数Table 1 BET data of MIPs and NIPs
2.5 溶液初始pH对吸附影响
实验环境因素在材料吸附方面具有一定的影响. 本文首先考察了溶液初始pH的变化对CAP在MIPs与NIPs上吸附量的影响. 已报道的研究表明,氯霉素宜保存于pH条件为酸性或中性环境中,而在碱性环境中易水解失效. 因此,本文实验选取了溶液初始pH=2~8之间的实验条件(初始浓度为30 mg/L),考察CAP在MIPs 与NIPs上的吸附量的变化. 由图5可以看出,随着溶液初始pH的增大,CAP在MIPs 和NIPs上的吸附量呈先减少后增大最后趋于平稳的趋势. 其中,当溶液初始pH=2时,CAP在MIPs上的吸附量为最大,Qe为8.39 mg/g,当溶液初始pH=4时,CAP在MIPs与NIPs上的吸附量均为最低,Qe分别为7.09 mg/g和4.29 mg/g. 这是由于当溶液初始pH=4时,MIPs与NIPs材料表面正电荷较多,而CAP的PKa=9.61,此时CAP溶液亦是正电荷偏多,由于同种电荷相互排斥作用,从而导致在溶液初始pH=4时,CAP在MIPs与NIPs上的吸附量均减少的原因. 由于在实际水体中pH为中性,所以在后续实验中,选择溶液pH=7条件进行探究.
2.6 温度对吸附的影响
为考察温度因素对CAP在MIPs与NIPs上吸附的影响,实验研究了MIPs 与NIPs在25 ℃、30 ℃、35 ℃和40 ℃条件下(初始浓度为30 mg/L),MIPs 与NIPs对CAP的吸附量的变化. 由图6可知,随着温度的升高,MIPs 和NIPs对CAP的吸附量没有明显的变化. 这可能一方面是由于该制备方法采用的是热聚合法,制备的聚合物本身处于比较稳定状态,不易受环境温度干扰. 另一方面是由于聚合体系使用的溶剂为极性较强的四氢呋喃,导致制备出的聚合物为坚硬块状,使得NIPAM的温度响应性能没有完全表现出来.
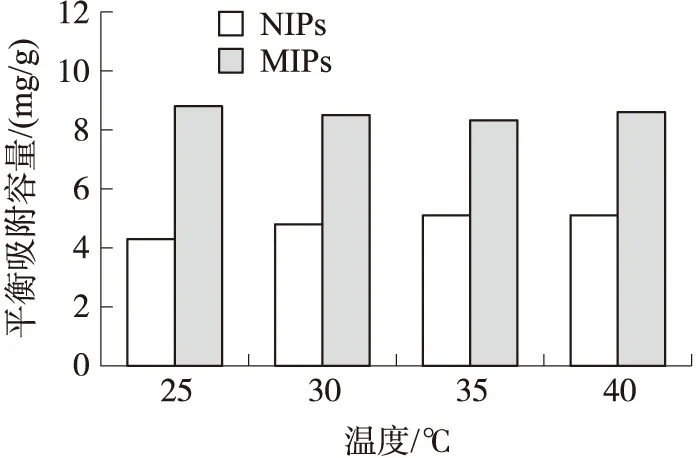
图6 温度对MIPs 与NIPs吸附的影响Fig.6 Effect of temperature on adsorption
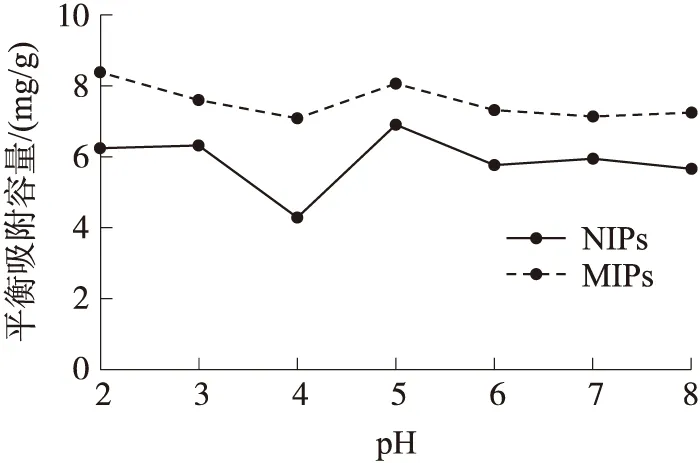
图5 溶液初始pH对吸附的影响Fig.5 Effect of pH on adsorption
2.7 吸附等温线
实验测定了25 ℃下在MIPs 和NIPs 上的吸附等温线. 实验结果如图7所示. CAP在MIPs与NIPs上的平衡吸附容量随着初始浓度的增加而增加. 实验测定CAP在MIPs上的理论最大吸附容量为127.8 mg/g,而在NIPs上的理论最大吸附容量为112.9 mg/g.
(3)
(4)
Langmuir方程(3)可以用来描述单层吸附,而Freundlich方程(4)可以用来描述多层吸附[22-23]. 其中Qe是平衡吸附容量(mg/g),Ce是CAP的平衡浓度,Qm是最大吸附容量,KL是朗缪尔常数(mL/g),n和KF是弗氏常数. 图7为拟合曲线,表2列出了拟合参数Qm、KL、KF、n和R2(相关系数),发现MIPs与NIPs对于Langmuir方程来说,R2均大于0.97,由此说明Langmuir方程能更好地拟合等温线数据,即MIPs与NIPs吸附过程为单分子层吸附.
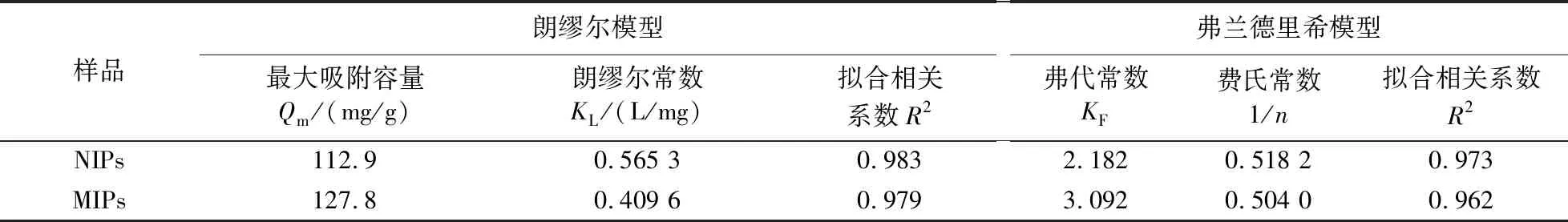
表2 MIPs与NIPs等温模型拟合参数Table 2 Fitting parameters of isothermal adsorption
2.8 吸附动力学
由MIPs和NIPs的吸附动力学实验可知,CAP的吸附容量随吸附时间的增加而增加,动力学吸附量在2 h达到吸附平衡(图8). 利用准一级方程(5)和准二级方程(6)对反应动力学数据进行了分析[24-25],确定了反应速率控制和传质机理. 模型参数拟合结果和R2值见表3,结果表明,两种动力学模型对于MIPs的吸附过程均具有较高的拟合相关系数(R2>0.98). 这是由于MIPs具备的立体空腔和结合位点上的特定分子识别作用,以及随机分布在表面上的官能团的共同吸附所致,即该吸附过程既有物理吸附,也有化学吸附. 然而,准二级动力学模型对于NIPs的动力学吸附过程有更高的拟合相关系数(R2=0.997),这表明化学相互作用在此吸附过程起主要作用. 由此进一步说明MIPs的功能单体与模板分子的印迹作用.
logQe-Qt=logQe-K1t,
(5)
(6)
式中,K1(min-1)是准一级速率常数,K2(g/(mg/min))是准二级速率常数.

表3 MIPs与NIPs吸附动力学拟合参数Table 3 Fitting parameters of adsorption kinetics
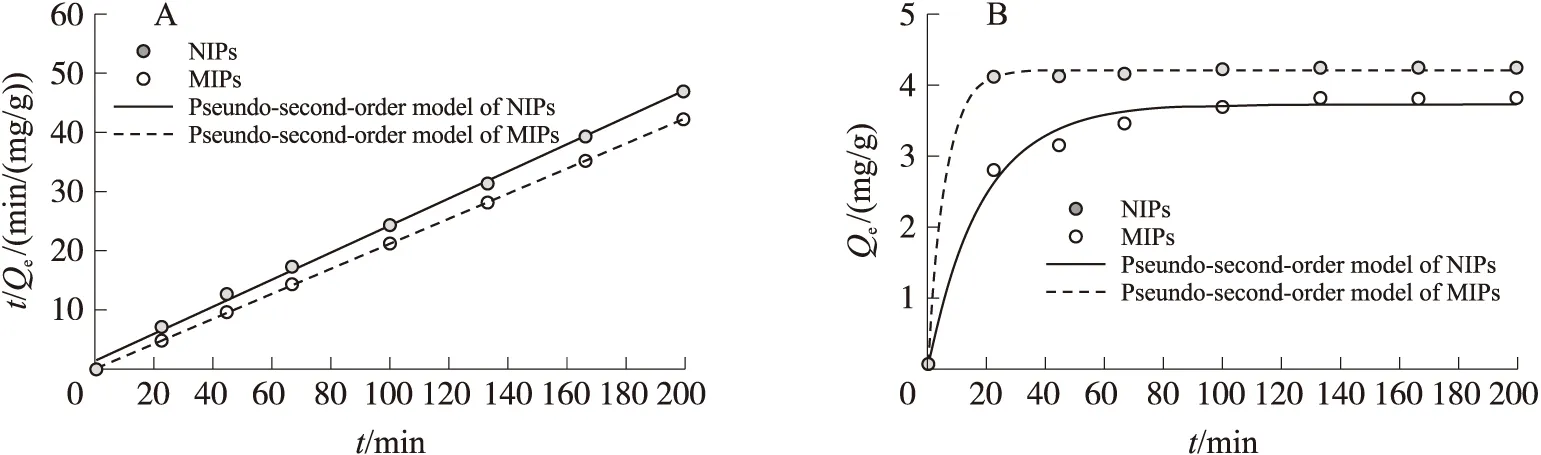
图8 MIPs与NIPs吸附动力学模型Fig.8 Adsorption kinetic model of MIPs and NIPs
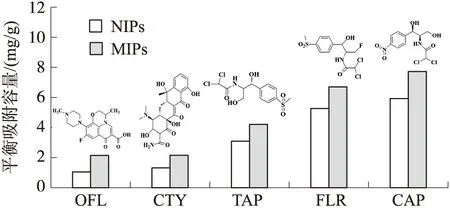
图9 MIPs与NIPs对各个抗生素的吸附效果Fig.9 Adsorption effects of MIPs and NIPs on antibiotic
2.9 MIPs与NIPs对各个抗生素的吸附效果
选择性吸附效果是评价分子印迹聚合物材料性质优劣的重要指标. 本文选用了两种氯霉素同类别抗生素FLR和TAP,以及另外两种氯霉素非同类别抗生素OFL和CTY,评价MIPs和NIPs材料对各个抗生素的吸附效果. 由图9可知,MIPs对OFL和CTY的吸附量分别为2.149和2.152 mg/g,以及对TAP、 FLR、CAP的吸附量分别为4.203、6.702和7.722 mg/g. 结果表明,MIPs对氯霉素类抗生素的吸附比起非同类别抗生素具有明显优势. 由于OFL和CTY 在结构上与CAP的结构差异较大,而FLR和TAP分子结构与CAP结构相似,并且MIPs在制备过程中形成了CAP印迹空穴位点,从而对氯霉素类抗生素具有明显的选择性吸附效果. 其吸附效果顺序为CAP>FLR>TAP>TCY>OFL. 结果说明制备的MIPs对氯霉素具有选择性吸附性能.
3 结论
本文以氯霉素为模板分子,异丙基丙烯酰胺为功能单体,采用热聚合法,制备出了一种对氯霉素类抗生素具有较大的吸附量和较好选择性的印迹聚合物. 通过FT-IR和TG的结果表明,MIPs的模板分子在制备过程中被成功印迹. 氮气吸附-脱附曲线结果显示,MIPs为介孔吸附剂,并具有较大的比表面积,为吸附效果良好提供佐证. 通过静态吸附实验结果显示,MIPs在室温下,pH=7条件下,吸附2 h达到吸附平衡,理论最大吸附量为127.8 mg/g,并且该吸附过程更符合Langmuir单分子层等温吸附模型以及准二级动力学方程. 选择性吸附实验结果表明MIPs对氯霉素类抗生素具有较好的选择性.
