浓缩生长因子对前臂皮瓣供区术后感觉功能恢复的影响
2021-03-30吴元元朱载瓯武和明张静露周薇娜吴煜农宋晓萌
吴元元,王 义,朱载瓯,丁 旭,武和明,刘 婕,王 方,张静露,周薇娜,吴煜农,宋晓萌
随着显微外科技术的发展,血管化游离皮瓣修复颌面部缺损的成功率得到了显著提升[1]。1981年杨果凡发明前臂皮瓣后[2],该皮瓣因血供充足、质地柔软、可塑性好等诸多优点逐渐成为颌面部重建的主要手段。传统的前臂皮瓣在制备过程中为考虑患者术后供区感觉功能的留存,对于暴露出的桡神经浅支常采取游离保护,但因制备过程中的机械牵拉及术后的包扎压迫,患者供区感觉常会出现不同程度的退化,影响日常工作生活[3]。
有研究报道采用不同的前臂制备方式及不同的创面关闭手段均可在一定程度上改善术后感觉[4-5],但效果欠佳。因此,如何简单、高效且安全地促进前臂区域术后感觉恢复,逐渐成为临床医生关注的重点。
浓缩生长因子(concentrated growth factor,CGF)作为第三代血小板浓缩物,最早由Sacco[6]提出,被广泛应用于组织损伤重建及再生修复。近年来,研究者们发现其在神经修复领域也有一定作用,可有效促进神经再生[7-9],作为神经损伤治疗的备选方案。但CGF在前臂桡侧皮神经的修复方面尚未见报道。本文目的旨在探索前臂皮瓣制备过程中应用CGF膜覆盖桡神经浅支,观察CGF对前臂术后供区感觉功能恢复的影响。
1 资料与方法
1.1 研究对象
回顾性分析2019年7月至2020年7月南京医科大学附属口腔医院采用前臂皮瓣修复颌面部缺损的30例患者,分为试验组(16例)及对照组(14例)其中男23例,女7例,年龄33~78岁,随访时间(4.0±1.6)个月。试验组采用CGF膜覆盖桡神经浅支,对照组不予以处理。患者病理类型均为鳞状细胞癌,其中舌癌12例,颊癌10例,口底癌3例,口咽癌2例,牙龈癌2例,腭部鳞癌1例。课题已通过南京医科大学附属口腔医院伦理学审批(PJ2019-049-001)。患者均知情并签署同意书。课题纳入标准:①均采用前臂游离皮瓣修复口腔缺损;②术中桡神经浅支均得到游离保护;③术后手臂无明显感染及外伤;④患者均无血液类疾病;⑤患者配合度好。
1.2 研究方法
1.2.1 CGF制备 术中采用4支真空采血管(意大利 Silfradent 公司,未添加抗凝剂),采取患者足背静脉血32 mL,对称置于Medifuge CGF血纤维蛋白离心制造机(意大利 Silfradent公司),变速离心13 min,可见静脉血分为三层,中间层黄色胶冻状物质即为CGF(图1)。
1.2.2 手术方法 所有患者均采用前臂桡侧游离皮瓣修复缺损,术者按标准化流程制备皮瓣,对显露的桡神经浅支予以充分游离保护。试验组术中制备CGF,采用纱布法压制成膜,覆盖于暴露的桡神经上(图2),对照组不做处理。两组均制备腹部游离皮片关创,于术创常规加压包扎。术后10 d取下绷带,14 d拆除手臂缝线,术后1、3、6个月复诊随访。
1.2.3 测量方法及评价指标 桡神经浅支(皮支)在前臂中下1/3交界转向背侧,继续下行至手背,分布于手背桡侧半皮肤和桡侧三个半手指近节背面皮肤。术后感觉障碍是以第1、2掌骨间隙背面“虎口区”皮肤最为明显[10]。因此,本实验采用定量感觉测试(quantitative sensory test,QST)测定:“虎口区”皮肤感觉(图3)。测试期间,保持房间安静,室温维持在25 ℃,尽量减少环境的影响。所有患者分别于术前、术后1、3、6个月测量记录相应数据。

白色箭头所指处为CGF

A:试验组;B:对照组;白色箭头指示桡神经浅支,黑色箭头指示覆盖于桡神经浅支上的CGF
图3 测试区域示意图Fig.3 Test site in back hand
测定方法及指标具体如下。
机械检测阈值(mechanical detection threshold,MDT)用一套标准的Semmes-Weinstein单丝(美国 NCM公司)测量,该单丝施加力的大小在0.008~300 g之间。测试者使用细丝垂直于测试部位停留1~2 s,并询问患者是否有感觉[11]。
机械疼痛阈值(mechanical pain threshold,MPT)使用标准化的加权针刺刺激器(一组7个加权针刺刺激器)(丹麦奥尔堡大学)进行测量。针刺装置由7种刺激强度组成,分别为8、16、32、64、128、256、512 mN。测试者垂直缓慢地以2 s的速率垂直施加针刺,直到疼痛感第一次出现或消失,从而进行了3次阈值范围确定,并计算3组阈值的几何平均值[12]。
温度定量感觉测试采用TSA-Ⅱ型温度定量感觉测试仪(美国 MEDOC公司)。使用30 mm×30 mm正方形探头对受试区域进行测量。首先测量冷感觉阈值(cold detection thresholds, CDT)及热感觉阈值(warm detection thresholds, WDT),然后测量冷痛觉阈值(cold pain thresholds,CPT)及热痛觉阈值(hot pain thresholds,HPT)。探头的基准温度为32 ℃,以1 ℃/s的速度加热或冷却。为保证患者安全,设置中断温度为0 ℃及52 ℃。测试过程中指示患者在感觉到冷、热、冷痛及热痛时按下按钮,重复测量3次取平均值[13]。
压力疼痛阈值 (pressure pain threshold, PPT)的测定采用手持式压力测试计(美国MEDOC公司)。测试者于受试区域缓慢施加压力,患者感觉到压痛后按下按钮,测试间隔1 min,重复测量三次取平均值[14]。
1.3 统计学方法
统计分析使用SPSS 23.0软件。不同部位测量数据均采用均值±标准差表示。计算试验组和对照组术后1、3、6个月与术前检测值的差值,比较两组不同时间段的差值,判断两组术后感觉恢复情况是否有差异。MDT及MPT相关变量为等级资料,检测采用曼-惠特尼秩和检验,CDT、WDT、CPT、HPT、PPT相关变量为计量资料,检测采用独立样本t检验,P<0.05表示结果有统计学差异。
同时,本试验采用Z分数描述试验组及对照组定量感觉测试各变量分布的差异[11]。两组均采用术前检测值作为参考值进行Z分数转换。转换公式:Z分数=(术后数据-术前数据)/术前数据标准差,分别计算术后1,3,6个月各变量值的Z分数。Z分数<-1.96或>1.96被认为已出现感觉的丧失。
2 结 果
两组患者的基本信息见表1,其中试验组16人、对照组14人。两组术前、术后1、3、6个月分别测量的PPT、CDT、WDT、CPT、HPT值以均值±标准差的形式列于表2,两组术后1、3、6个月与术前检测值的差值列于表3。两组患者术后伤口愈合良好,未出现明显感染及瘢痕增生。
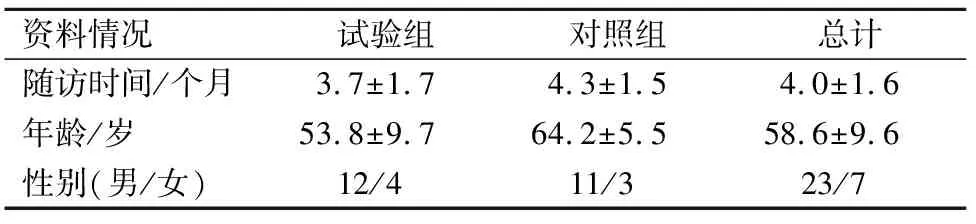
表1 患者的临床资料Tab.1 Patient information

表2 受试者虎口区定量感觉测试结果Tab.2 Results of MDT, MPT, PPT, CDT, WDT, CPT and WPT between the thumb and index in patients

表3 两组受试者术后温度感觉阈值及机械疼痛阈值的差值Tab.3 Postoperative differences of PPT, CDT, WDT, CPT and WPT of the two groups
2.1 MDT与MPT
术后1个月,试验组与对照组的MDT差值无统计学差异(P=0.185),术后3、6个月的MDT差值以及术后1、3、6月的MPT差值均可见统计学差异(P<0.05),具体见表4及图4。

A~G分别代表两组MDT、MPT、CDT、WDT、CPT、HPT、PPT在1、3、6个月差值的比较,*代表差异有统计学意义

表4 两组受试者术后MDT及MPT差值比较结果Tab.4 Comparison results of MDT and MPT of the two groups (CGF vs. control)
2.2 温度阈值与压力痛觉阈值
术后1、3、6个月试验组测量的温度阈值差值均小于对照组,但两组术后1、3个月的CPT差值无统计学意义(P=0.417,P=0.151),术后6个月的CPT差值有统计学意义(P<0.05)。同时两组的CDT、WDT及HPT在术后1、3、6个月的差值也均有统计学意义(P<0.05)。另外,试验组在1、3、6个月的PPT差值显著小于对照组(P<0.05),具体见表5及图4。
2.3 Z分数
试验组与对照组患者在不同时间的Z分数如图5。我们发现两组患者的WDT及CDT术后1、3、6个月均可见明显感觉丧失。在术后3个月,试验组的供区感觉已基本恢复正常,而对照组的部分患者在术后6个月仍可见明显感觉异常。

表5 两组受试者术后温度感觉阈值及机械感觉阈值差值比较结果Tab.5 Comparison results of CDT, WDT, CPT and HPT of the two groups (CGF vs. control)

A:试验组各测量值的Z分数;B:对照组各测量值的Z分数,灰色区域:-1.96 对于前臂皮瓣术后的患者,无论采取怎样的手术方式都会损伤到桡神经浅支,影响术后支配区域的感觉[15-16]。研究表明,前臂皮瓣的术后感觉异常发生率在20%~93%[3]。目前对于大部分神经损伤,药物和物理治疗的联合应用仍是第一选择,但Kim等[17]也提出,在下牙槽神经损伤的患者中,近70%在联合治疗后感觉异常仍未有较大改善。 之前已有报道指出早期的血小板浓缩物-富血小板血浆(palate rich plasma, PRP)和富血小板纤维蛋白(palate rich fibrin,PRF),可促进小范围损伤神经的再生及支配区域感觉的恢复[18-19],因此,作为最新一代血小板浓缩物的CGF,为临床上修复神经损伤提供了新思路。 CGF是通过差速不间断离心技术获得的血小板浓缩物[20],富含柔软疏松的纤维蛋白网格和大量生长因子,其中包括血小板衍生生长因子、转化生长因子、碱性成纤维细胞生长因子、血管内皮生长因子、胰岛素样生长因子、表皮生长因子及骨形成蛋白等[21]。这些因子在机体中通过各种信号通路,实现骨组织重建、软组织修复再生及神经损伤修复。付丽等[22]在下牙槽神经移位后的同期种植过程中,应用CGF包裹下牙槽神经,结果表明术后2个月患者的感觉功能已基本恢复正常,明显缩短了愈合时间,证明了CGF在临床神经损伤应用的可行性。 2006年,德国神经疼痛研究网络(German research network on neuropathic pain, DFNS)提出一套标准QST程序,通过刺激有髓Aδ纤维和无髓C纤维,评估外周神经功能状况,近年来被广泛应用于口腔颌面部疼痛的测量及周围神经损伤情况的评价[13,15]。 基于上述研究,本研究首次将CGF应用于前臂供区,覆盖暴露的桡神经浅支,经过术后1、3、6个月的随访,测量QST的各参数值,观察神经损伤的修复效果。本文研究数据表明,试验组神经恢复情况明显优于对照组,试验组患者在术后3个月,PPT、CPT及HPT感觉异常基本恢复,术后6个月,CDT及WDT感觉异常基本恢复,随访病人未有明显不适;而对照组患者在术后6个月的WDT及CDT仍有明显异常。 现阶段CGF促进神经修复再生的机制尚未明确,但有学者发现,CGF可通过与受体的结合,增加整合素β1的表达。而整合素β1可介导粘着斑激酶途径促进施万细胞的增殖、迁移。与此同时,CGF还可促进mTOR的磷酸化,mTOR相关信号通路可能在促受损神经再生过程中发挥重要作用[7-9]。 本实验研究的局限性为:①本实验样本量较小以及术后6个月的随访数据较少,需纳入更多病例进一步验证结果的普适性;②QST测试多依赖于患者的主观感觉,会造成结果一定的偏移;③本实验中患者年龄跨度较大,未考虑年龄对术后神经恢复的影响。 综上所述,使用CGF覆盖前臂供区可明显促进术后感觉功能的恢复。此外,由于CGF仅采用患者静脉血制备,伦理及安全方面可得到保证,建议于临床上推广使用。3 讨 论
