PPP1R3C基因在3T3-L1前脂肪细胞分化过程中的功能研究
2021-03-29李成萍张海燕刘雪燕周国利
崔 潇,李成萍,张海燕,刘雪燕,周国利
(聊城大学 生命科学学院,山东 聊城 252059)
0 引言
糖原和脂质是能量的主要储存形式,受到激素和代谢信号的严格调控。糖原是能量储存和利用的首选,它的代谢严格地被激素和营养状况调控,从而进一步通过多种途径调控糖原磷酸化酶(glycogene phosphorylase,GP)和糖原合成酶(glycogen synthase,GS)的活性[1]。蛋白磷酸酶1调节亚基(protein phosphatase 1 regulatory subunit),也称糖原靶向调控亚基(G亚基),通过将蛋白磷酸酶1(protein phosphatase 1,PP1)的催化亚基靶向糖原颗粒来协调糖原合成[2,3]。它们调节糖原代谢酶的活动,通过PP1介导的去磷酸化,主要是对糖原合成酶磷酸酶(glycogen synthase phosphatase,GSP)去磷酸化和激活GS,进而刺激糖原生成。根据GenBank数据库,已知有7个基因编码G亚基(protein phosphatase 1 regulatory subunit 3a-3g,PPP1R3A-PPP1R3G)[2]。
蛋白磷酸酶1调节亚基3C(protein phosphatase 1 regulatory subunit 3C,PPP1R3C),也称为糖原靶向蛋白(protein targeting to glycogen,PTG),在许多组织中均有表达,小鼠的PPP1R3C杂合缺失可导致许多组织糖原水平降低,并伴有进行性葡萄糖耐受不良、高胰岛素血症和随着年龄增长的胰岛素抵抗[4]。在肝脏中,PTG和GS几乎以同等的水平表达[5],它们共同作用加速肝糖原的代谢和储存。PTG过表达显著增加糖原含量,因为PP1和GS重新分配到糖原中,同时GS活性和糖原合成显著增加[6-10]。尽管PTG具有对糖原的代谢有很大的影响,但它是如何调控糖原代谢仍不清楚,一种可能的调节方式是在转录水平的。去甲肾上腺素和腺苷酸均可上调星形胶质细胞和肝细胞中PTG基因的转录水平,同时伴有糖原合成增加[11]。转录因子叉头框蛋白A2(forkhead box A2,FoxA2)在体外直接与PTG基因的启动子区域结合并激活它的转录,而且PTG启动子中的两个SREBP/上游刺激因子结合元件也提示了SREBP潜在的转录调控作用[12]。
在小鼠的脂肪组织中,使用脂肪酸结合蛋白4(fatty acid binding protein 4,FABP4)启动子超表达PPP1R3C,结果表明,脂肪组织中糖原水平比野生型小鼠高出200-400倍,显示脂肪细胞具有容纳高水平糖原的空间能力,糖原在脂肪沉积中的重要性被证实[13]。目前的数据显示,在营养过剩期间,当糖原达到阈值水平时,能量储存会从糖原转移到脂质。这种能量存储模式的转变可能是由于哺乳动物雷帕霉素靶蛋白复合物1(mammalian target of rapamycin complex 1,mTORC1)和其转录靶标SREBP1之间的正反馈回路造成的[14]。但是PPP1R3C在3T3-L1前脂肪细胞分化中的功能尚不清楚,并且,它是否与SREBP1在脂肪细胞分化中具有协调作用还需进一步的分析。因此,本研究以3T3-L1前脂肪细胞为实验材料,通过对目的基因PPP1R3C的功能获得与缺失实验及相应的分子生物学技术,研究小鼠PPP1R3C基因在3T3-L1前脂肪细胞分化中的功能,并初步探讨SREBP1与PPP1R3C基因在脂肪细分化中的调控关系。
1 材料与方法
1.1 实验材料
1.1.1 细胞株。小鼠3T3-L1 前脂肪细胞株购自武汉普诺赛生命科技有限公司。
1.1.2 药品与试剂。地塞米松、 3-异丁基-1-甲基-黄嘌呤(IBMX)和胰岛素购自美国Sigma公司;胰蛋白酶、DMEM高糖培养基购自美国HyClone公司;胎牛血清购自美国Gibco公司;RNAeasyTMPlus动物RNA抽提试剂盒、BeyoRTTMcDNA第一链合成试剂盒购自上海碧云天生物技术有限公司;EcoRI和NotI限制酶、SYBR Green PCR Master Mix试剂盒购自NEB(北京)有限公司;siRNA和阴性对照购自上海吉玛制药技术有限公司;油红O试剂盒购自南京建成生物工程研究所。
1.2 实验方法
1.2.1 细胞培养及诱导分化。3T3-L1前脂肪细胞接种在含10% FBS和1%双抗的DMEM培养基中,于37℃ 5% CO2的培养箱中培养,细胞汇合率达85%后,加胰蛋白酶消化,按1:3的比例传代培养。接触抑制2天(D0)后,向DMEM培养基中添加终浓度分别为10 μg/mL 胰岛素、100 μM地塞米松和0.5 mM IBMX,诱导分化2天(D2)后,培养基中只添加终浓度为10 μg/mL胰岛素继续维持分化,培养2 d。然后改换为含10% FBS的DMEM培养基,隔天更换一次培养基进行培养。
1.2.2 油红O染色。吸去培养板中的培养基,用PBS清洗细胞3次;在37 ℃下,细胞用油红O染液着色1 h,期间注意观察染色情况;双蒸水(ddH2O)清洗残留油红O染液;染色完成后,通过倒置显微镜(ZEISS Axio Vert.A1)观察并拍照记录;记录完成后,染色的细胞用ddH2O清洗,加入100-200 μL的异丙醇抽提,510 nm波长测定OD值,对油红O染色进行定量分析。
1.2.3 引物设计。根据NCBI数据库中已公布的小鼠PPP1R3C、SREBP1以及成脂标志基因(PPARγ、C/EBPβ、C/EBPα、FABP4)和β-actin的mRNA序列,利用Primer 5.0设计引物,引物由北京六合华大基因科技有限公司合成,引物序列信息详见表1。

表1 本研究中所用的引物序列
1.2.4 基因表达载体的构建。利用RNAeasyTMPlus动物RNA抽提试剂盒从3T3-L1中提取总RNA,然后用BeyoRTTMcDNA第一链合成试剂盒进行反转录,利用cDNA为模板,扩增PPP1R3C基因的CDS序列片段,然后将其克隆到带有flag标签的pCMV载体上的EcoRI和NotI之间,挑取阳性克隆进行测序验证,所用的引物见表1。
1.2.5 实时定量PCR。利用RNAeasyTMPlus动物RNA抽提试剂盒从3T3-L1不同分化时间点的细胞中提取总RNA,再用BeyoRTTMcDNA第一链合成试剂盒进行反转录,合成cDNA。然后利用SYBR Green PCR Master Mix试剂盒,在CFX96定量PCR仪(伯乐,美国)上进行实时定量PCR,采用2-ΔΔCt法分析各基因的相对表达量,β-actin作为内参,所用的引物见表1。
1.2.6 siRNA合成、过表达载体及细胞转染。SREBP1、PPP1R3C基因的干扰小RNA(siRNA)和它们的阴性对照(scramble)序列信息见表2。合成的siRNA 在3000 r/min离心1分钟,再加入125 μL DEPC水配成浓度为20 μM 溶液备用。

表2 siRNAs 序列信息
将3T3-L1前脂肪细胞与过表达载体或siRNA混匀于500 μL无血清培养基中,用Gene Pulser Xcell 电穿孔仪(伯乐,美国)进行转染。转染条件为:方波、电压 220 V、电容 960 μF。12孔板中每孔转染质粒6 μg,siRNA终浓度为50 nM。
1.2.7 统计分析。通过GraphPad Prism 7软件作图并进行统计学分析,数据表示为平均数±标准差(Mean ±SD),显著水平以p<0.05(*)和p<0.01(**)为标准。
2 结果与分析
2.1 过表达PPP1R3C基因促进3T3-L1前脂肪细胞分化
为分析PPP1R3C基因对3T3-L1前脂肪细胞分化的影响,进行了PPP1R3C基因的过表达实验。首先,转染24 h后通过实时定量PCR检测PPP1R3C的表达量,以测定其转染效率,与对照组相比,转染组PPP1R3C的表达量显著高于对照组,说明转染效率良好(图1(a))。检测了脂肪细胞分化标志基因PPARγ、C/EBPα和C/EBPβ的表达谱。结果显示,与对照组(pCMV-Flag)相比,PPP1R3C基因过表达导致PPARγ、C/EBPα和C/EBPβ成脂分化标志基因的表达升高,PPARγ基因表达量在3T3-L1前脂肪细胞诱导分化的第4 d、第6 d和第8 d差异显著(p<0.05,图1(b));C/EBPα基因表达量在诱导分化的第2 d、第4 d和第8 d差异极显著(p<0.01),诱导分化第6 d差异显著(p<0.05,图1(c));C/EBPβ基因表达量在诱导分化的第2 d和第4 d差异显著(p<0.05),第6 d和第8 d差异极显著(p<0.01,图1(d))。诱导分化8 d后,通过油红O染色和定量分析表明,过表达PPP1R3C基因导致脂滴含量显著增加(图2)。

注:(a) 转染24 h后PPP1R3C的过表达效率;(b) 诱导分化各时期PPARγ基因的表达量;(c) 诱导分化各时期C/EBPα基因的表达量;(d)诱导分化各时期C/EBPβ基因的表达量;β-actin为内参,*表示p<0.05,**表示p<0.01,***表示p<0.001。

注:(a) 经过8 d的分化后,脂滴积累的定量结果,**表示p<0.01;(b) 脂滴的油红O染色结果,比例尺表示100 μm。
2.2 敲低PPP1R3C基因的表达抑制3T3-L1前脂肪细胞分化
在3T3-L1前脂肪细胞中转染siPPP1R3C,检测对前脂肪细胞分化的影响。转染24 h后,实时定量PCR分析结果显示,转染PPP1R3C特异性siRNA(siPPP1R3C)可以显著降低PPP1R3C的mRNA表达水平(p<0.05;图3(a))。利用油红O染色检测3T3-L1细胞脂肪生成过程中的脂滴积累。如图所示,油红O染色结果清晰地表明在诱导分化后第8 d,干扰PPP1R3C的3T3-L1细胞中的脂滴累积明显减少(图3(b),(c))。此外,干扰PPP1R3C显著降低了成脂分化标志基因的表达水平(图4)。上述结果表明干扰PPP1R3C基因的表达会抑制3T3-L1细胞的成脂分化。

注:(a) 转染24h后PPP1R3C的过表达效率,β-actin为内参,**表示p<0.01;(b) 经过8 d的分化后,脂滴积累的定量结果。*表示p<0.05;(c) 脂滴的油红O染色结果,比例尺表示100 μm。

注:诱导分化后8 d的干扰组与对照组细胞的PPARγ(a);C/EBPα(b)和FABP4(c)基因表达的实时定量PCR分析,β-actin为内参,*表示p < 0.05,**表示p < 0.01。
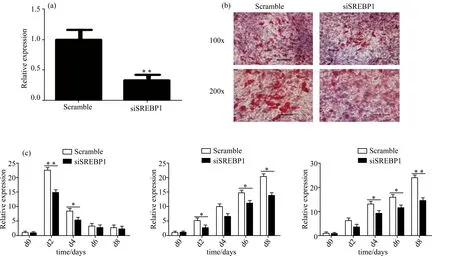
注:(a) 转染24 h后SREBP1的干扰效率,β-actin为内参,**表示p < 0.01;(b) 诱导分化8 d后,脂滴的油红O染色结果,比例尺表示100 μm;(c) 诱导分化期间各时间段干扰组与对照组的C/EBPβ、C/EBPα、PPARγ基因表达的实时定量PCR分析,β-actin为内参,*表示p < 0.05,**表示p < 0.01。
2.3 敲低SREBP1基因的表达可抑制3T3-L1前脂肪细胞分化
首先检测了在siSREBP1转染24 h后SREBP1的表达,实验组显著低于对照组(图5(a))。通过油红O染色(图5(b))可以看到干扰SREBP1后,实验组脂滴积累明显少于对照组的脂滴积累。在转染的3T3-L1细胞脂肪生成过程中,分别检测了前期脂肪分化标志基因(C/EBPβ)和后期标志基因(PPARγ和C/EBPα)在分化各时期的表达谱(图5(c)),结果表明,与对照组(Scramble)相比,干扰组(siSREBP1)中的C/EBPβ基因表达量在诱导分化的第2 d差异极显著(p<0.01)、第4 d差异显著(p<0.05);C/EBPα基因表达量在诱导分化的第2 d、第6 d和第8 d差异显著(p<0.05);PPARγ基因表达量在诱导分化的第4 d、第6 d差异显著(p<0.05)、第8 d差异显著(p<0.01)。
2.4 敲低SREBP1抑制PPP1R3C基因的表达
为了探究SREBP1基因对PPP1R3C基因的调控作用,干扰SREBP1基因后,利用实时定量PCR分别检测了SREBP1基因和PPP1R3C基因在3T3-L1前脂肪细胞分化过程中各时期的相对表达量(图6)。
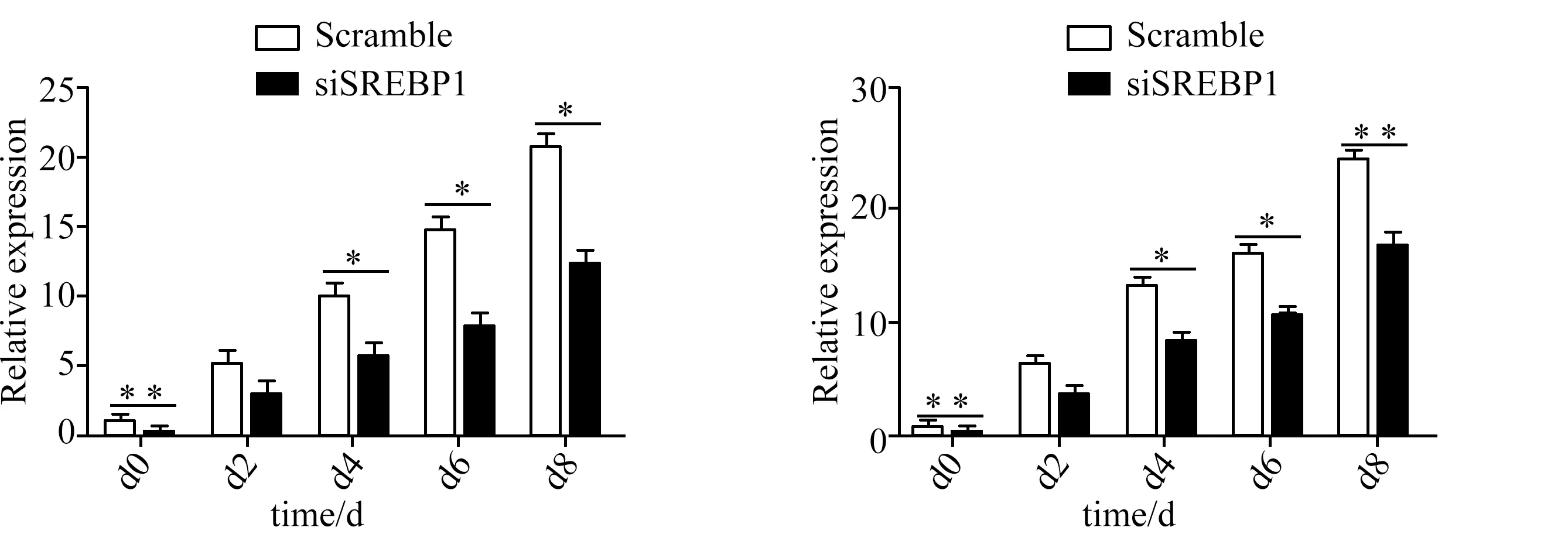
注:诱导分化时各时间点干扰组与对照组的SREBP1和PPP1R3C基因的实时定量PCR分析,β-actin为内参,*表示p < 0.05,**表示p< 0.01。
结果显示,利用siRNA干扰SREBP1基因的表达,可导致PPP1R3C的表达受到抑制,说明PPP1R3C和SREBP1之间存在一定的关联。在3T3-L1前脂肪细胞分化过程中,可能SREBP1基因参与调控PPP1R3C 基因的表达,准确的调控机制还需要进一步分析。
3 讨论
脂肪细胞的成脂分化是由正、负调控因子严密调控的过程。但至今还没有发现在缺失PPARγ的情况下,可发动脂肪细胞的成脂分化[15]。除此以外,SREBP1、糖皮质激素、cAMP 应答元件结合蛋白和C/EBPδ对脂肪细胞的成脂分化都有促进作用;Wnts通路、 Krüppel样因子家族部分成员、转录因子E2F家族、叉头转录因子家族的成员、C/EBP 同源蛋白等对成脂分化有负调控作用[16]。我们前期对3T3-L1脂肪细胞分化过程中转录组的变化进行了研究,分析了D0和D13 的差异表达基因,发现PPP1R3C基因在脂肪细胞分化过程中是上调的(log2FoldChange=3.97)[17],暗示PPP1R3C基因在脂肪细胞分化中可能存在一定的功能。本研究结果显示,过表达PPP1R3C基因促进了3T3-L1分化的脂肪细胞中脂肪特异性基因的表达和脂滴的形成。
本研究也发现,在3T3-L1前脂肪细胞中敲低PPP1R3C基因的表达,导致脂肪生成和脂肪基因表达受到抑制,提示PPP1R3C可能在3T3-L1脂肪形成过程中起正向调控作用。糖原和甘油三酯是人体能量储存的两种主要形式,在食物缺乏的不同阶段提供能量。然而,糖原代谢是如何与脂肪组织中的脂肪沉积相联系的还没有明确的定论。在从禁食到进食状态的转变过程中,脂肪组织中形成了大量的糖原,人们推测:(1) 脂肪组织可以合成糖原;(2) 脂肪组织的糖原代谢是特异性调控的;(3) 脂肪组织可能影响碳水化合物转化为脂肪;(4) 脂肪组织在糖脂代谢中似乎发挥更积极的作用。人们还假设糖原沉积是碳水化合物转化为脂肪组织中的脂肪的先决条件,因为脂肪沉积发生在糖原沉积之后[18]。通过缺失PPP1R3G的小鼠模型,与野生型相比,高脂肪饮食喂养后,PPP1R3G缺失小鼠的体重和脂肪组成显著降低。高脂肪饮食引起的肝脏脂肪变性也因PPP1R3G的缺失而略有缓解。PPP1R3G的缺失降低了脂肪组织中的糖原水平。PPP1R3G的过表达会导致糖原和甘油三酯水平的升高。研究表明,糖原积极参与脂肪组织的脂肪积累和高脂肪饮食的肥胖发展,PPP1R3G是体内糖原代谢与脂质代谢相联系的重要分子[19]。后来发现脂肪组织确实具有合成糖原的巨大能力。除了PPP1R3G外,PPP1R3B是脂肪组织中表达的另一个G亚基基因[6]。而本研究中的PPP1R3C基因与PPP1R3G、PPP1R3B基因同属一个家族,在脂肪细胞分化过程中也是上调的,而且过表达PPP1R3C基因促进成脂分化,敲低其表达抑制成脂分化,说明PPP1R3C基因与PPP1R3G、PPP1R3B基因在糖原和脂肪代谢中可能有相似的功能。
另外,PPP1R3C基因受SREBP1基因的调控,PPP1R3C基因和SREBP1基因同时作为胆固醇合成途径的重要组分,它们很有可能在调控脂肪生成的过程中存在协同作用[14]。有趣的是,我们的研究结果显示,在3T3-L1前脂肪细胞中敲低SREBP1基因的表达,检测到PPP1R3C基因的表达也是下调的,提示PPP1R3C对脂肪生成的影响可能是通过3T3-L1中的SREBP1调控来实现的,进一步证实SREBP1是否通过结合到PPP1R3C基因的启动子上来调控其表达是必要的。
SREBPs自发现及命名以来,就被作为固醇类和脂肪酸合成中的重要转录调节因子来研究[20-23]。SREBP1在甘油三酯和脂肪酸合成方面的调控作用显著,由于SREBP1基因过度表达会导致非脂肪组织脂质沉积聚合,从而造成组织病变[24]。虽然有明确的证据表明SREBP1并非肥胖发育所必需的[25]。然而,显性抑制SREBP1的异位表达可减弱脂肪细胞的分化。此外,SREBP1过表达增强了PPARγ的活性[26],其他研究表明,SREBP1参与了PPARγ配体的产生[15,27]。总之,在体外的研究支持SREBP1在成脂中的作用,而体内研究表明SREBPs并非脂肪组织产生或扩展所必需,因此进一步的研究是必要的。
PTG基因敲除的小鼠肝糖原水平降低,肝脂质减少,mTORC1/SREBP1减少,而且通过RNA-seq对转录组进行分析,发现SREBP1和许多参与脂肪生成的靶基因显著下调。这些现象也许反映了PTG对 mTORC1/SREBP1和脂肪生成的反馈调节,从而介导糖原和脂质代谢之间的串话[14]。此外,在膀胱癌细胞中也发现了PPP1R3C与SREBP1的调控关系[28]。本研究初步证实在3T3-L1前脂肪细胞分化中SREBP1可能对PPP1R3C起到一定的调控作用。总之,本研究揭示了PPP1R3C对3T3-L1前脂肪细胞脂肪分化具有促进作用,而且发现敲低SREBP1基因的表达导致PPP1R3C基因下调表达,推测PPP1R3C可能受到SREBP1的调控,为进一步研究PPP1R3C在脂肪细胞分化及脂肪沉积中的分子机制提供了一定的基础。但在3T3-L1前脂肪细胞分化中, SREBP1对PPP1R3C的具体调控机制还需进一步的分析。
