儿童自身免疫性胶质纤维酸性蛋白星形胶质细胞病1 例报告并文献复习
2021-03-29黄海霞符跃强陈应富党红星
黄海霞 符跃强 白 科 周 昉 陈应富 党红星 李 静
重庆医科大学附属儿童医院重症医学科 儿童发育疾病研究教育部重点实验室 国家儿童健康与疾病临床医学研究中心 儿童发育重大疾病国家国际科技合作基地 儿科学重庆市重点实验室(重庆 400014)
胶质纤维酸性蛋白星形细胞病(glial fibrillary acidic protein astrocytopathy,GFAP-A)是一组累及脑膜、脑、脊髓和视神经的神经综合征,临床上常以发热、头痛、脑病、脊髓炎、视力异常等为主要表现。2016年美国梅奥医院首次报道[1],其后较多成人GFAP-A被报道[2-5],但儿童病例报道少,其临床特点有待进一步明确。本文报道1 例GFAP-A 患儿的临床资料,并进行文献复习,以探讨儿童GAFP-A 的临床特点。
1 临床资料
患儿,女,10岁2个月,因发热8天、意识障碍3天收入重庆医科大学附属儿童医院重症医学科。患儿于入院前8天出现发热,最高体温39.6 ℃,经口服退热药及感冒药仍反复发热。入院前3天,患儿诉头痛,能忍受,并出现嗜睡、幻觉。入院前2天因咳嗽、呼吸困难,于外院就诊住院。查血常规白细胞9.88×109/L,红细胞4.78×1012/L,血小板362×109/L,中性粒细胞61.4%,淋巴细胞28.5%,C反应蛋白(CRP)<0.5 mg/L;脑脊液白细胞60×106/L,淋巴细胞0.97,糖2.7 mmol/L,蛋白0.81 g/L,氯111.8 mmol/L。头颅、胸部CT平扫未见异常。外院诊断为病毒性脑炎、上呼吸道感染,予以静脉输注甘露醇降颅压,阿昔洛韦抗病毒,头孢曲松抗感染,病情无改善。入院前1天患儿出现尿储留,入院前8小时出现反应迟钝、氧饱和度下降至80%,予鼻导管吸氧后缓解,心率、血压无下降,转入重庆医科大学附属儿童医院急诊科。当时患儿昏迷状,呼吸浅表、不规则,血气分析示二氧化碳分压83 mmHg,血钠124 mmol/L,氧分压93 mmHg。予气管插管,并收入重症医学科。患儿G4P2,足月自然分娩,出生体质量3.0 kg,母亲孕期健康。患儿既往健康,生长发育同正常同龄儿;无自身免疫疾病及肿瘤家族史。
入院体格检查:营养好,体质量30 kg,镇静状态,面容未见异常,心肺腹无异常,颈抵抗阳性,双侧巴氏征阴性,肌力无法评估,肌张力不高。实验室检查:肝肾功能、心肌标志物、血氨、乳酸、抗心磷脂抗体、补体C 3、补体C 4 均无异常;血游离三碘甲状腺原氨酸2.53 pmol/L,抗甲状腺球蛋白抗体85.1 IU/mL,抗甲状腺过氧化物酶抗体63.9 IU/mL,游离甲状腺激素无异常。血培养、痰培养及脑脊液培养未见异常。血及脑脊液病原学检查(EB 病毒、单疱病毒、柯萨奇病毒、肠道病毒71、麻醉病毒、肺炎支原体、流感病毒)均阴性;结核干扰素阴性;抗核抗体1:100,抗SS-A抗体(+),抗Ro-52抗体(++),抗线粒体抗体M2型(+)。血及脑脊液血清水通道蛋白4(AQP4)抗体、抗髓鞘少突胶质细胞糖蛋白抗体(MOG)抗体、抗髓鞘碱性蛋白(MBP)抗体均为阴性。血及脑脊液自身免疫性周围神经病抗体阴性。血抗谷氨酸受体(NMDA型)抗体,抗谷氨酸受体(AMPA1、AMPA2型)抗体、抗富亮氨酸胶质瘤失活蛋白1(LGI 1)抗体、抗γ-氨基丁酸B型受体(GABAB)抗体、抗接触蛋白关联蛋白2(CASPR2)抗体为阴性,血免疫球蛋白G4无异常。胸片、肝胆胰脾超声未见异常。
患儿入院时有惊厥发作,表现为双目凝视,牙关紧闭、四肢肌张力增高,予以止惊处理后缓解,未再发作。即刻查血钠123 mmol/L,予补钠后复查血钠无异常。入院后患儿无发热,血常规白细胞10.54×109/L,红细胞4.22×1012/L,血小板403×109/L,中性粒细胞74%,淋巴细胞25%,CRP < 8 mg/L;脑脊液细胞总数136×106/L,淋巴细胞0.42,糖2.18 mmol/L,蛋白0.9 g/L,氯117.6 mmol/L。患儿予以呼吸机辅助呼吸;5%甘露醇5 mL/(kg·次),每6小时1次静脉输注;头孢唑肟50 mg/(kg·次),每天2次静脉输注抗感染。入院第3 天,患儿昏睡状态,咳嗽、吞咽反射弱,四肢肌力0 级。入院第6 天头颅MRI 示双侧基底节区、丘脑异常信号,见图1。脑电图示镇静状态下背景呈0.5~6.0 Hz混合活动,时见两侧前额区高幅δ活动。因考虑病毒性脑炎可能,予阿昔洛韦7 天抗病毒治疗;静脉滴注丙种球蛋白1 g/(kg·d),连续4天支持治疗;甲基泼尼松龙40 mg/d,每天1次抗炎治疗。患儿病情有所缓解,入院第10 天,患儿意识状态转为嗜睡,呼之能睁眼,能点头表达意愿,能听懂指令活动上肢,肌力较前好转,双上肢肌力3~4级,双下肢肌力1级。入院第21 天,脊髓MRI 示胸段部分脊膜及部分神经根线状强化,见图2。脑脊液及血液胶质纤维酸性蛋白IgG抗体(GFAP-immunoglobulin G,GFAP-IgG)均阳性。患儿诊断为自身免疫性GFAP-A。除外激素禁忌证后,予以静脉输注甲基泼尼松龙冲击治疗500 mg/d,连续3天;后改为口服醋酸泼尼松龙60 mg/d,qd。患儿病情较前改善明显。入院第28天,患儿呼吸机撤机成功。入院第30天,患儿转入神经内科普通病房。改为口服醋酸泼尼松片,25 mg/次,每12小时1次;后逐渐减至35 mg/次,qd。住院第62天出院,出院时神清,咳嗽、吞咽功能可,大小便无异常,肌张力无异常,双上肢肌力无异常,双下肢肌力Ⅲ级。
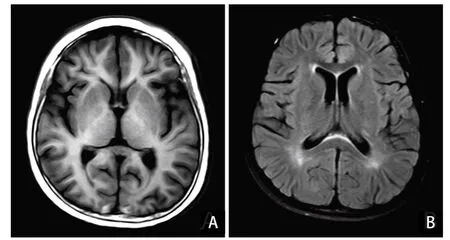
图1 患儿入院第6 天头颅MRI 表现
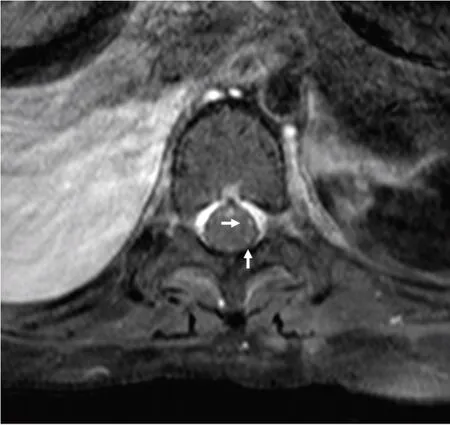
图2 患儿入院21 天脊髓MRI 表现
2 讨论
2016 年梅奥医学中心神经免疫实验室描述了一种新发现的中枢神经系统自身免疫性疾病,即GFAP-A,并指出GFAP-IgG可以作为其特异性生物标志物[1]。根据梅奥诊所发布的数据,GFAP-A的发病率并不低于抗NMDAR脑炎及AQP4阳性的视神经脊髓炎谱系疾病[5]。迄今为止,国际上已经有不同研究者对自身免疫性GFAP-A的报道,但大多为成人。
本例GFAP-A 为10 岁女性儿童,以发热起病,病程早期出现呼吸困难、尿储留,其后出现进行性意识障碍及惊厥,头痛不明显,病初考虑病毒性脑炎可能,给予抗感染治疗无效,且相关病原学检查未见异常,颅内感染证据不足。患儿病程中有幻视表现,脑脊液示细胞总数及蛋白增高,而糖及氯化物正常,考虑免疫性因素或脱髓鞘疾病可能,故征得家属同意后,经验性地予以丙种球蛋白及小剂量激素治疗,同时完善抗体及影像学检查。头颅MRI示双侧丘脑及基底节病变,脊髓平扫加增强示胸段部分脊膜及部分神经根线状强化,提示自身免疫性GFAP-A 可能。最终脑脊液及血清中均检测到GFAP-IgG得以确诊。
检索国内外文献,检索时间为建库至2020年3月,以“GFAP astrocytopathy”为“Keywords/Abstract”检索PubMed与Medline,以“自身免疫性胶质纤维酸性蛋白星形胶质细胞病”检索万方及维普数据库,仔细阅读文献后筛选出 7篇英文文献[4-10]、1篇中文文献[11],共18例血清或脑脊液GFAP-IgG阳性患儿,但文献中1例患儿无具体描述,4例患儿仅血清GFAP-IgG阳性,而脑脊液GFAP-IgG阴性,结合其临床表现、影像学结果,不符合GFAP-A诊断,故排除。余13例加本例患儿,共14例GFAP-A儿童患者。
14 例患儿中男性8 例、女性6 例,发病年龄为6~15 岁。其中1 例(7.1%)为单纯疱疹病毒性脑炎数月后出现精神病症状,13 例(92.8%)有脑膜脑炎症状,5例(35.7%)合并有脊髓炎症状,1例(7.1%)有视力模糊,提示儿童GFAP-A 最常见的临床表现为脑膜脑炎伴或不伴脊髓炎,与成人相似[1]。14例患儿中有13 例获得脑脊液标本。脑脊液检测显示,大多为炎性改变(11例,84.6%),蛋白水平升高,严重者>250 mg/dL,细胞总数也有不同程度的增高。GFAP-A患者MRI 显示为多发病灶,最常见的是沿中线结构分布T 2 加权像上高信号的病灶,增强后可见病灶强化[1,10]。而本组14例患儿中,10例MRI提示异常,其中最常见的是脑膜脊膜强化(7例50%),其次为脑实质或脊髓病灶强化(4例28.6%)。GFAP-A患者最特异性的MRI 改变为垂直于脑室的脑白质血管样放射强化,成人可见于40%~50%的患者[2],与之不同的是,本组14例患儿中仅1例(7.1%)显示脑室周围放射状强化。由于本组患儿数量过少,因此成人与儿童GFAP-A患者是否在影像学方面存在一定的差异仍需进一步研究。
约1/3的GFAP-A成人患者重叠其他自身免疫性疾病相关的抗体,包括NMADR 抗体、AQP 4 抗体及MOG抗体等[1,10]。在梅奥诊所报道的102例患者中,41例(40.2%)在血清或脑脊液中发现1种或多种其他共存抗体[5]。本组有4例(28.5%)GFAP-A患儿重叠其他免疫性疾病相关抗体,与成人患者接近。在本例患儿及另1例国内病例中,血抗核抗体、抗SS-A抗体或类风湿因子阳性,但无相关临床表现支持合并其他自身免疫性疾病[11]。另发现2 例患儿共存NMDA抗体;余10例未重叠其他自身免疫性疾病相关抗体[4]。此外,约1/3的成人患者合并肿瘤,如前列腺癌、畸胎瘤等。在梅奥诊所报道的102例患者中发现35例(34%)患有肿瘤;且在合并肿瘤的患者中66%是在症状发作的2年内发现[5]。本组14例患儿中只有3例提及肿瘤筛查但未见异常,其中1 例患儿随访1 年后肿瘤筛查仍为阴性。故确诊儿童GFAP-A 后,需要注意自身免疫性疾病及肿瘤疾病的筛查且至少需要超过2年的随访。
目前,GFAP-A 的标准治疗方案尚未制定。14 例GFAP-A 患儿大部分接受丙种球蛋白加激素的治疗,反应良好;病情改善不明显者,在行血浆置换治疗后好转。但仍有少数患儿对以上治疗反应差,需行免疫抑制剂治疗。有报道2例患儿应用利妥昔单抗疗效良好[4]。但也有报道1例患儿对丙种球蛋白加激素治疗反应差,继续每月行丙种球蛋白及口服激素、霉酚酸酯治疗,随访10 个月后,病情改善仍不明显[8]。本组14例GFAP-A患儿中,11例(78.6%)对一线免疫治疗有效,如甲基泼尼松龙、丙种球蛋白、血浆置换;2例(14.2%)对二线免疫治疗有效,如利妥昔单抗、霉酚酸酯等免疫抑制剂。总体儿童GFAP-A患者大多治疗效果好。另外,约20%~50%患者可能复发,需要长时间免疫抑制治疗,如长期口服糖皮质激素和免疫抑制剂(如霉酚酸酯、硫锉嘌呤、利妥昔单抗和环磷酰胺等)[2-5,10]。14 例患儿中,仅6 例有随访数据;其中2 例出院后仅接受口服激素治疗,2 例口服激素和利妥昔单抗治疗,1 例口服激素和霉酚酸酯治疗,1例无具体描述。随访时间为5~60个月,中位数为12个月,大多预后好。14例患儿中,13例(92.8%)未复发,仅1 例遗留神经精神症状。儿童GFAP-A 是否复发率偏低以及长期免疫抑制剂的使用方案,需要适当临床研究以评估。
综上所述,GFAP-A 是一种新型的神经系统免疫疾病。儿童患者以伴或不伴脊髓炎的脑膜脑炎为主要表现;MRI 示脑膜脊膜强化、多发高信号病灶、脑室周围放射状强化,或神经根强化;需在除外颅内感染的同时,完善脑脊液GFAP-IgG 检查以明确诊断。GFAP-A可用丙种球蛋白、激素冲击治疗,若改善不明显,可考虑使用血浆置换或免疫抑制剂,大多预后良好。另外,GFAP-A 患儿需要筛查并随访有无其他自身免疫性疾病或肿瘤性疾病,且至少2年。
