积极肠外营养支持方案在胎龄<34 周早产儿中的应用
2021-03-29申玉洁张先红李潇然匡安迪付利珍李禄全吴利平
申玉洁 张先红 李潇然 匡安迪 范 娟 付利珍 李禄全 吴利平
重庆医科大学附属儿童医院新生儿诊治中心 儿童发育疾病研究教育部重点实验室 国家儿童健康与疾病临床医学研究中心 儿科学重庆市重点实验室 儿童发育重大疾病国家国际科技合作基地(重庆 400014)
最新的多中心调查表明宫外发育迟缓(extrauterine growth retardation,EUGR)是当前早产儿管理中面临的突出问题。EUGR 不仅增加院内感染、坏死性小肠结肠炎、晚发性败血症患病率,且延长住院时间,病死率也明显增加。同时,EUGR 增加神经系统发育不良甚至脑性瘫痪的风险,严重影响其生存质量[1-4]。早期营养支持是改善EUGR 发生的重要方法。2006 年中华医学会儿科分会新生儿学组颁布中国新生儿营养支持临床应用指南[5]。早产儿人群氨基酸初始量为1 g/(kg·d),增加速度为0.5 g/(kg·d),最大量3.0g/(kg·d);脂肪乳初始量为0.5~1.0 g/(kg·d),增加速度为0.5 g/(kg·d),最大量3.0 g/(kg·d)。2013年修订并颁布新的指南[6]。早产儿人群氨基酸初始量为1.5~2.0 g/(kg·d),最大量3.5~4.0 g/(kg·d);脂肪乳初始量为1.0 g/(kg·d),最大量3.0 g/(kg·d)。但两次国内多中心调查表明早产儿人群生后早期营养状况改善并不明显,2009 年的多中心调查表明EUGR 发生率为56.8%[7]。2015年的全国多中心调查也表明271例出生体质量>P10的早产儿中有74.1%出院时体质量低于P10,其中36.4%<P3;而 301例出生体质量<P10的患儿在出院时仍有高达 96.0%在出院时其体质量仍<P10[8]。这提示相当部分的早产儿在住院期间未能改善其营养状态。
近年研究表明,早产儿可耐受生后24 小时内即给予高剂量氨基酸3 g/(kg·d)[9-11]。包含7项随机对照试验的meta分析表明,在生后24小时内低出生体质量儿即可耐受高剂量氨基酸,初始剂量分别为3 g/(kg·d),最大剂量均为4 g/(kg·d),仅有血尿素氮(BUN)一过性轻微增高,但自行恢复正常,无需调整营养支持策略[12]。此剂量在国内胎龄<34 周早产儿的疗效以及耐受情况未见报道。
本研究拟通过前瞻性随机对照方法,探讨胎龄<34周早产儿生后早期静脉应用不同剂量氨基酸、脂肪乳的近期疗效,明确其安全性及有效性,为此类特殊患儿早期输注氨基酸和脂肪乳的适宜剂量提供依据,以改善患儿预后。
1 对象与方法
1.1 研究对象
纳入重庆医科大学附属儿童医院2019 年5 月至2019年12月收治的胎龄<34周,生后24小时内入院的新生早产儿为研究对象。除外疑诊或确诊消化道畸形者、肝肾功能异常暂不宜实施肠外营养支持者、严重窒息无法开奶者、肠外营养支持期间死亡者、家长不同意参加本研究者。
本研究获得重庆医科大学附属儿童医院临床试验伦理委员会批准。
1.2 方法
1.2.1 营养支持方案及分组 入组新生儿均给予尽早开奶,奶量增加按照2013 年中华医学会肠外肠内营养学分会儿科学组制定标准执行。总热卡维持在130~150 kcal/(kg·d),随奶量增加,逐步减少肠外营养支持直至完全实施肠道内营养。①积极肠外营养组:氨基酸自2.5 g/(kg·d)开始,逐日增加1.0 g/(kg·d),到达4 g/(kg·d)并维持;脂肪乳自2.0 g/(kg·d)开始应用,次日3g/(kg·d),第3天达3.5 g/(kg·d)并维持。②常规肠外营养组:参照2013年制定的中国新生儿营养支持临床应用指南执行[6],氨基酸自2 g/(kg·d)开始,逐日增加0.5 g/(kg·d),总量不超过4 g/(kg·d);脂肪乳从1 g/(kg·d)开始,总量不超过3g/(kg·d)并维持。同时,按照胎龄分为<32周及32~34周早产儿亚组进行分析。
1.2.2 体格生长指标 观察生后第1周至第4周患儿的体质量、身长以及头围的增长情况。每周由管床医护人员对患儿进行头围、身长以及体质量的测量。
1.2.3 临床资料收集 记录两组早产儿的肠外营养时间、住院时间、全肠道喂养时日龄、呼吸机支持时间、用氧时间、抗生素使用时间、住院结局等情况。收集观察入组患儿入院24小时,第1周,第2周,第3~4周,第5~6周的谷氨酸氨基转移酶、血尿素氮、肌酐、尿酸等指标。收集两组患儿肠外营养相关并发症或合并症,包括败血症、呼吸暂停、坏死性小肠结肠炎、肺出血、乳糖不耐受、新生儿高血糖、新生儿低血糖、高钾血症、低钾血症、高氯血症、低镁血症等发生情况。
1.3 统计学分析
采用 SPSS 22.0 统计软件进行数据处理。符合正态分布的计量资料以均数±标准差表示,两组间比较采用两独立样本t检验;非正态分布计量资料以中位数(四分位数间距)表示,组间比较采用秩和检验。计数资料以例数(百分比)表示,组间比较采用χ2、校正χ2检验或Fisher精确概率法检验。以P<0.05为差异有统计学意义。
2 结果
2.1 一般资料
最终纳入138例早产儿,其中男72例、女66例;双胎51例,三胎5例;出生胎龄25+3~33+6周,出生体质量 770~1 980 g。其中胎龄<32周患儿93例,32~34周患儿45例。积极静脉营养和常规肠外营养组患儿入院时胎龄、性别、出生体质量、身长及头围、小于胎龄儿、羊水污染、胎膜早破、母亲妊娠期高血压综合征(妊高征)、母亲糖尿病、产前使用糖皮质激素、胎胎输血综合征、房间隔缺损、室间隔缺损、动脉导管未闭等方面比较差异均无统计学意义(P均>0.05)。见表1。
2.2 两组患儿体格增长情况比较
两组胎龄<34周早产儿体质量增长值在生后第1、2、3周的差异均有统计学意义(P均<0.05),积极肠外营养组体质量增长显著高于常规肠外营养组。生后第1、2、3周两组患儿的其余指标包括身长、头围差异均无统计学意义(P均>0.05)。
<32周早产儿积极肠外营养组生后第1、2周体质量增长值,生后第2周身长增长值均高于常规肠外营养组,差异有统计学意义(P均<0.05)。32~34周组早产儿常规肠外营养组在生后第3、4周身长增长值高于积极肠外营养组,差异有统计学意义(P均<0.05)。见表2、3。
2.3 两组患儿临床疗效比较
积极肠外营养组患儿肠外营养时间和达到全肠道喂养日龄均低于常规肠外营养组(P<0.05)。两组患儿肠外营养用氧时间、呼吸机支持时间、抗生素使用时间、开始喂养时日龄、住院时间、住院结局、肠外营养液蛋白能量比值等方面比较差异均无统计学意义(P均>0.05)。见表4。
<32 周早产儿组积极肠外营养组的肠外营养时间为31.50(24.00~44.25)d,常规肠外营养组为47.00(35.00~53.00)d,差异有统计学意义(Z=3.48,P<0.001);<32周早产儿组积极肠外营养组达到全肠道喂养日龄为35.00(25.75~50.00)d,常规肠外营养组为50.00(36.00~60.00)d,差异有统计学意义(Z=3.04,P=0.002)。
2.4 两组患儿实验室检查指标比较
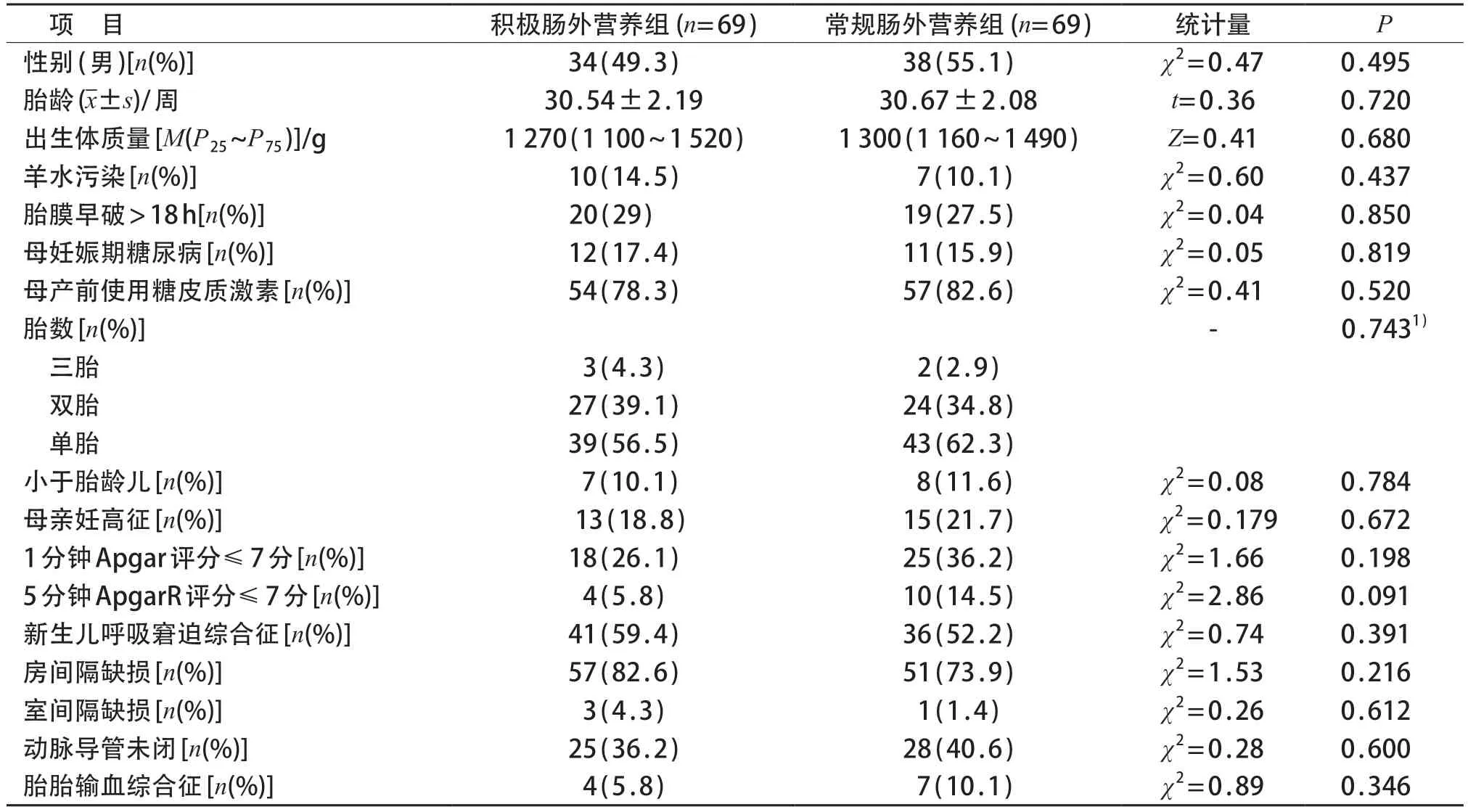
表1 积极肠外营养组与常规肠外营养组基线资料比较
表2 两组患儿第1、2周体质量、身长、头围增长值比较[,M(P25~P75)]
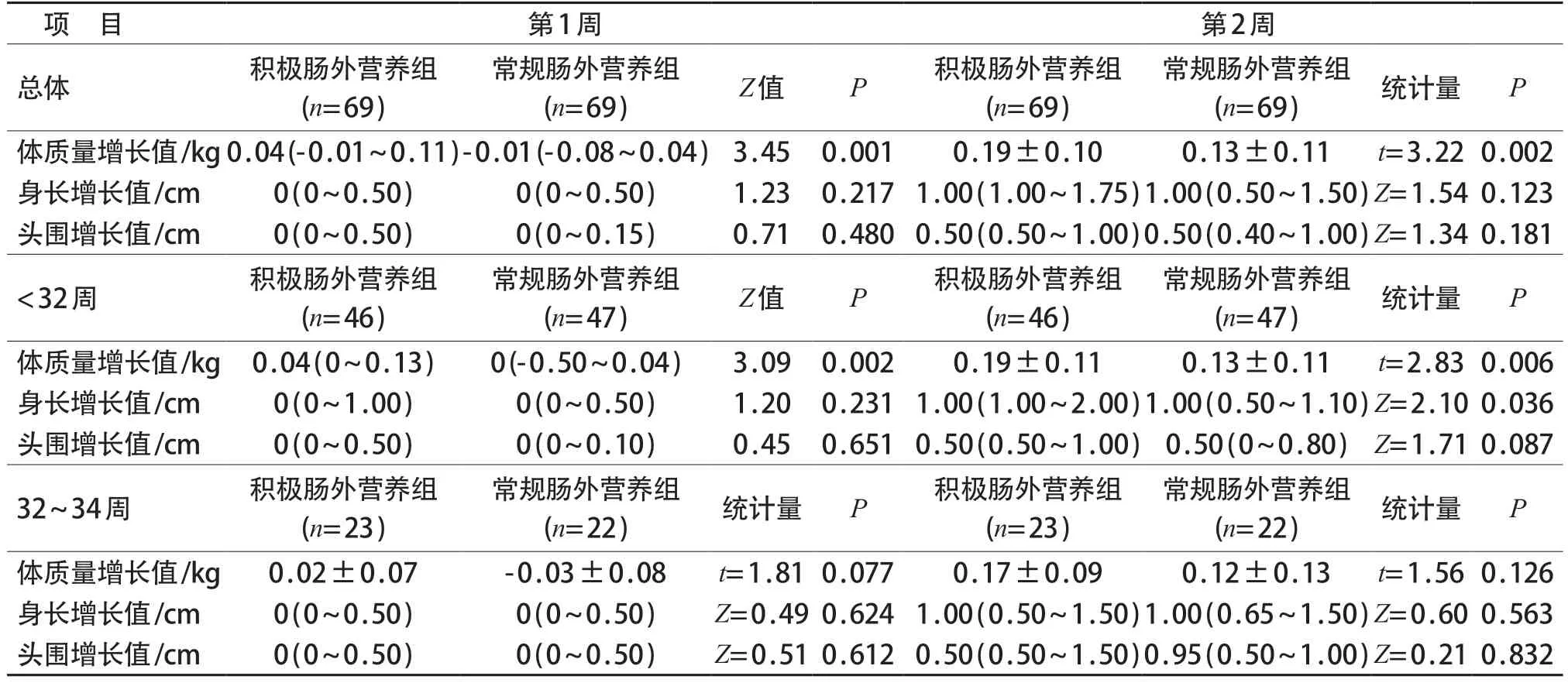
表2 两组患儿第1、2周体质量、身长、头围增长值比较[,M(P25~P75)]
表3 两组患儿第3、4周体质量、身长、头围增长值比较[,M(P25~P75)]
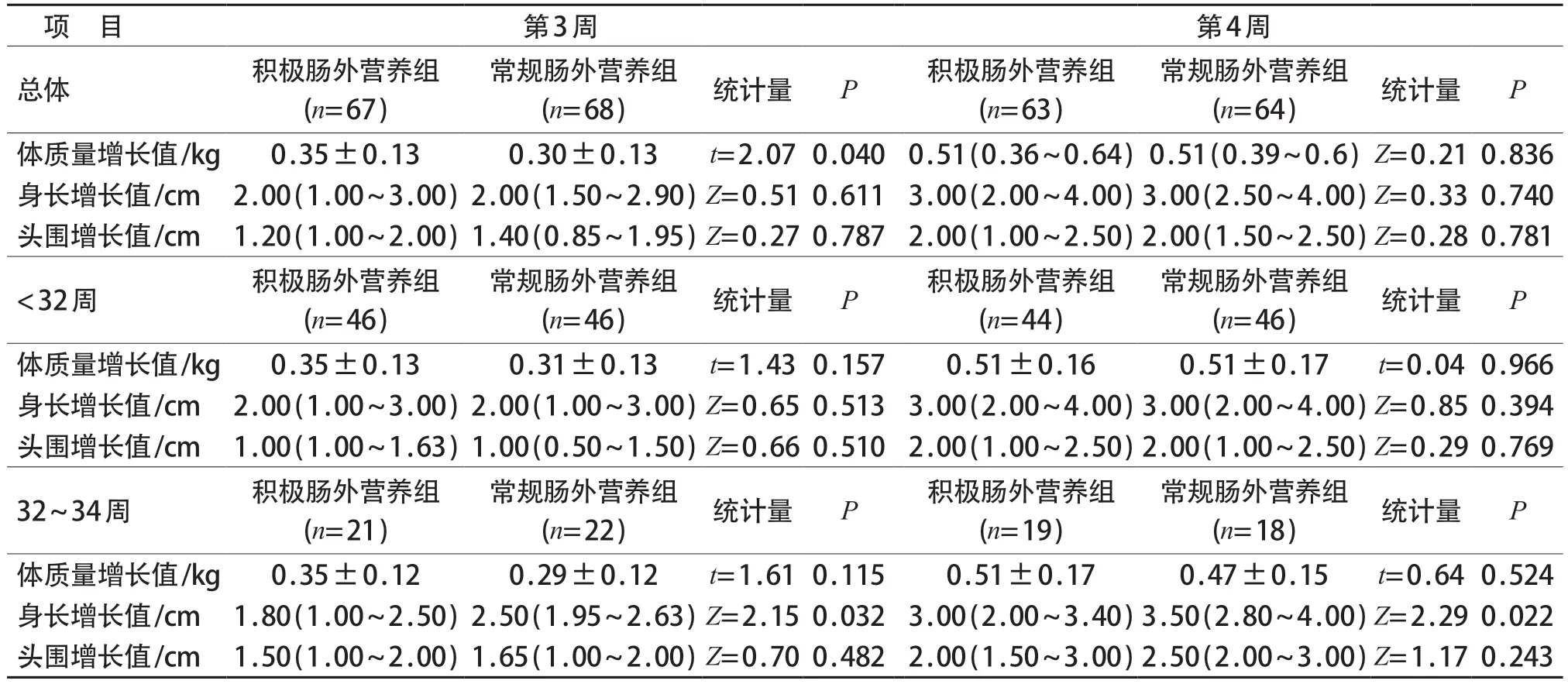
表3 两组患儿第3、4周体质量、身长、头围增长值比较[,M(P25~P75)]
表4 两组患儿肠外营养临床疗效比较[,M(P25~P75)]
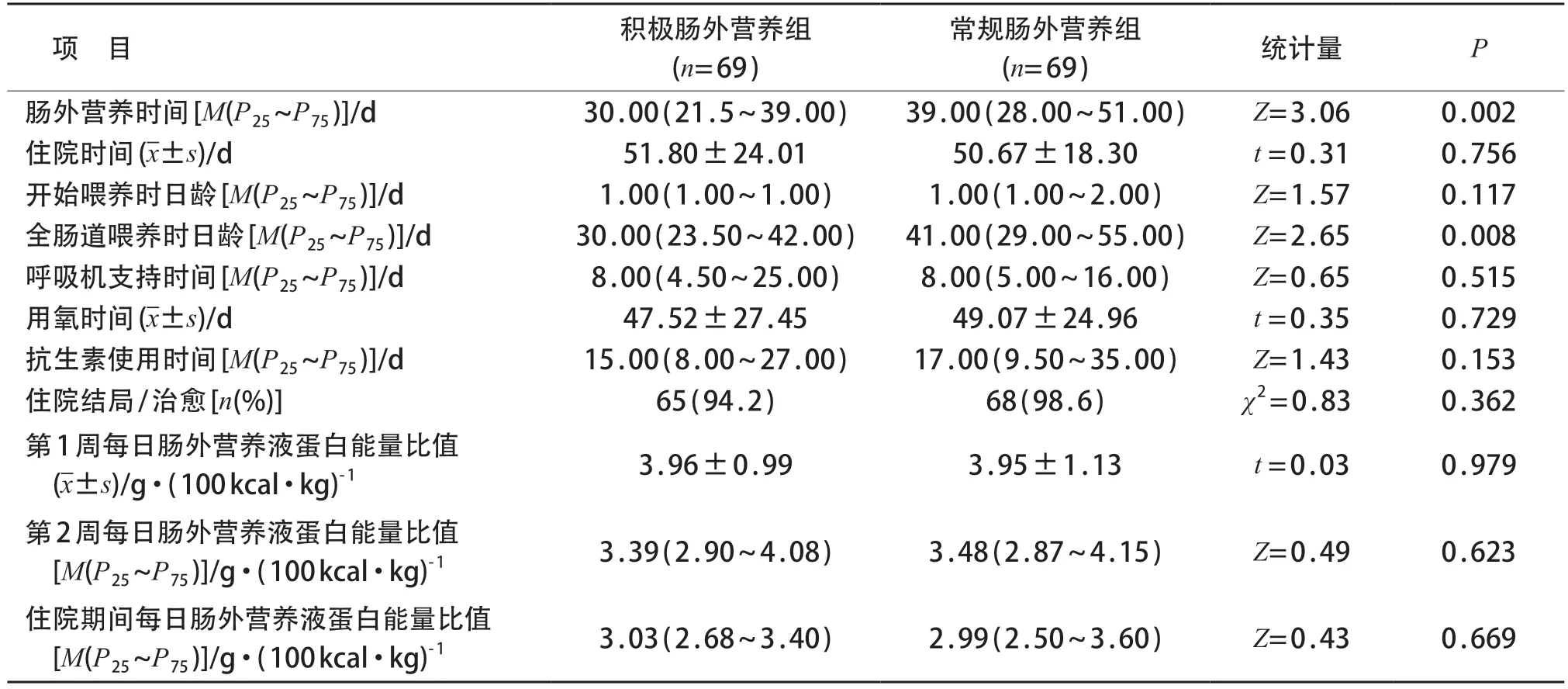
表4 两组患儿肠外营养临床疗效比较[,M(P25~P75)]
生后24小时,常规肠外营养组的血尿素氮(BUN)水平为4.68(3.44~6.00)mmol/L,积极肠外营养组为3.71(2.90~4.78)mmol/L,两组间差异有统计学意义(Z=3.02,P=0.003)。生后第2周,常规肠外营养组的丙氨酸氨基转移酶(ALT)水平为7.40(4.45~16.80)U/L,积极肠外营养组为5.00(3.20~9.63)U/L,两组间差异有统计学意义(Z=2.32,P=0.021)。除此之外的BUN和ALT在生后第1~6周的两组间差异均无统计学意义(P均>0.05)。肌酐(Cr)、尿酸(UA)在生后第1~6周的两组间差异均无统计学意义(P均>0.05)。
2.5 两组患儿肠外营养严重并发症和合并症比较
积极肠外营养组乳糖不耐受、呼吸暂停、低镁血症的发生率低于常规肠外营养组(P均<0.05),其余指标差异均无统计学意义(P>0.05)。见表5。
<32 周早产儿积极肠外营养组高胆红素血症44例(95.7%),高于常规肠外营养组(37例,78.7%),差异有统计学意义(χ2=5.93,P=0.015)。
3 讨论
早产儿消化系统发育不成熟、消化酶活性低,能量摄入有限,每天丢失的蛋白质在(0.6~1.0)g/kg,从而处于负氮平衡,影响体质量增长[13],因此成为EUGR 高发群体。目前国内外就早期给予肠外营养支持以满足早产儿生长需要,减少EUGR 的发生率已达成共识。但对于肠外营养主要能量来源,特别是氨基酸和脂肪初始剂量和饱和剂量仍存在较大差异。2004年美国早产儿早期营养方案中推荐在生后1天开始给予每日3.0 g/kg氨基酸,每日增加 0.5~1.0 g/kg,最终达到目标剂量4.0 g/(kg·d)[14]。近年国外研究表明,早产儿生后24 小时内完全可以耐受初始高剂量脂肪乳3 g/(kg·d)[10-11,15-16]。而国内大多因考虑高氨基酸摄入会导致代谢性酸中毒、高氨血症、肾功不全等并发症[13],在氨基酸和脂肪乳剂量的选择方面相对保守和谨慎。研究表明,肠外营养支持中初始给予常规剂量氨基酸及脂肪乳导致较高的EUGR患病率[17]。
近年来国内研究表明,早产儿可耐受生后24小时内即给予高剂量氨基酸3 g/(kg·d)[9-11]。因此本研究对胎龄<34 周早产儿的氨基酸和脂肪乳剂量进行有效性及安全性的研究。本研究在积极营养支持方案(即生后24小时内便给予高剂量的氨基酸和脂肪乳)对胎龄<34周早产儿的有效性得到较好验证,总体上生后3周体质量增长方面具有显著优势。积极肠外营养组第1周生理性体质量下降越小,能以较快速度恢复出生时体质量至出现体质量增长,而第2、3周体质量增长速度明显快于常规肠外营养组。亚组分析表明,对于胎龄<32周早产儿其体质量增长优势更为显著。而身长增长方面,总体无显著性差异,但在亚组呈现不同趋势增长,可能与测量误差和样本量较少有关。而在临床疗效方面,积极肠外营养可缩短肠外营养使用时间,更快达到全胃肠道喂养目标,在胎龄<32周组早产儿中得到更好的体现。
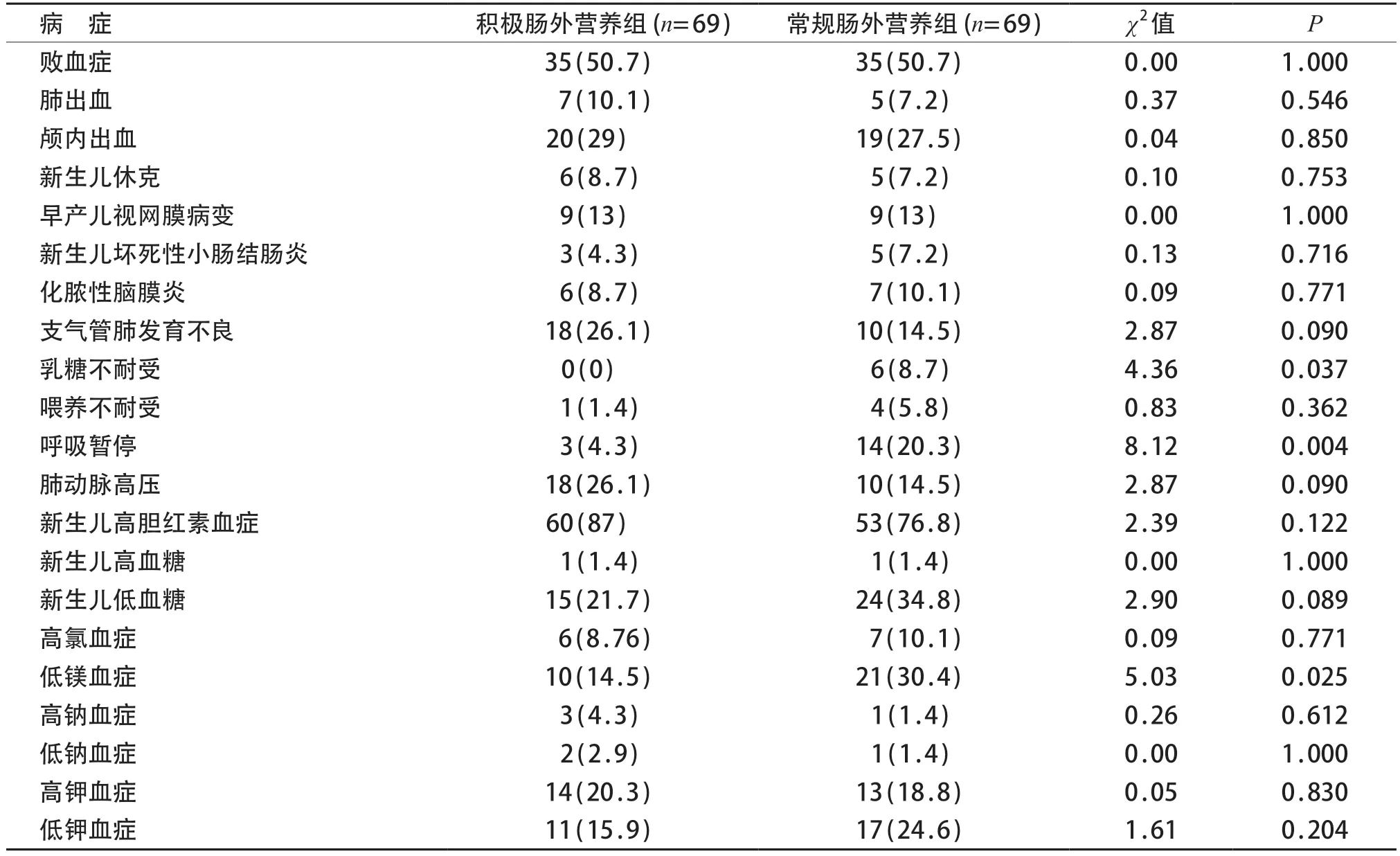
表5 两组患儿肠外营养严重并发症和合并症比较[n(%)]
而在积极静脉高营养的安全性方面,高剂量氨基酸和脂肪乳并未增加胎龄<34 周早产儿败血症、肺出血、颅内出血、新生儿休克、早产儿视网膜病变、新生儿坏死性小肠结肠炎、肾功能损害等相关并发症的发生率。同时各项内环境相关指标也显示与常规剂量组相比,高剂量的氨基酸和脂肪乳并未明显增加胎龄<34周早产儿的内环境紊乱。同时积极肠外营养组乳糖不耐受发生率较低可能与肠内营养及早建立有关,同时呼吸暂停发生率在积极肠外营养组也更低。而<32 周胎龄新生儿高胆红素血症的发生率高于常规营养组可能与样本量较少有关。
因此,本研究证实积极肠外营养对于胎龄<34周早产儿在近期疗效和耐受性方面的积极作用。积极肠外营养不仅缩短胎龄<34 周早产儿(尤其是早期早产儿)肠外营养使用时间、全肠道喂养日龄,还能较好地促进生后早期体质量增长,且未增加并发症的发生率。但本研究样本量偏小且为单中心研究,有待进一步增加样本量,即开展多中心研究进一步验证。同时除了近期疗效以外,积极肠外营养对其远期神经系统发育是否具有积极影响,也值得继续探索和研究。
