TH 基因变异致婴儿多巴反应性肌张力障碍4 例临床和基因分析
2021-03-29胡恕香黄燕茹蔡慧强李文洁彭桂兰
胡恕香 黄燕茹 李 培 蔡慧强 李文洁 彭桂兰
厦门大学附属妇女儿童医院 1.儿童神经康复科,2.中心实验室 (福建厦门 361003)
关健词:Segawa病;多巴胺;肌张力障碍;TH基因
多巴反应性肌张力障碍(dopa-responsive dystonia,DRD)是一组临床表现及基因表型均具有异质性的遗传病,其主要特征为肢体起病、具有日间波动性的肌张力障碍,对多巴胺治疗反应良好[1]。由三磷酸鸟苷环化水解酶l(guanosine triphosphate cyclohydrolase 1,GCH1)基因变异导致的Segawa病最为常见。酪氨酸羟化酶(tyrosine hvdroxvlase,TH)基因变异、墨蝶呤还原酶(sepiapterin reductase,SPR)基因变异等均可导致DRD[2-3]。
DRD 通常在婴儿期至12 岁间发病,平均发病年龄6 岁。但早期,尤其是婴幼儿期由于症状不典型易被误诊为脑瘫、发育迟缓及其他类型的肌张力障碍,导致延误疾病治疗,经受各种过度的长期康复治疗,甚至遗留明显的后遗症[4]。目前相关文献中绝大多数病例为成人、儿童或幼儿。本文报告4 例婴儿期起病并获得诊断的DRD,分析其临床、遗传特点以及治疗和预后。
1 临床资料
例1,男,3 个月23 天,因不会抬头入院。患儿入院时不会抬头,伴异常姿势,表现为双上肢持续后伸、喜握拳、头后仰,紧张激动时喜过度用力;追视、追声差;偶有发作性动眼危象,表现为双眼球向内或偏向一侧,持续数秒到半小时不等。出生史无特殊。无类似家族史。入院体格检查:头围40 cm,体质量5.5 kg,神志清,心、肺、腹无明显异常;兴奋时肌张力增高、安静时肌张力正常或降低,握持反射、侧弯反射阳性;膝腱反射强阳性,踝阵挛阳性,双侧巴氏征阴性、克氏征阴性,布氏征阴性。
例2,男,6个月28天,以发现运动发育落后4个月入院。入院前4个月,患儿肢体自主动作逐渐减少、无力渐加重。患儿入院时抬头不稳,不会翻身,头易后仰;追视、追声可。出生史无特殊。无类似家族史。入院体格检查:头围42.5 cm,神清,心肺腹无明显异常;肌张力障碍,膝腱反射阳性,病理反射未引出。
例3,女,6个月3天,以发现运动发育落后3个月入院。临床表现与例2相似。
例4,男,11月龄,以运动倒退4个月入院。患儿7月龄前生长发育与同龄儿相似,7月龄时已独坐稳。入院前4 个月,患儿肢体自主动作逐渐减少、无力渐加重,入院时已全身松软、不能抬头、手口不协调,上脸下垂,每次睡醒后症状略减轻,随活动时间延长,无力有所加重;应人应物能力可。出生史无特殊。无类似家族史。入院体格检查:头围46.5 cm,神清,心、肺、腹无明显异常;肌张力障碍,膝腱反射阳性,踝阵挛阴性,双侧巴氏征阴性、克氏征阴性,布氏征阴性。
4 例患儿的血生化、血氨、血乳酸、血串联质谱、尿气相质谱、常规染色体检查均无异常。脑干诱发电位、视频脑电图均无异常。例1 发作性动眼危象时的同期脑电图示背景正常,未见癫痫波。4例患儿首次头颅磁共振成像(MRI)仅表现为脑室稍扩大、脑外间隙略增宽。
为明确病因,经医院伦理委员会审批,并取得家长知情同意后采集患儿的血液标本进行全外显子测序,余家系成员作一代验证。采用QIAamp DNA 提取试剂盒(QIAGEN 公司)抽提基因组DNA,提取的DNA用Covairs 进行机械打断并进行末端修复和A碱基的添加,随后进行PCR 扩增并连接上接头序列,经Agencourt AMPure XP beads进行2次纯化,纯化后产物经过PCR扩增及2次纯化后获得的最终文库,对文库进行定量后,进行杂交、捕获及纯化。混合文库后在Novaseq 6000测序仪(Illumina Inc,USA)上对基因组外显子区域进行测序。对可疑候选突变的位点设计PCR引物进行扩增及进行Sanger测序验证。
基因检测结果显示,例1的TH变异位点c.457C>T遗传自父亲,导致编码该蛋白的第153 位氨基酸由精氨酸变为终止密码子,可能造成蛋白提前截短;c.1196C>T遗传自母亲,导致编码该蛋白的第399位氨基酸由苏氨酸变为甲硫氨酸;HGMD 中均已有收录,根据ACMG 变异致病性判读指南,均为致病性变异。例2患儿TH变异位点c.698G>A遗传自父亲,导致编码该蛋白的第233 位氨基酸由精氨酸变为组氨酸;c.1293+5 G>C 遗传自母亲,预计会引起剪接位点发生改变,使所编码的蛋白质发生紊乱而丧失其正常功能;HGMD 中均已有收录,均为致病性变异。例3患儿TH变异位点c.690C>A遗传自母亲,导致编码该蛋白的第230位氨基酸由酪氨酸变为终止密码子,可能导致蛋白提前截短;HGMD 中未见收录,根据ACMG 指南为致病性变异;c.880 G>C 遗传自父亲,导致编码该蛋白的第294位氨基酸由甘氨酸变为精氨酸,HGMD中已收录,为致病性变异。例4患儿TH变异位点c.739G>A遗传自父亲,导致编码该蛋白的第247位氨基酸由甘氨酸变异丝氨酸;c.1293+5G>C遗传自母亲,同例2;HGMD中均已有收录,均为致病性变异。见图1。最终4例患儿均确诊为DRD。
患儿确诊后均予多巴丝肼片(每片含左旋多巴200 mg,苄丝肼50 mg)口服,初始剂量为每天25 mg,分3~4次,渐加量,即使缓慢加量,每周加12.5~25 mg,仍容易出现易动症,表现为肢体无目的乱动、扭动,伴或不伴张嘴伸舌。因家长担心不良反应,依从性欠佳,故前4个月加量缓慢。服药2周左右,患儿追视、追声反应渐灵敏,每天总量达到125 mg时,逐渐出现眼手口协调动作,抬头、扶坐、扶站等抗重力运动慢慢改善,易动症渐消失。例1用药1个月后动眼危象消失。例1、2、3目前每天总量250 mg,分4次口服。例1、例2已正常上幼儿园,例3运动协调能力略差于同龄儿,例3 在19.8 个月时行0~6 岁小儿神经心理测试:大运动发育商(DQ)61,精细运动DQ 68,适应能力DQ 68,语言DQ 83,社会行为DQ 61,总DQ 68。例4服药第3 天即见效,出现眼手口动作,随访到1 岁6 个月,多巴丝肼用量12 mg/(kg·d),激动时仍有轻微肌张力障碍表现,如左足稍外翻、左上肢稍后伸,继续缓慢加量中。例1、例2、例3于2周岁时复查MRI均无异常。
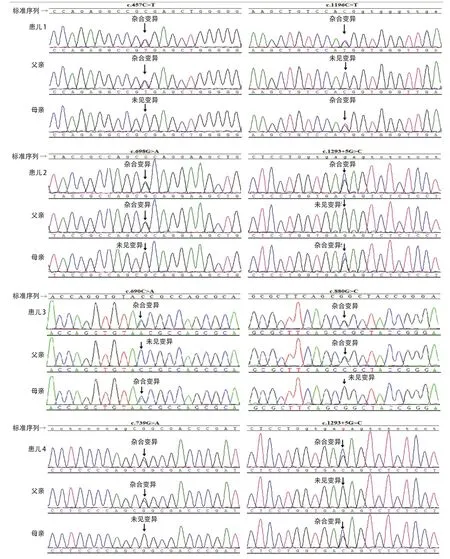
图1 4 例患儿基因测序图
2 讨论
DRD 主要表现为症状波动性的进行性肌张力障碍,但其表型谱广泛,许多患者临床表现不典型,尤其是婴儿,给诊断带来一定困难。1998年,DRD被分为两型:经典型DRD和DRD附加症(DRD-plus)。经典型DRD常在10岁内发病,女性多于男性。患儿智力正常,常以双下肢姿势性肌张力障碍为首发症状,有左侧优先受累倾向,可有痉挛性斜颈及帕金森样表现。DRD-plus 型涵盖了具有各种不典型症状的DRD[5]。DRD-plus在起病年龄、运动系统症状及非运动系统症状方面均具有不典型性,患儿可早至婴儿期起病,病情重,具有类似于中枢性瘫的体征,如肌张力障碍导致的假性巴彬斯基征,肌张力低下显著,可有咀嚼、吞咽、构音障碍,发育显著落后,可有动眼危象,上睑下垂、刻板样动作、惊厥(全面性强直-阵挛发作或肌阵挛发作),不伴感染的反复高热等。相同的基因变异可引起不同的表型,目前认为与酶缺乏程度有关[6]。本组4 例患儿均于婴儿期起病,前3 例无昼夜波动的进行性肌张力障碍,初期仅肌张力低下,渐出现肌张力障碍表现,因小婴儿对肌张力的测查不配合,临床判断有一定的困难。本组患儿的临床表现均为全面性发育落后,大运动发育落后显著;例4 略有昼夜波动的规律,但不典型,主要表现为运动发育倒退,左侧受累重于右侧;例1 存在动眼危象,表现为眼球固定偏向一侧或均向内侧,持续数秒到半小时不等,但同期脑电图未见癫痫波。本组4例患儿随访至今均无癫痫及反复高热表现。
参与多巴胺合成及循环的多个酶缺陷都可引起经典型DRD 或DRD-plus 型,其编码基因包括GCH 1基因、TH基因、PTS基因(编码6-丙酮四氢生物蝶呤合成酶),SPR基因(编码墨蝶呤还原酶),PCBD基因(编码蝶呤-4 ɑ-甲胺醇脱氢酶),QDPR基因(编码二氢蝶呤还原酶)等[7-8]。本组4例患儿均为TH基因复合杂合变异。
TH基因定位于11p55,包含14个外显子,其变异导致的DRD 呈常染色体隐性遗传。TH基因编码的酪氨酸羟化酶可将酪氨酸转换为多巴胺,参与多巴胺合成。而多巴胺可进一步代谢成高香草酸及3-甲基-4-羟基苯氧乙醇,多巴胺合成减少进一步导致脑脊液中高香草酸及3-甲基-4 羟基苯氧乙醇浓度降低,而酪氨酸和5-羟吲哚乙酸浓度正常。另外,酪氨酸羟化酶还是儿茶酚胺类神经递质合成的限速酶[9],故该酶缺陷可导致广泛性神经功能异常,引起以下临床表现:①进展性婴幼儿脑病,表现为运动发育落后,波动性锥体外系症状,动眼危象及植物神经症状,左旋多巴可减轻上述症状,但不一定能完全缓解;②左旋多巴反应性婴幼儿帕金森病,表现为婴幼儿期起病的严重运动障碍,如帕金森样症状、非癫痫性肌阵挛发作以及上睑下垂,左旋多巴对帕金森样症状效果显著,而2.5%的去氧肾上腺素眼部应用后可使上睑下垂明显好转;③经典型DRD[6-7,10-12]。前两型归类于DRDplus型。本组患儿均为DRD-plus型,例1存在动眼危象,例4上眼睑下垂,对多巴丝肼治疗均效果显著。
治疗上,小剂量左旋多巴1~5 mg/(kg·d)对于DRD治疗有显著稳定的效果,尤其对于肌张力障碍效果显著,但对于DRD-plus型的非运动系统临床表现效果欠佳[13]。在确诊的DRD 患儿中多巴胺最大剂量为20 mg/(kg·d)[14]。推荐在服用多巴胺的同时服用多巴胺脱羧酶抑制剂。本组4例患儿均从0.2 mg/(kg·d)左右开始服用多巴丝肼治疗,加量过程中,恶心等不良反应不明显,加量到3周左右,均出现张嘴、肢体乱动等异动症,影响家长信心,对临床用药量的精准判断困难,肌张力障碍改善慢,但经过4个月左右适应,异动渐消失,临床根据肌张力障碍表现继续加量,目前恢复到正常运动水平的患儿均用量达20~25 mg/(kg·d),如有漏服2次,即可表现无力症状,呈现明显的依赖性。文献报道,随年龄增加,DRD 患者对左旋多巴的依赖性减少[14]。本组患儿对左旋多巴的依赖性有待进一步随诊观察。
总之,DRD 虽属罕见病,但针对基因变异及发病机制的小剂量多巴胺靶向治疗效果好,早诊断、早治疗是关键。儿科医师尤其是神经康复科医师针对全面发育落后婴儿需警惕该病,仔细测查肌张力,如存在肌张力障碍表现,尽早给予遗传学检测便于早期识别该病,避免延误诊断及过度的康复干预,甚至遗留后遗症。
