马鲛鱼中精氨酸脱羧酶的基因克隆及生物信息学分析
2021-03-27哈斯周家民韩玲钰邹宇马堃李婷婷
哈斯,周家民,韩玲钰,邹宇,马堃,李婷婷
(大连民族大学生命科学学院,辽宁大连 116600)
由于水产品的开发利用相对较低,其容易在微生物的作用下腐败变质,而马鲛鱼(Scomberomorus niphonius)是一种容易在腐败变质后发生生物胺中毒的鱼[1]。马鲛鱼具有分布较广、产量较高、生长较快等特点,已经在东北地区成为一种主要的经济鱼类[2,3]。生物胺(Biogenic amines,BAs)是一类低分子质量含氮有机化合物,广泛存在于富含蛋白质和氨基酸的食物中,大多可由具有脱羧酶活性的微生物将氨基酸分解生成[4]。生物胺根据结构可划分为芳香族胺、脂肪族胺和杂环族胺;根据组成可分为单胺和多胺。生物胺产生主要有两种方式,一种是游离的氨基酸经微生物的脱羧作用,另一种则通过氨基酸脱羧酶脱羧作用[5]。水产品在运输和贮藏的过程中十分容易受到微生物的污染而产生大量的生物胺,由于其含有大量的氨基酸和蛋白质。一部分微生物可以通过控制氨基酸脱羧酶,产生相应的代谢物质来促进生物胺的产生,从而导致水产品的腐败变质,在水产品中分离得到的肠杆菌科、气单胞菌属、假单胞菌属、弧菌属、梭菌属、肺炎克雷伯氏杆菌、链球菌属、埃希氏菌属、变形杆菌属等多种微生物种群都可以产生生物胺[6]。含有高浓度生物胺的食物可能是鱼类,鱼类衍生物和发酵产品[7]。适量的生物胺可维持正常的生理代谢,但过量的生物胺会使人体中毒并引起严重的反应,如头痛、血压变化、呼吸系统疾病、心悸等[8,9]。因此如何抑制生物胺的产生成为越来越重要的研究问题同时也受到了越来越多人的关注。
通常认为,生物胺的形成能力似乎与菌株有关,而不是特定物种[10]。肠杆菌科细菌显示出通过精氨酸脱羧分别产生多胺,特别是腐胺的强大能力[11]。大肠杆菌中腐胺的合成涉及精氨酸脱羧酶将精氨酸脱羧生成胍丁胺,然后将其通过胍丁胺尿素水解酶水解,或通过精氨酸脱羧酶水解精氨酸[12]。在之前的工作中,发现马鲛鱼体内含有大量腐胺。通过16s rRNA 鉴定的来自马鲛鱼的菌株为霍氏肠杆菌。因此,在这项研究中,通过聚合酶链式反应(PCR)克隆和表达了来自霍氏肠杆菌中精氨酸脱羧酶基因(ADC),还对其进行了一系列的生物信息学分析,为后续的深入研究提供参考。今后在基因克隆的基础上,将进行蛋白质的表达、分离纯化和性质研究,进一步解析精氨酸脱羧酶。
1 材料和方法
1.1 材料
马鲛鱼,购置于大连乐购冷鲜超市冷库;霍氏肠杆菌Ho-01(分离于马鲛鱼体内)LB 培养基,北京索莱宝生物科技公司;PrimeSTAR® Max DNA Polymerase 高保真酶试剂盒,大连Takara 公司;50×TAE 缓冲液、异丙基硫代半乳糖苷(IPTG)、X-Gal、氨苄青霉素,北京索莱宝生物科技公司;Mighty TA-cloning Reagent Set for PrimeSTAR®试剂盒,大连Takara 公司;TIANprep Mini Plasmid Kit 质粒小提试剂盒,大连Takara 公司;pMD20-T vector 克隆载体、E. coli JM109 Competent Cells,大连Takara 公司;溴化乙锭核酸染色剂、DNA Maker、琼脂糖,上海生工生物工程股份有限公司。
1.2 实验仪器
防蒸发梯度PCR 仪,德国Eppendorf 公司;LRH型生化培养箱,上海一恒科技有限公司;LDZX-50FBS立式高压蒸汽灭菌锅,上海申安医疗器械厂;DK-8D型恒温水浴槽,上海一恒科技有限公司;PE Victor X3酶标仪,美国Perkin Elmer 公司;HZQ-X300C 型恒温振荡器,上海一恒科技有限公司;Purifier 生物安全柜,美国LABCONCO 公司;Legend Micro21R 微量冷冻离心机,美国Thermo 公司;Ge1Doc XR+全自动凝胶成像系统,美国Bio-Rad 公司;PE Victor X3 酶标仪,美国Perkin Elmer 公司。
1.3 菌种活化及基因组DNA 提取
霍氏肠杆菌的活化,从-80 ℃超低温冰箱中取出保存的菌种,平板划线于LB 固体培养基,28 ℃倒置培养12~16 h,挑取单菌落于10 mL LB 液体培养基中,28 ℃、160 r/min 摇床过夜培养用。将细菌溶液放入1.5 mL EP 管中,离心10 min 以弃去上清液。加入1 mL TE 缓冲液重悬菌体,旋涡使菌体充分混匀。将细菌溶液置于1.5 mL EP 管中,并在沸水浴中加热10 min,离心并以上清液为模板。得到的DNA用50~100 µL TE Buffer 溶解,于-20 ℃保存备用。
1.4 霍氏肠杆菌Ho-01 目的基因ADC 的克隆及测序
根据NCBI 数据库中的霍氏肠杆菌基因序列(GenBank:CP036310.1),利用primer primer 5 软件进行扩增引物的设计。在上海生工生物工程有限股份公司合成基因扩增引物序列(表1 所示)。

表1 ADC 基因扩增引物序列Table 1 ADC gene amplification primer sequence
以霍氏肠杆菌Ho-01 的基因组DNA 为模板,利用高保真酶试剂盒PrimeSTAR® HS DNA Polymerase 进行PCR 实验,并根据使用说明书及优化试验确定PCR扩增反应体系及条件。ADC 基因扩增反应条件为:98 ℃,10 s;58 ℃,5 s;72 ℃,5 s;30 个循环;4 ℃恒温。

表2 生物信息学分析工具Table 2 Bioinformatics analysis tools
扩增所得的目的片段,通过大连Takara 公司的MiniBEST Agarose Gel DNA Extraction 试剂盒进行PCR 产物纯化,然后与pMD20-T 载体进行连接,重组的质粒转化到E.coli JM109 感受态细胞,通过蓝白斑筛选挑取阳性克隆子,送至Takara 公司进行测序,测序结果利用NCBI 网站(https://www.ncbi.nlm.nih.gov/)进行比对分析。
1.5 精氨酸脱羧酶的生物信息学分析
将测序获得的ADC 核酸序列使用NCBI 网站中的ORFfinder 工具翻译为氨基酸序列,翻译得到的ADC 蛋白的氨基酸序列上传至NCBI 网站,进行序列BLAST 分析,蛋白数据库选用Swiss-Prot Database,将高相似性蛋白比对序列下载至本地,按照系统发育分析软件MEGA 7.0 进行序列同源性比对,构建系统发育树。生物信息学分析工具如表2 所示。
2 结果与分析
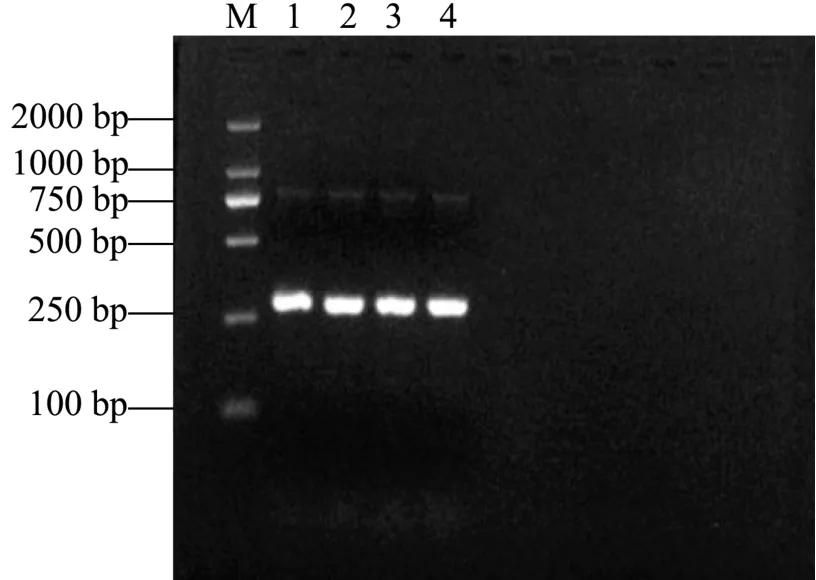
图1 重组质粒ADC 目的片段的PCR 产物Fig.1 The PCR amplification products of ADC fragments
2.1 ADC 基因克隆及测序
如图1 所示,通过PCR 从霍氏肠杆菌的总DNA中扩增了一个基因片段,目的片段大小约为260 bp,与测序结果基本吻合,在NCBI 网站对测序结果比对分析,由霍氏肠杆菌中克隆测序获取的基因片段序列与GenBank 中登录的霍氏肠杆菌精氨酸脱羧酶基因speA 序列的同源性达99%,可初步确定菌株中存在精氨酸脱羧酶基因,为精氨酸脱羧酶基因的后续表达及其编码蛋白的功能探究奠定了基础。
2.2 ADC 蛋白一级结构的确定及序列比对分析
利用NCBI 网站中ORFfinder 工具将ADC 核酸序列分别翻译为氨基酸序列,将翻译得到的ADC 蛋白的氨基酸序列分别上传至NCBI 网站,进行序列BLAST 分析,比对结果显示该序列与GenBank 中登录的霍氏肠杆菌精氨酸脱羧酶基因(speA)序列的同源性达100%(图2)。
2.3 ADC 蛋白的同源性分析
通过NCBI 数据库的smart BLAST 工具搜索ADC 蛋白的相似性较高的序列,将下载的序列用DANMAN 8.0软件进行多序列比对,结果如图3所示,ADC 蛋白与肠杆菌科生物合成精氨酸脱羧酶(登录号:WP_001295380.1)相似度较高。基于ADC 的多序列比对结果,利用MEGA 7.0 软件构建系统进化树(图4)。

图2 ADC 蛋白的氨基酸序列比对Fig.2 Amino acid sequence alignment of ADC protein
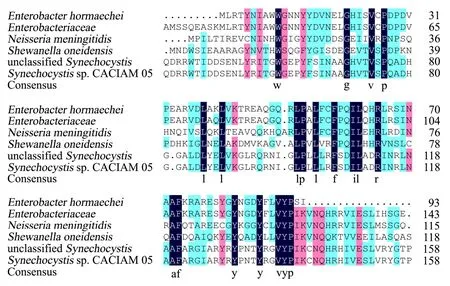
图3 ADC 蛋白多序列比对Fig.3 ADC protein multiple sequence alignment

图4 ADC 基因系统进化树Fig.4 Phylogenetic tree of ADCgene
2.4 ADC 蛋白理化性质预测
将目的蛋白的氨基酸序列输入至 ExPASy-ProtParam 在线分析软件中进行蛋白质理化性质预测,结果如表2 所示,ADC 蛋白由93 个氨基酸构成,预估分子量大小约为10.82 ku、理论等电点是8.64、原子组成为C492H746N136O135S3、半衰期>10 h(大肠杆菌,体内)、脂肪系数为86.02;总平均亲水性是-0.35 整体表现亲水性,属于可溶性蛋白;不稳定系数为48.57,根据不稳定系数数值<40 属于稳定蛋白的标准,推断ADC 蛋白为不稳定蛋白。

表2 ADC 蛋白理化性质的预测Table 2 The prediction of physicochemical properties of ADC proteins
2.5 ADC 蛋白亲疏水分析
使用ProtScale 工具分析ADC 蛋白亲疏水性,由图3 可知,其中负值代表亲水,数值越小亲水性越强,而正值代表疏水,数值越大疏水性越强。疏水区最大值为第58 位氨基酸(1.878),亲水区最小值为47 位氨基酸(-2.522),图中可以看出在0 以下的区域有很多氨基酸,即亲水性区域,所以ADC 蛋白为亲水性蛋白质,这与Expasy Protaram 预测得到的总平均疏水指数(GRAVY=-0.35)结果是一致。

图5 ADC 蛋白的疏水性分析Fig.5 The Hydrophobic forecast of ADCproteins
2.6 ADC 蛋白跨膜结构及信号肽预测

图6 ADC 蛋白的跨膜区预测Fig.6 The transmembrane region prediction of ADC proteins
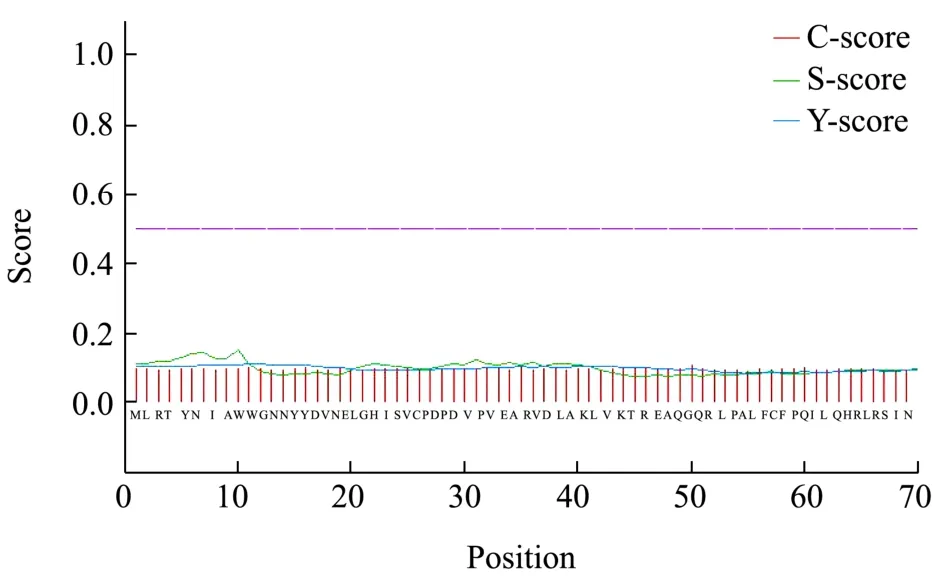
图7 ADC 蛋白的信号肽预测Fig.7 The signal peptide prediction of ADC proteins
通过TMHMM Serverv. 2.0 在线工具预测跨膜与跨膜螺旋结构特征,ADC 蛋白预测的跨膜螺旋(Transmembrane Helix,TMH)数为0,N’末端在膜的细胞质侧的总概率为0.45,可以推测ADC 蛋白都处于膜外,为非跨膜蛋白(图6)。用Signal P 4.0 Server软件预测ADC 蛋白信号肽,通过综合剪切点分值C的最大值来预测信号肽的剪切位点,通过信号肽分值(S>0.5)来判断ADC 蛋白是否为分泌蛋白,第50位氨基酸CMax=0.11,S 平均值为0.13(<0.5),说明ADC 蛋白均不具有分泌信号肽的特征(图7)。
2.7 ADC 蛋白的二级结构预测

图8 ADC 蛋白的二级结构Fig.8 The secondary structure prediction of ADC proteins
蛋白质的二级结构预测有利于探究氨基酸序列和三维构象之间的联系。利用SOPMA 在线工具分析ADC 蛋白的二级结构(图8),由预测结果可知,ADC蛋白中α-螺旋(h 表示)为38.71%,β-转角(t 表示)为9.68%,氨基酸残基构成的延伸链(e 表示)为24.73%,无规则卷曲(c 表示)占26.88%。蛋白质肽链中构成配体/受体结合的活性部位是无规则卷曲,容易受到侧链相互影响而改变空间构象,ADC 蛋白二级结构中如果含有大量的无规则卷曲可能影响蛋白质肽链的活性,从而影响蛋白质的功能。
2.8 ADC 蛋白的三维构象模型预测
经SWISS-MODEL 在线分析平台,ADC 蛋白与生物合成的精氨酸脱羧酶有98.90%相似,能够用于同源建模。由图9 可知,ADC 蛋白主要有α-螺旋和无规则卷曲构成,与二级结构预测的结果是一致的。

图9 ADC 蛋白的三级结构Fig.9 The tertiary structure prediction of ADC proteins
3 结论
3.1 本实验对马鲛鱼中霍氏肠杆菌鸟氨酸脱羧酶基因进行研究,包括基因克隆和生物信息学分析。通过PCR 扩增获得目的基因,构建T-A 克隆重组质粒进行检测最终获得ADC 基因的碱基序列。同时预测了ADC 蛋白质一级结构、二级结构、理化性质、ADC蛋白质功能、三维构象五项内容。
3.2 实验结果表明ADC蛋白质一级结构由93个氨基酸组成,二级结构由螺旋结构、折叠结构、无规卷曲和氨基酸残基构成的延伸链组成,其中螺旋结构占38.71%占总结构的三分之一以上。在理化性质和功能预测中我们得知其分子量大小约为10.82 ku、理论等电点为8.64、原子组成为C492H746N136O135S3、半衰期>10 h(大肠杆菌,体内)、脂肪系数为86.02;总平均亲水性为-0.35 整体表现亲水性,属于可溶性蛋白,而且不存在信号肽及跨膜区。上述研究首次报道马鲛鱼中产胺菌-霍氏肠杆菌中精氨酸脱羧酶的生物信息学特性,今后在基因克隆的基础上,将进行蛋白质的表达、分离纯化和性质研究,进一步解析精氨酸脱羧酶。
