坚忍肠球菌6-24 和枯草芽孢杆菌B9 对罗氏沼虾免疫水平与肠道环境的改善作用
2021-03-27朱成坤秦振宁韩双艳梁书利林影
朱成坤,秦振宁,韩双艳,梁书利,林影
(华南理工大学生物科学与工程学院,广东省发酵与酶工程重点实验室,广东广州 510006)
罗氏沼虾(Macrobrachium rosenbergii)属于长臂虾科、沼虾属动物,又名马来西亚大虾、淡水长臂大虾、大头虾等,是一种大型淡水经济虾类,素有淡水虾王之称。罗氏沼虾原产于东南亚(大部分产于马来西亚),现在已被引进到全球各地,成为全球养殖产量最高的三大虾种之一[1]。近年来,在广东省整体渔业的出塘总量以及出塘总收入逐年下降的情况下,罗氏沼虾的出塘量及其带来的收益在逐年上升,表明罗氏沼虾对广东省水产行业的经济贡献巨大[2]。为了提高产量和产值,高密度养殖成为养殖场的常用方法,但也出现了不少问题。养殖密度的增加常常使得水质恶化、营养盐缺乏,导致虾机体免疫力下降、感染病毒和细菌的机率大大增加,虾体发病甚至死亡,出塘率显著降低[3]。为此,人们开始引入抗生素类的化学药品,但这也导致了细菌耐药性产生、虾体肠道正常菌群扰乱、食物链摄入导致食用者体内抗生素积累、以及环境中抗生素残留等诸多问题[4,5]。近年来,随着微生物修复的概念普及,人们尝试在水产饲料中引入益生菌减少化学药物的使用,提高虾体自身免疫力,促进整个虾类养殖业的健康绿色发展。
益生菌具有调节水产动物体内的微生态平衡,刺激免疫功能等作用,因而有利于恢复动物机体正常生理功能、防治病害、增进健康,从而使养殖动物的生产性能提高[6,7]。Lin 等[8]发现在饲料中添加浓度均为1×109cfu/kg-的枯草芽孢杆菌(Bacillus subtilisE20),戊糖乳杆菌(Lactobacillus pentosus BD6),酿酒酵母(Saccharomyces cerevisiaeP13)以及发酵乳杆菌(Lactobacillus fermentumLW2)能够改善鲈鱼的免疫参数和生长状况,同时还能够降低嗜水气单胞菌(Aeromonas hydrophila)的数量。除了水产鱼类,益生菌也在饲养凡纳滨对虾中也有初步应用。张盛静等[9]研究发现,在饲料中添加地衣芽孢杆菌可显著提高凡纳滨对虾抗哈维氏弧菌感染的能力,汪波等[10]研究则表明,添加凝结芽孢杆菌也可在一定程度上提高凡纳滨对虾幼虾的生长性能和改善其非特异性免疫力。但上述研究主要集中于研究外源益生菌添加对虾体生长及免疫力的影响。同时,学者们普遍认为,不同种类的益生菌对机体的作用机制不同,复合添加通常能够达到作用互补或增强的效果[11]。理论上来讲,内源益生菌较外源益生菌对宿主虾体的作用更加温和,适应性更好。近几年,人们开始尝试从虾体自身消化道分离内源性微生物,但对分离的内源益生菌用于饲喂,研究对虾的生长性能以及免疫的影响比较少。本研究尝试从抑菌作用、肠道粘附性以及产酶能力三个方面从虾肠道筛选分离内源益生菌,并将分离鉴定的内源益生菌用于制备发酵饲料,分析该添加饲料对罗氏沼虾肠道环境和免疫功能的影响,为内源益生菌在罗氏沼虾养殖中的应用推广及快速普及提供科学参考。
1 材料与方法
1.1 材料
1.1.1 实验动物
罗氏沼虾,活体,28.84±5.09 g,共120 条,购于东莞市江南水产批发市场,活体运回。
1.1.2 实验材料与试剂
副溶血弧菌ATCC17802 购自环凯生物科技有限公司;商业南美白对虾1 号料购自通威股份有限公司;超氧化物歧化酶(superoxide dismutase,SOD)测定试剂盒、溶菌酶(lysozyme,LZM)测定试剂盒购自南京建城生物工程研究所;乳酸菌培养基(MRS)、营养肉汤培养基(NB)、硫代硫酸盐柠檬酸盐胆盐蔗糖培养基(TCBS)、胰酪大豆胨培养基(TSB)培养基购自环凯生物科技有限公司;L-3,4 二羟基苯丙氨酸(L-DOPA),棕榈酸对硝基苯酯(p-NPP)、多粘菌素B 购自阿拉丁公司;促芽孢培养基:2%(m/V)胰蛋白胨、3%(m/V)葡萄糖、0.4%(m/V)K2HPO4、0.4%(m/V)NaH2PO4、0.1%(m/V)MgSO4、0.5%(m/V)(NH4)2SO4、0.05%(m/V)MnSO4、0.02%(m/V)CaCl2、0.8%(m/V)酵母提取物,pH 7.2;淀粉酶筛选培养基:1%(m/V)胰蛋白胨,0.3%(m/V)牛肉浸膏,0.5%(m/V)无水氯化钠,0.2%(m/V)可溶性淀粉,2%(m/V)琼脂,pH 7.2;蛋白酶筛选培养基:1%(m/V)蛋白胨,1%(m/V)牛肉浸膏(m/V),0.5%(m/V)无水氯化钠,1%(m/V)干酪素,2%(m/V)琼脂;木聚糖酶筛选培养基:1%(m/V)木聚糖,1.8%(m/V)NB 培养基,2%(m/V)琼脂。
1.2 内源益生菌分离实验
1.2.1 乳酸菌分离纯化
虾的体表用75%的乙醇清洗和消毒。在无菌条件下,使用镊子和剪刀解剖整个肠子并浸泡在PBS 7.2中。使用匀浆机将肠子进行匀浆。将匀浆液进行连续稀释(10-1至10-6)并涂布在MRS 平板上,在厌氧条件下于37 ℃培养24 h。培养结束后随机挑出一个菌落重新划线于新的MRS 平板,重复3 次以获得纯培养物。将纯化的菌株保存在含有15%无菌甘油的MRS肉汤中,并保存在-80 ℃待用。
1.2.2 芽孢杆菌分离纯化
将1.2.1得到的匀浆液置于促芽孢培养基中,37 ℃培养24 h。培养结束后置于80 ℃水浴30 min 以除去非芽孢菌,后续将培养液进行连续稀释(10-1至10-6)并涂布在NB平板上,在好氧条件下于37 ℃培养24 h。培养结束随机挑出一个菌落重新划线于新的NB 平板上,重复3 次以获得纯培养物。将纯化的菌株保存在含有15%无菌甘油的NB 肉汤中,并保存在-80 ℃待用。
1.2.3 抑菌能力测定
参考沙玉杰[12]的报道使用琼脂扩散法测试乳酸菌的抑菌活性,乳酸菌以0.1 OD的接种量接种到MRS培养基中,30 ℃摇瓶发酵48 h 后,4 ℃,5000 r/min离心5 min 得到上清发酵液。副溶血弧菌ATCC17802在TSB 培养基中37 ℃培养24 h 后,根据麦氏比浊管将活菌数调整为1×106cfu 并接种到TSB 平板中,静置20 min 后得到实验平板。在实验平板上均匀地放下4 个牛津杯,向其中两个分别加入200 µL 发酵上清液,一个加入200 µL 1 mg/mL 抗生素多粘菌素类B 作为阳性对照,一个加入200 µL MRS 培养基作为空白对照。28 ℃培养24 h 后观察抑菌圈的大小。益生菌的相对抑菌活力I(实验组相对于抗生素的抑菌效率,%)用以下公式表示:

式中:H1为实验组抑菌圈直径;C1为阳性对照抑菌圈直径。
1.2.4 菌株粘附性实验
将100 µL 虾肠道粗粘液分别添加至96 孔板中,4 ℃过夜固定,用250 µL 无菌PBS 溶液冲洗96 孔板2 次以除去未固定的粘液。所有候选乳酸菌用MRS 培养基调整OD 为1.0,取50 µL 菌液加入到96 孔板中,37 ℃孵育1 h。孵育结束后使用PBS 7.2 清洗掉未固定的菌液,加入200 µL 的无菌PBS 7.2 缓冲液重悬菌体,重悬液进行连续稀释(10-1至10-2)后,分别取15 µL 稀释液涂布到MRS 平板上,37 ℃培养24 h。随选取适当的稀释度进行菌落计数。原菌液经过适当稀释后涂布到MRS 平板上作为空白对照。粘附率A 粘附计算公式如下:
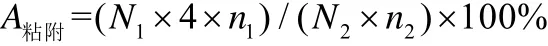
式中:N1为实验组菌落数量;N2为对组照菌落数量;n1为实验组的稀释倍数;n2为对照组的稀释倍数。
1.2.5 菌株产水解酶能力鉴定
借鉴陈小敏[13]所报道的方法对候选菌株产酶能力进行测定,将前面分离的菌株分别点种于淀粉酶筛选培养基、蛋白酶筛选培养基、木聚糖酶筛选培养基、甘露聚糖酶筛选培养基中,平板放置于37 ℃下培育48 h,培养后的具体操作如下:
(1)淀粉酶生产菌筛选:往筛选平板中滴加适量碘液;
(2)蛋白酶生产菌筛选:往筛选平板上加入少量10%三氯乙酸溶液,静置15 min 后倒去;
(3)木聚糖酶生产菌筛选:往筛选平板中加入适量刚果红染液,静置30 min,让其充分染色,先用蒸馏水冲洗,再用1 mol/L 的氯化钠水溶液冲洗染液;
(4)观察并记录菌落(C)和透明圈直径(H)算出H/C 值,判断其产水解酶能力。
1.2.6 生理生化鉴定及16S rDNA 鉴定
根据相关的实验结果,选取6-24 与B9 送至美吉生物有限公司进行16S rDNA 全序列测试,其测序结果提交至NCBI 进行序列比对。此外根据《常见细菌系统鉴定手册》对6-24 和B9 进行生理生化鉴定。
1.3 养殖试验
1.3.1 菌株处理
坚忍肠球菌(E.durans)6-24 和枯草芽孢杆菌(B.subtilis)B9分别在MRS培养基中30 ℃静置培养24 h,接种量为1 OD,培养后5000 r/min 离心10 min,无菌生理盐水洗涤3 次后备用。
1.3.2 发酵饲料制备
发酵饲料制备根据袁春营等[14]的方法稍稍修改。将浓度均为2×109cfu/mL 的坚忍肠球菌6-24、坚忍肠球菌B9 菌按体积比1:1 混合,向混合菌液中加入2 g/L的红糖后按照体积比1:80 加入自来水,混合均匀,与商业饲料(通威股份有限公司,南美白对虾1 号料),按照2:5 的比例搅拌均匀,塑料薄膜密封发酵24 h,制成实验饲料。此时发酵前饲料中各菌的浓度均为1×107cfu/kg。
1.3.3 饲养管理
本研究设置1 个实验组T 和1 个对照组C,每个组设置三个水族箱作为平行实验。水族箱规格600 mm×500 mm×450 mm,每个水族箱中投放20 只罗氏沼虾。
饲养期间,T 组投喂发酵饲料,C 组投喂普通的商业饲料,投饵量为对虾体质量的1%~3%进行投喂,每天投喂2 次,投喂时间为8:00 和16:00,饲养时间为4 周。饲养期间记录每天饲料摄入量,水温27~29 ℃,pH 7.5~8,期间连续通氧。
1.3.4 罗氏沼虾免疫参数分析
养殖期结束后,每个水族箱取5 只虾并根据Ranjit等[15]的方法进行血淋巴的抽取。对于总血球计数(total haemocyte count,THC),将血淋巴按照体积比1:9 放在福尔马林溶液中稀释,然后取20 µL 溶液放在血球计数板上,使用复合显微镜测量总血球数量。通过以下公式计算总血细胞计数:
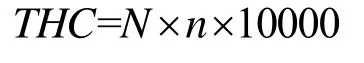
式中:N为中央大方格血细胞的数量;n为稀释倍数;10000为1 mL 里的THC。
对于酚氧化酶(phenoloxidase,PO)活力的测定,将血淋巴与TBS 溶液按体积比1:9 混合,将50 µL 混合液置于96 孔板中,加入50 µL 1 mg/L 的胰蛋白酶(trypsin)孵育5 min 后,添加50 µL 3 mg/mL 的L-DOPA 到每个孔中,同时添加100 µL TBS 溶液作为空白对照。孵育5 min 后,在492 nm 处测量形成的多巴色素。PO 活性通过以下公式计算:

式中:Ipo为酚氧化酶活性;|A2-A1|为每分钟在492 nm 处的吸光度变化;0.001 代表每分钟使492 nm 处吸光度上升0.001为一个活性单位;Ew为测试混合物中所含血淋巴的体积(mL)。
对于超氧化歧化酶(superoxide dismutase,SOD)以及溶菌酶(lysozyme,LZM)活力的测定,参照“1.1.2实验材料与试剂”中的酶试剂盒说明书进行测定。
1.3.5 肠道消化酶测定
每个实验组中取0.1 g 肠道组织,用1 mL 0.1 mol/L 的磷酸盐缓冲液(pH 7.2)匀浆并以12,000 r/min离心5 min 以获得酶粗提液。
淀粉酶活力参考Xiao[16]等的方法进行测定,以1 mg 蛋白每分钟水解淀粉产生1 mg 葡萄糖为1 个酶活力单位(U)。蛋白酶参考Zhang 和Zhang[17]的方法进行测定,以1 mg 蛋白每分钟水解干酪素产生1 µg 酪氨酸为1 个酶活力单位(U)。脂肪酶根据Aryee[18]等方法进行测定。以1 mg 蛋白每分钟使OD 值每上升0.001 为1 个酶活力单位(U)。
1.3.6 罗氏沼虾肠道弧菌的计数
在无菌条件下提取0.1 g 的肠道组织,将其浸泡在2 mL 预冷的0.1 mol/L 的磷酸盐缓冲液(pH 7.2)中,4 ℃放置24 h 后匀浆。匀浆液进行10-1至10-6的梯度稀释后分别涂布在TCBS 平板上,37 ℃培养24 h 后选取适当的稀释度进行计数。
1.4 数据统计与分析
每个实验设置3 个平行。各喂养组数据使用单因素方差(One-Way ANOVA)分析,若处理有显著差异则进行多重比较(Tukey"s)检验。分析软件为Excel 2016,实验数据均以“平均值±标准差(Mean±SD)”表示。
2 结果与讨论
2.1 乳酸菌抑菌与粘附能力对比
抑菌效果是水产养殖中益生菌筛选的重要指标之一[19]。本研究根据1.2.1 的方法在MRS 培养基中一共分离得到26 株形态、大小不一样的乳酸菌并考察了其抗菌能力。该研究以对大多数致病菌有抑制作用的多粘菌素类B 为对照,将乳酸菌抑菌圈与多粘菌素类B(1 mg/mL)产生的抑菌圈作对比,发现其中12 株对副溶血弧菌ATCC17802 具有抑菌活性(图1),相对抑菌率在40%到70%之间。相对抑菌率40%,可以理解为该菌对副溶血弧菌ATCC17802 的抑菌能力相当于0.4 mg/mL 多粘菌素类B。12 株菌中,4-12、4-1以及6-24 相对抑菌率超过60%,6-24 的相对抑菌活力最高,达到68.94%。上述实验结果显示,自罗氏沼虾肠道内分离的乳酸菌对副溶血弧菌有较好的抑制能力。沙玉杰[12]的研究也发现,饲喂乳酸菌时凡纳滨对虾的副溶血弧菌感染率下降86.86%,这与本实验结果得以互相印证。Sha 等[20]的研究指出,使用NaOH 溶液将乳酸菌发酵上清液中和到pH 7.0 后,失去了对副溶血弧菌ATCC17802 的抑菌活性,推测有机酸质的产生可能是乳酸菌发挥抑制病原菌生长繁殖的重要原因之一。
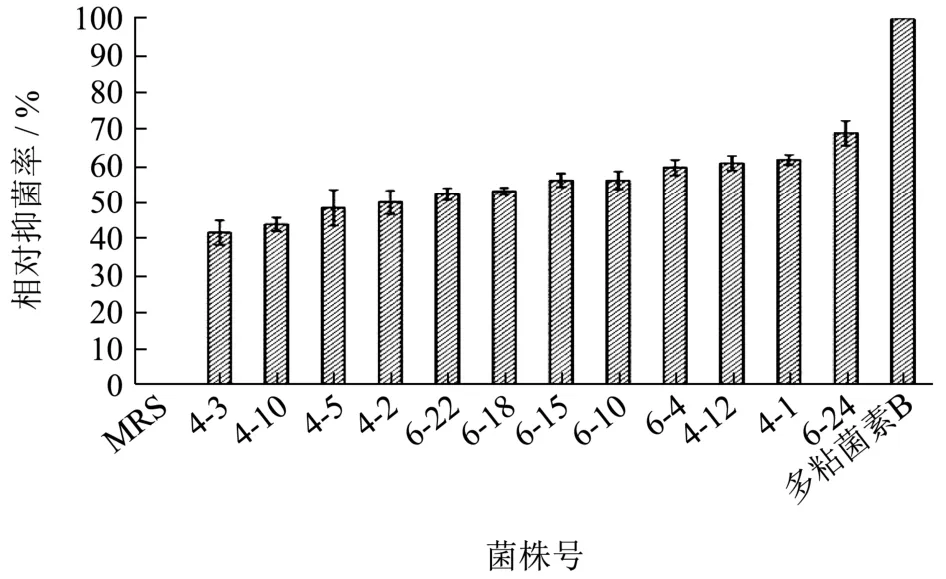
图1 各乳酸菌株对副溶血弧菌ATCC17082 的相对抑菌率Fig.1 Relative antibacterial activity of LAB to V. parahaemolyticus ATCC 17802
肠道粘液能够为生物体提供所需营养的同时也是各种微生物粘附肠道的桥梁[21]。益生菌能够与病原菌竞争粘附位点,从而抑制病原菌的生长与繁殖,因此对肠道粘附能力的强弱也成为了益生菌筛选的标准之一。Sugimura 等[22]曾使用平板计数法来评价菌株对肠道粘液的粘附性能,并筛选出了一株相对粘附率为20.15%的棉籽糖乳球菌(Lactococcus raffinolactis)。本实验结果表明,第一轮筛选获得的26 株乳酸菌菌株均具有粘附能力,如表2~6 所示。26 株乳酸菌菌株中,14 株菌株粘附能力超过10%,2 株菌株粘附能力超过20%。令人欣喜的是,6-24 表现出最高的粘附能力,黏附能力达到21.55%,与其优越的抑菌活性十分匹配。因此,后续对6-24 开展了进一步鉴定,并研究用其饲喂罗氏沼虾后,虾体的免疫能力变化情况。
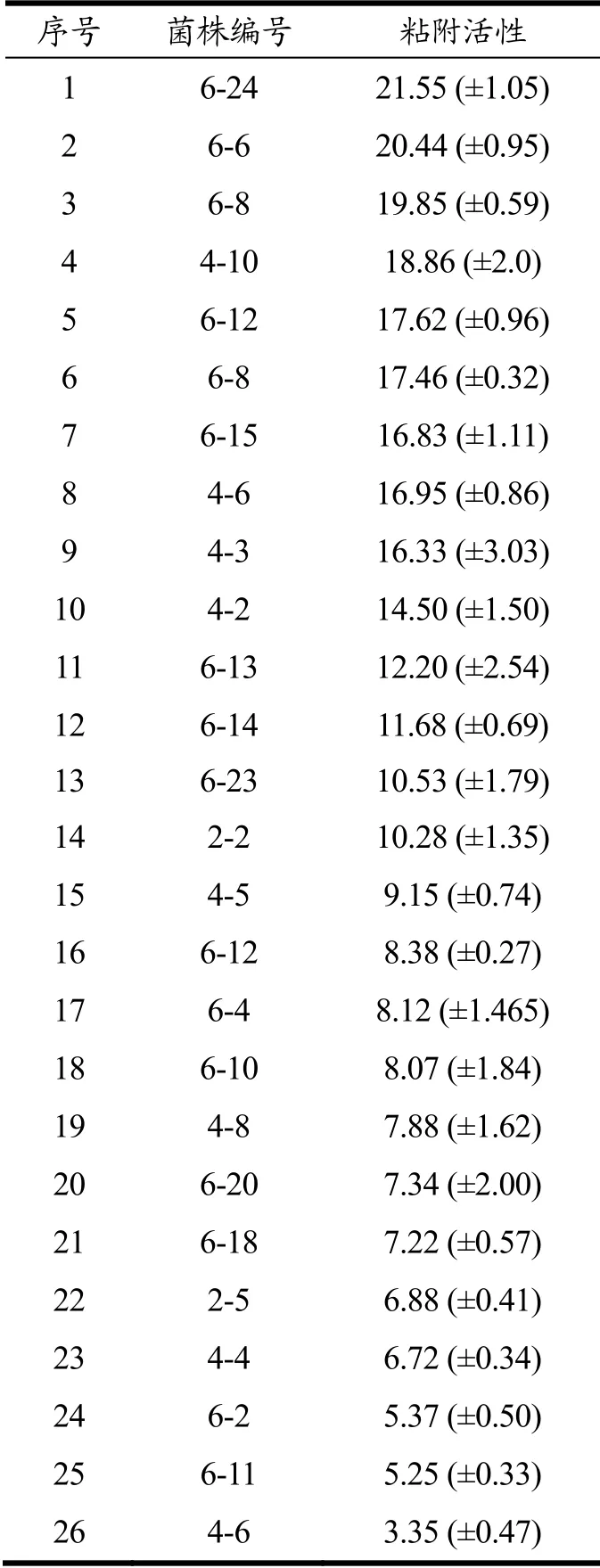
表1 乳酸菌粘附能力排名(黏附活性从高到低排列)Table 1 The adhesive activity of LAB
2.2 芽孢杆菌水解酶能力对比
目前研究报道认为,淀粉酶和木聚糖酶能够分解水产动物肠道中的碳水化合物,为机体的生长发育提供能量,蛋白酶则能够水解各种蛋白质和多肽,为机体提供各种氨基酸,因而高产淀粉酶,蛋白酶等多种水解酶的芽孢杆菌可以考虑作为益生菌开发。

表2 候选芽孢杆菌菌株水解酶产酶情况Table 2 Hydrolytic enzyme-producing ability of Bacillus
本研究根据1.2.2的方法从NB培养基中分离得到12 株形态、大小不一的芽孢杆菌,采用平板透明圈观察法,对的产淀粉酶、木聚糖酶、蛋白酶能力进行了评价。表2 显示,自罗氏沼虾肠道中分离出来的12株内源芽孢杆菌大多具备水解酶产酶能力,仅有1 株不生产淀粉酶、木聚糖酶和蛋白酶中的任何一种。而产一种酶的有4 株,产两种水解酶的有6 株。在12株芽孢杆菌中,B9 表现优秀,被检测出能够产3 种酶,且三种酶的产酶能力均较其他株表现良好,因此选取B9,合并乳酸菌6-24,一同研究他们作为内源益生菌的免疫和肠道改善能力。
2.3 候选菌株的鉴定
基于6-24 和B9 的优越性能,本研究对这两株菌进行了分子生物学和生理生化鉴定。16S rDNA 鉴定显示,6-24 和B9 分别相似与Enterococcus duransHCD35-4 和Bacillus subtilisJCM1465,相似度均为99.99%,系统发育进化树分析进一步证实了两株菌与其相近株的同源性,如图2 所示。进一步结合《常见细菌系统鉴定手册》对这两株菌进行了生理生化鉴定,如表3 所示。鉴定结果表明这两株菌分别为坚忍肠球菌和枯草芽孢杆菌,因此本研究将两株菌命名为E.durans6-24 和B.subtilisB9。
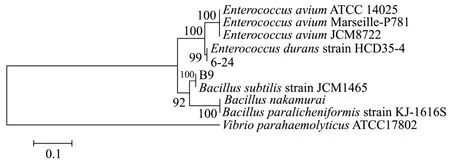
图2 基于16S rDNA 进化树发育分析Fig.2 Phylogenetic relationship based on 16S rDNA

表3 各菌株生理生化检测结果Table 3 Physiological and biochemical test results of each strain
2.4 饲料中添加6-24、B9 对罗氏沼虾非特异性免疫能力的影响
罗氏沼虾作为无脊椎动物,机体自身并不具有特异性免疫,因此先天性免疫系统成为了其对抗病毒以及病菌的重要屏障。虾的先天性免疫应答主要由总血球细胞,酚氧化酶原系统(proPO),抗氧化系统以及溶菌酶四个部分组成。
酚氧化酶(PO)是酚氧化酶原系统所表达的重要蛋白,能将酚类物质转化为醌类物质来阻止微生物对机体的感染。Ranjit 等[15]在饲料里添加不同浓度的枯草芽孢杆菌后,罗氏沼虾血淋巴中PO 活性随着菌株浓度的上升而提高,上升幅度最大达到46.40%。在本研究中,图3a 显示实验组PO 活性上升48.24%(p<0.05),该结果表明6-24 与B9 联用,能够有效促使PO 活性提高。Sudarat 等[23]研究指出,向南美白对虾喂养乳酸菌后,PO 活性和与相关免疫基金LvproPO的mRNA 表达量都有显著的上升,说明益生菌可以通过对酚氧化酶原系统的激活来调节酚氧化酶的活力,参与到对虾机体免疫防御。
虾的天然免疫中,病原微生物被免疫细胞吞噬的过程会通过NADPH 氧化酶产生大量的活性氧(ROS),而大量的活性氧会对机体造成伤害,因此超氧化物歧化酶(SOD)可以中和过量的活性氧以维持机体的平衡。在本研究中,实验组组SOD 活性上升4.42%(p<0.05)(见图3b),这一结果与汪波[10]的研究结果一致,反映了6-24 与B9 能促进虾体SOD 的表达,进而有助于清除虾体内的自由基,使虾体保持正常的免疫状态。
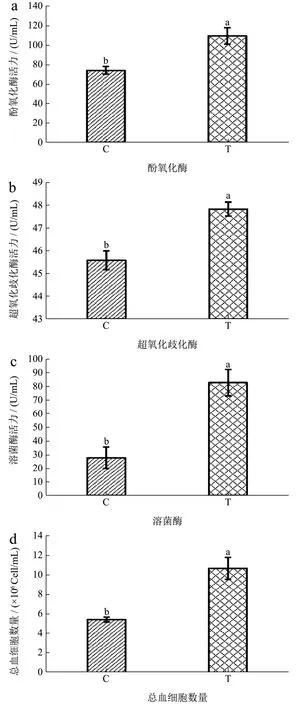
图3 发酵饲料对罗氏沼虾非特异性免疫能力的影响Fig.3 Effects of fermented feed on immune parameters of M.rosenbergii
在大多数甲壳类动物中,溶菌酶(LZM)是一类在血淋巴或血细胞中表达的具有抗菌活性的蛋白质[24,25],它是甲壳类动物先天性免疫的重要组成部分。Dong 等[26]研究指出虾在细菌的干预下LZM 的表达情况会有所改变。图3c 显示实验组LZM 活力与对照组相比上升198.00%(p<0.05),说明LZM 可被B9 以及6-24 所诱导表达。除此之外,总血球细胞数量(THC)的提高也是LZM 活力上升的重要原因,总血球细胞在先天性免疫系统中不仅负责吞噬,包囊以及结节形成,同时也是某些免疫蛋白质的来源[27]。Daruosh 等[28]研究指出对南美白对虾喂养枯草芽孢杆菌(Bacillus subtilis)和地衣芽孢杆菌(Bacillus lichenformis)后THC 上升了12.15%,同时LZM 活力上升88.34%。图3d 显示实验组的THC 在喂养了B9 和6-24 后相对于C 组上升了96.54%(p<0.05),跟上述结果一致,说明LZM 活性与总血球细胞数量之前存在着相关性。
2.5 饲料中添加6-24、B9 对罗氏沼虾肠道消化酶活力的影响

图4 发酵饲料喂养对罗氏沼虾肠道环境的影响Fig.4 Effect of fermented feed on intestinal environment of M.rosenbergii
水生动物的生长取决于消化道中各种营养物质的消化、吸收和转化,这些复杂而多样的过程是通过肠道中的消化酶进行的。Ye 等[29]发现饲料中添加益生菌后蛋白酶活力和淀粉酶活力都有增加,但蛋白酶活力上升87.53%,较其他水解酶活力增强很多。图4 所示,实验组罗氏沼虾肠道中淀粉酶、蛋白酶、脂肪酶活力确实比未添加混合益生菌的对照组有显著提高(p<0.05),多项研究报告也证实混合益生菌的添加显著提高了虾肠道消化酶的活力[30,31]。与Ye 的研究结果一致性非常好的是,经饲喂益生菌后,罗氏沼虾体内的蛋白酶活力提升了84.80%。推测枯草芽孢菌B9 在落实沼虾肠道内能够进行顺利定植,并产生大量蛋白酶,从而良好地促进了各种蛋白质和多肽的水解,为机体提供各种氨基酸养料,这一结果有待进一步后续验证。
2.6 饲料中添加6-24、B9 对罗氏沼虾肠道可培养弧菌的影响
哈氏弧菌、副溶血弧菌以及溶藻弧菌等弧菌属细菌一直是导致虾发病的主要病原体,它们所引起的疾病是世界各地养殖鱼,贝类,虾等中的主要流行病,也是水产养殖中危害最大的细菌性疾病。因此,虾肠中弧菌的数量是虾体是否健康的重要指标之一。
4 周后各组肠道中可培养弧菌数量如图5 所示,T组肠道中的可培养弧菌数量相对于C 组下降了59.76%(p<0.05),张盛静等[9]的研究中发现使用含有地衣芽孢杆菌的饲料28 d 后,肠道中LZM 基因表达显著上调,肠道中可培养弧菌数量相对于对照组只下降4.64%,与本研究结果不完全一致,推测存在以下两种原因,第一,高粘附性的6-24 通过粘附位点的竞争以及分泌有机酸,抑制了弧菌的生长。第二,在喂养了6-24 和B9 后使血淋巴中溶菌酶的表达量上升,溶菌酶能够使弧菌死亡从而导致肠道内弧菌数量有所减少。

图5 各处理组肠道中可培养弧菌数量图Fig.5 Culturable Vibrio in the intestine of each treatment group
3 结论
本研究从抑菌试验、粘附性实验和特定水解酶产酶活力三方面考量,成功地从罗氏沼虾的肠道筛选出两株内源益生菌,一株是具有高抑菌能力以及高粘附能力的坚忍肠球菌6-24,另外一株是具有较好产酶能力的枯草芽孢杆菌B9。将两株菌株按1:1 比例复合添加到饲料中制备发酵饲料,初步分析知道内源性的坚忍肠球菌6-24 和枯草芽孢杆菌B9 能够有效增强罗氏沼虾的非特异性免疫能力,以及强化其肠道消化酶酶活力。据了解,这也是第一次将坚忍肠球菌作为益生菌对罗氏沼虾进行干预以及开展其对虾的益生功能评价。本研究结果显示,添加浓度为1×107cfu/kg 的坚忍肠球菌6-24 与枯草芽孢杆菌B9 于饲料中,不仅可以有效提高罗氏沼虾的免疫能力,同时可以改善其肠道环境,降低肠道弧菌的数量,具有进一步开出虾饲用益生菌的潜在可能。
