小檗碱对糖尿病认知功能障碍模型小鼠AGEs/RAGE/NF-κB 信号通路的影响*
2021-03-27马月娥刘春秋
马月娥,刘春秋
重庆三峡中心医院,重庆 万州404000
近年来,我国糖尿病的发病率日益增加,据统计,2015年我国糖尿病患病人数已经达到1.09亿人,到2040年我国糖尿病患者数量将达到1.51亿人[1-2]。糖尿病会引起认知功能障碍,已成为全球性医学和公共卫生问题。据统计约有65%的2 型糖尿病患者伴有认知功能障碍[3-5]。但目前尚无治疗2 型糖尿病伴认知功能障碍的有效药物,因此亟待解决。相关研究发现AGEs/RAGE/NF-κB 信号通路是引起糖尿病伴认知功能障碍的重要机制[6-7]。小檗碱(Berberine)为黄连中主要有效成分,具有广泛的药理作用,如降血糖、降脂、降胆固醇、抗炎、抗菌和拮抗神经系统功能障碍的作用[8]。前期研究发现,小檗碱可缓解2型糖尿病(type 2 diabetes mellitus,T2DM)大鼠学习记忆障碍,但尚不能确定其是否是通过调节AGEs/RAGE/NF-κB信号通路,进而改善认知功能障碍[9-11]。为进一步探明小檗碱改善糖尿病认知功能障碍的作用机制,本实验拟采用腹腔注射链脲佐菌素(streptozotocin,STZ)建立糖尿病认知功能障碍模型,用Real time-PCR和Western bolt检测海马中晚期糖基化终末产物(advanced glycation end products,AGEs)、晚期糖蛋白终末产物受体(receptor for advanced glycation end products,RAGE)、核因子κB(nuclear factor-κB,NF-κB)的基因和蛋白的表达,以期为小檗碱改善糖尿病认知功能障碍提供实验依据。
1 材料与方法
1.1 实验动物70 只SPF 级雄性KM 小鼠,体质量为20~25 g,由湖北省实验动物研究中心提供,实验动物许可证号:SCXK(鄂)2015-0018。喂养条件:温度控制在23~25℃,相对湿度控制在50%~60%。
1.2 药品及试剂链脲佐菌素(streptozotocin,STZ)(美国Sigam 公司,批号:18883-66-4);小檗碱(上海源叶生物科技有限公司,纯度:98%,批号:B21379);葡萄糖测定试剂盒、肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)和白细胞介素1β(interleukin-1β,IL-1β)试剂盒(武汉伊莱瑞特生物科技股份有限公司,批号分别为EBC-K234、E-EL-R0019c、E-EL-R0012c);Trizol(美国Thermo Scientific,批号:15596018);Takara逆转录试剂盒(大连Takara 公司,批号:RR430S);SYBR Premix Ex Taq[TM](大连Takara 公司,批号:638319);一抗:AGEs(1∶1000)、RAGE(1∶1000)、NFκB(1∶1000),均为兔多克隆抗体(美国Santa Cruz 公司,批号分别为:sc-4527、sc-365154、sc-7178);二抗,HRP 标记山羊抗兔抗体(武汉谷歌生物技术有限公司,批号:20180516)。
1.3 实验仪器EnVision 型多功能酶标仪(美国Perkin Elmer 公司),AL204 型电子天平(梅特勒-托利多仪器公司),DU730 型核酸蛋白分析仪(美国Beckman coulter 公司),CFX96 型实时荧光定量PCR 扩增仪(美国Bio-Rad 公司),Universal Hood Ⅲ型凝胶图像成像分析系统(美国Bio-Rad公司)。
1.4 实验方法
1.4.1 造模及分组 70 只小鼠适应性饲养1 周后,除空白组10只外,其他60只参考文献[5]制作糖尿病认知功能障碍模型:造模组进食24 h后,一次性腹腔注射STZ 40 mg/kg,注射后第5 天禁食12 h后尾静脉取血,测定葡萄糖含量,选取空腹血糖值大于11.1 mmol/L的小鼠,最终获得符合条件的37 只小鼠为模型小鼠,分为模型组10 只,小檗碱低、中、高剂量组各9只。
1.4.2 给药方法 小檗碱低、中、高剂量组分别按照按20、40、80 mg/(kg·d)的剂量灌胃小檗碱,模型组和空白组以等体积的生理盐水灌胃,每日1次,持续给药30天。
1.5 观察指标
1.5.1 Morris水迷宫实验 灌胃结束后12 h,进行Morris水迷宫实验,前4天进行获得性训练,第5 天进行正式检测,检测定位航行实验和空间探查实验。
1.5.2 小鼠海马尼氏染色 行为学检测完毕后,以6%水合氯醛经腹腔注射麻醉(6 mL/kg),部分小鼠用4%多聚甲醛溶液经心脏灌注,待心脏发白后,端头取脑,置4%多聚甲醛固定24 h,用尼氏染色观察各组小鼠海马病理形态变化。
1.5.3 ELISA 检测血清中TNF-α、IL-1β表达水平 部分小鼠摘眼球取血,取血后置4℃离心机,以3500 r/min,离心半径:14 cm,离心15 min,取上清液,按照ELISA 试剂盒说明书检测各组小鼠血清中TNF-α、IL-1β的表达水平。
1.5.4 Realtime-PCR 检 测 海 马 中AGEs、RAGE、NF-κB mRNA 表达水平 取血后,断头取脑,冰上分离海马,置液氮速冻,24 h 内移至-80℃冰箱保存。取20 mg海马,加Trizol提取海马总mRNA,提取后用核酸蛋白仪检测纯度,纯度为1.8~2.0 即可逆转录合成cDNA;参照Takara逆转录试剂盒说明书逆转录合成cDNA;参照SYBR Premix Ex Taq[TM]试剂盒说明书依次添加试剂,置PCR 仪进行基因扩增。用2-△△Ct表示mRNA 相对表达水平。AGEs、RAGE、NF-κB及内参β-actin序列见表1。

表1 引物序列
1.5.5 Western bolt检测海马中AGEs、RAGE、NF-κB蛋白表达水平 取海马20 mg,加RIAP 裂解液和PMSF,冰上研磨,置4℃离心机,以12 000 r/min离心25 min,取上清,用BCA 蛋白质试剂盒检测各样本蛋白浓度;制作SDS-PAGE凝胶,依次加样、电泳、转膜;按抗体说明书孵育一抗AGEs、RAGE和NF-κB,置4℃冰箱过夜,洗膜,加入二抗,洗膜,ECL 显色。最后置于凝胶图像成像分析系统,曝光各组蛋白条带,拍照。
1.6 统计学方法采用统计软件SPSS 19.0处理数据,计量资料以(±s)表示,组间比较采用单因素方差分析,多组间比较采用LSD-t法,P<0.05表示差异有统计学意义。
2 结果
2.1 Morris 水迷宫实验结果与空白组比较,模型组小鼠上平台潜伏期、游泳总路程和第1 次抵原平台时间明显增加(P<0.01),穿越平台次数、目标象限时间则明显减少(P<0.01)。与模型组相比,小檗碱高剂量组小鼠上平台潜伏期、游泳总路程和第1 次抵原平台时间均有不同程度减少(P<0.05),穿越平台次数、目标象限时间则有不同程度增加(P<0.05)。小檗碱低、中剂量组小鼠上平台潜伏期、游泳总路程和第1 次抵原平台时间有不同程度较少,穿越平台次数、目标象限时间有不同程度增加,但差异无统计学意义(P>0.05)。见表2—3。
表2 各组小鼠定位航行实验结果比较(±s)
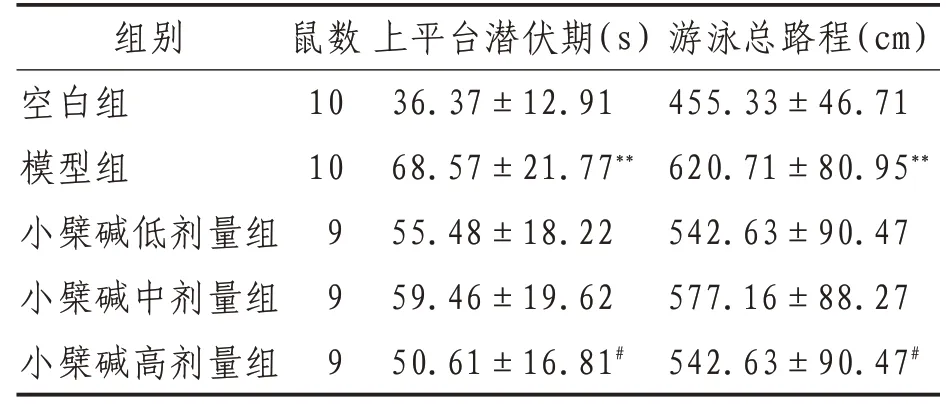
表2 各组小鼠定位航行实验结果比较(±s)
注:**表示与空白组比较,P<0.01;#表示与模型组比较,P<0.05
游泳总路程(cm)455.33±46.71 620.71±80.95**542.63±90.47 577.16±88.27 542.63±90.47#组别空白组模型组小檗碱低剂量组小檗碱中剂量组小檗碱高剂量组鼠数10 10 9 9 9上平台潜伏期(s)36.37±12.91 68.57±21.77**55.48±18.22 59.46±19.62 50.61±16.81#
表3 各组小鼠空间探查实验结果比较(±s)
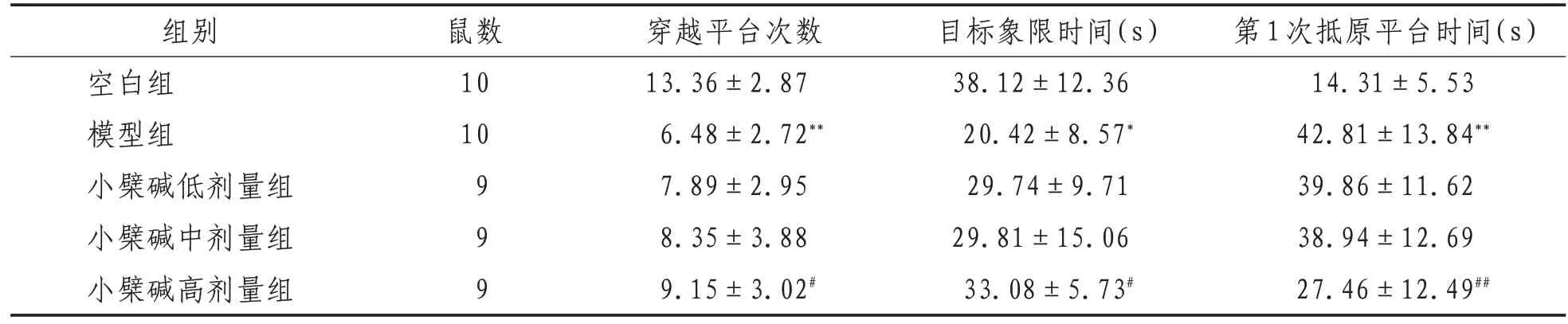
表3 各组小鼠空间探查实验结果比较(±s)
注:与空白组比较,**表示P<0.01;与模型组比较,#表示P<0.05,##表示P<0.01
第1次抵原平台时间(s)14.31±5.53 42.81±13.84**39.86±11.62 38.94±12.69 27.46±12.49##组别空白组模型组小檗碱低剂量组小檗碱中剂量组小檗碱高剂量组鼠数10 10 9 9 9穿越平台次数13.36±2.87 6.48±2.72**7.89±2.95 8.35±3.88 9.15±3.02#目标象限时间(s)38.12±12.36 20.42±8.57*29.74±9.71 29.81±15.06 33.08±5.73#
2.2 海马尼氏染色空白组小鼠海马CA3 区神经元排列均匀整齐,细胞核饱满,尼氏体染色均匀,大小均一。模型组小鼠海马CA3 区神经元减少,尼氏体固缩、深染。小檗碱高剂量组神经元恢复较好,排列较整齐,尼氏体固缩、深染明显好转。小檗碱低剂量组和中剂量组神经元也有所恢复,但不如高剂量组明显。见图1。
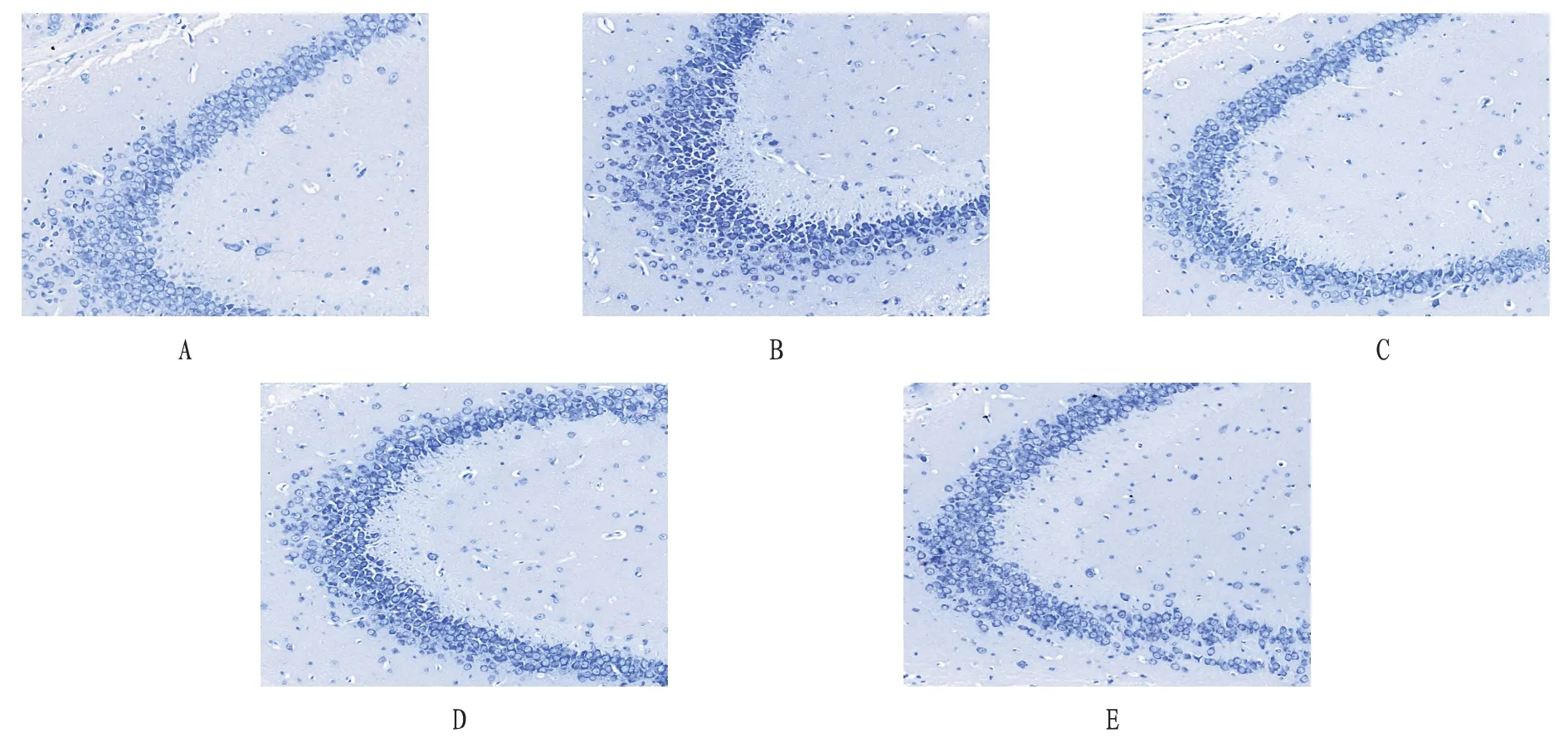
图1 各组小鼠海马CA3区尼氏染色图(×200)
2.3 血清TNF-α、IL-1β水平与空白组相比,模型组小鼠血清中TNF-α、IL-1β表达水平升高(P<0.01);与模型组相比,小檗碱高剂量组小鼠血清中TNFα、IL-1β表达下降(P<0.05),小檗碱低、中剂量组小鼠血清中TNF-α、IL-1β也有不同程度降低,但差异无统计学意义(P>0.05)。见表4。
表4 各组小鼠血清TNF-α、IL-1β水平比较(±s)ng/L

表4 各组小鼠血清TNF-α、IL-1β水平比较(±s)ng/L
注:与空白组比较,**表示P<0.01;与模型组比较,#表示P<0.05
IL-1β 63.91±24.95 101.14±21.12**82.06±19.58 86.06±17.22 77.75±18.52#组别空白组模型组小檗碱低剂量组小檗碱中剂量组小檗碱高剂量组鼠数10 10 9 9 9 TNF-α 48.49±18.15 88.93±27.48**73.19±24.78 71.86±22.07 64.06±24.78#
2.4 海马中AGEs、RAGE、NF-κB mRNA表达水平与空白组比较,模型组小鼠海马中AGEs、RAGE、NFκB mRNA 表达水平升高(P<0.01,P<0.05);与模型组比较,小檗碱高剂量组小鼠海马中AGEs、RAGE、NF-κB mRNA 表达下降(P<0.01,P<0.05),小檗碱低、中剂量组小鼠海马中AGEs、RAGE、NFκB mRNA 也有不同程度降低,但差异无统计学意义(P>0.05)。见表5。
2.5 海马中AGEs、RAGE、NF-κB蛋白表达水平与空白组比较,模型组小鼠海马中AGEs、RAGE、NF-κB的蛋白表达水平升高(P<0.01);与模型组相比,小檗碱高剂量组小鼠海马中AGEs、RAGE、NF-κB 的蛋白表达下降(P<0.01,P<0.05),小檗碱低、中剂量组小鼠海马中AGEs、RAGE、NF-κB 的蛋白也有不同程度降低,但差异没有统计学意义(P>0.05)。见表6、图2。
表5 各组小鼠海马中AGEs、RAGE、NF-κB mRNA表达水平比较(±s)

表5 各组小鼠海马中AGEs、RAGE、NF-κB mRNA表达水平比较(±s)
注:与空白组比较,**表示P<0.01;与模型组比较,#表示P<0.05,##表示P<0.01
组别空白组模型组小檗碱低剂量组小檗碱中剂量组小檗碱高剂量组NF-κB mRNA 0.58±0.31 0.91±0.36*0.74±0.26 0.69±0.22 0.64±0.25#鼠数10 10 9 9 9 AGEs mRNA 1.10±0.26 1.76±0.23**1.53±0.38 1.61±0.29 1.28±0.41##RAGE mRNA 0.74±0.31 1.07±0.37*0.84±0.19 0.99±0.17 0.79±0.31#
表6 各组小鼠海马中AGEs、RAGE、NF-κB灰度值比较(±s)
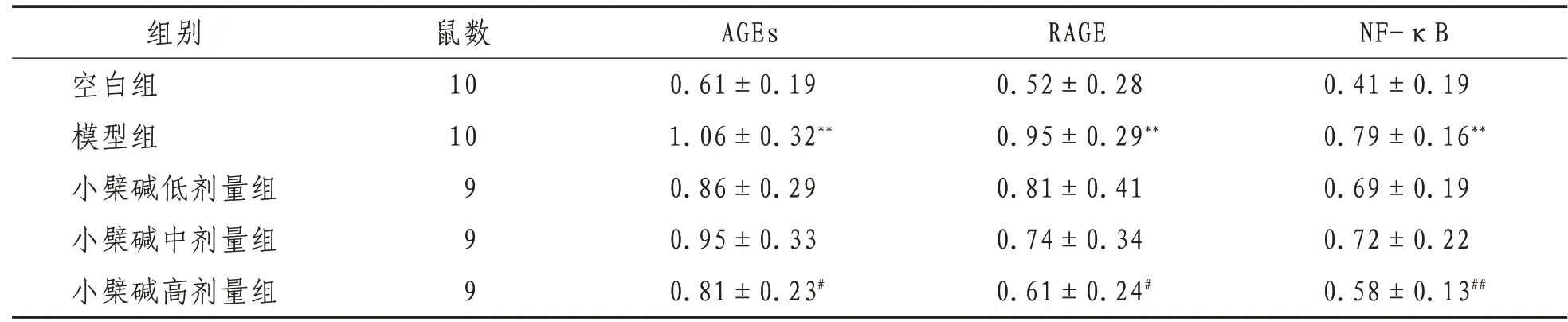
表6 各组小鼠海马中AGEs、RAGE、NF-κB灰度值比较(±s)
注:与空白组比较,**表示P<0.01,*表示P<0.05;与模型组比较,##表示P<0.01,#表示P<0.05
组别空白组模型组小檗碱低剂量组小檗碱中剂量组小檗碱高剂量组NF-κB 0.41±0.19 0.79±0.16**0.69±0.19 0.72±0.22 0.58±0.13##鼠数10 10 9 9 9 AGEs 0.61±0.19 1.06±0.32**0.86±0.29 0.95±0.33 0.81±0.23#RAGE 0.52±0.28 0.95±0.29**0.81±0.41 0.74±0.34 0.61±0.24#

图2 各组小鼠海马中AGEs、RAGE、NF-κB的蛋白条带
3 讨论
糖尿病患者体内长时间高血糖状态会促使葡萄糖发生糖化反应,进而产生AGEs 及其中间产物甲基乙二醛(methylglyoxal,MG)[12]。AGEs 和MG 具有细胞毒性,可以毒伤神经元,促进神经元凋亡[13]。体内沉积的AGEs 和MG 会促使中枢神经系统发生氧化应激反应,导致与学习记忆相关的海马神经细胞凋亡,进而引起认知功能障碍[14-16]。RAGEs是AGEs的受体,主要存在于巨噬细胞及神经细胞中,可以介导机体对AGEs 进行蛋白修饰、蛋白降解及蛋白清除[17-18]。存在于锥体神经细胞和神经胶质细胞中RAGEs 能维持血脑屏障的完整性、减少神经炎症反应和Aβ的沉积[19-21]。AGEs 在脑内过度沉积时,AGEs 会与其受体RAGE 结合,两者结合后会激活氧化应激,进而激活氧化还原反应敏感转录因子NF-κB,导致TNF-α、IL-1β等炎症因子水平升高,从而引起神经突触可塑性减低以及轴突树突分支减少等,最终引起认知功能障碍[22-23]。腹腔注射STZ 后,通过Morris 水迷宫实验,我们发现小鼠上平台潜伏期、游泳总路程和第1 次抵原平台时间明显增加,这说明本实验成功通过STZ 建立了糖尿病认知功能障碍模型。腹腔注射STZ 后,小鼠血清中TNF-α、IL-1β表达水平升高,海马CA3 区神经元减少,尼氏体固缩、深染,海马中AGEs、RAGE、NF-κB的mRNA和蛋白表达水平也升高,这说明STZ可以激活AGEs/RAGE/NF-κB信号通路,从而引起认知功能障碍。
小檗碱为黄连的主要有效成分,具有降血糖、降脂、降胆固醇、抗炎、抗细菌和拮抗神经系统功能障碍等作用[23]。本实验发现,给予模型小鼠小檗碱后,小鼠神经元恢复,排列较整齐,尼氏体固缩、深染好转,血清中TNF-α、IL-1β表达下降,海马中AGEs、RAGE、NF-κB 的mRNA 和蛋白表达水平也下降。这说明小檗碱能改善糖尿病认知功能障碍,其机制可能与其下调AGEs/RAGE/NF-κB 信号通路有关。
