海胆和海参中microRNAs的研究进展
2021-03-26尹文露赵谭军韩森荣李莹莹常亚青湛垚垚
尹文露,刘 丽,赵谭军,韩森荣,宋 坚,李莹莹,常亚青,湛垚垚
(大连海洋大学农业农村部北方海水增养殖重点实验室,辽宁大连116023)
0 引言
MicroRNAs(MiRNAs)是一类由真核生物内源基因编码产生的长度约为20 nt的调控型非编码RNAs(non-coding RNAs,ncRNAs),主要通过mRNA剪切和抑制蛋白质翻译等方式调控靶基因的表达。自1993年在秀丽隐杆线虫(Caenorhabditis elegans)中首次发现miRNA——lin-4以来[1],关于真核生物体内miRNAs的鉴定及其生物学功能的研究便广泛开展了起来。现已证实,miRNAs可通过调控生物体内约50%以上的蛋白质编码基因,参与生长发育[2]、免疫防御[3]和生理代谢[4]等多种生命过程。此外,研究发现miRNAs对其靶基因的调控还具有多向性和复杂性的特点,即miRNAs既可以对靶基因的转录进行负向调控又可以进行正向调控[5-6],同一个miRNA可调控多个甚至上千个靶基因的表达,而同一个靶基因的表达也可以受到多个miRNAs的调控[6-7]。
海胆(sea urchins)和海参(sea cucumbers)属棘皮类动物(echinoderms),是高等海洋无脊椎动物的重要代表物种,其中某些种类还是重要的世界性渔业资源,具有较高的商业价值。比如,海胆纲中的中间球海胆(Strongylocentrotus intermedius),被认为是海胆中性腺品质最好的种类,是中国重要的海胆养殖品种和出口海产品种类,市场需求量逐年增加。海参纲中的刺参(Apostichopus japonicas)在亚洲被誉为“海产八珍”之首,其产业规模从1980年开始迅速扩张,目前西太平洋地区刺参的平均年养殖产量已经从2008年的9.3×104t[8]增加到2018年的1.74×105t[9]。近年来,探明各类miRNAs在海胆和海参生长发育以及生理代谢过程中的调控功能及调控机制已逐渐成为海胆和海参研究领域的热点,因此,本研究中综述了近年来海胆和海参中miRNAs的研究相关成果及进展,以期进一步丰富和完善海胆和海参中miRNAs的基础资料,为系统了解和掌握海胆和海参中miRNAs的序列特点、生物学功能及其参与调控重要生理过程的分子机制提供参考资料。
1 动物体内miRNAs的成熟及其调控机制
在动物体内,miRNA的成熟可分为4个阶段(图1):(1)细胞核中初级 miRNA(primary miRNA,primiRNA)的生成——miRNA基因绝大部分由RNA聚合酶Ⅱ(RNA polymeraseⅡ)介导转录[10],极小部分由RNA聚合酶Ⅲ(RNA polymeraseⅢ)介导转录[11],形成长度为300~1000 nt的pri-miRNA;(2)pri-miRNA加工转化为miRNA前体(precursormiRNA,premiRNA)——pri-miRNA会在细胞核中被核糖核酸酶ⅢDrosha(ribonucleaseⅢ Drosha)和RNA结合蛋白(digeorge syndrome chromosomal region 8,DGCR8)复合体切割成长约70 nt的发卡环结构pre-miRNA[12];(3)pre-miRNA从细胞核向细胞质的转运——premiRNA会被输出蛋白5(exportin-5)以及GTP结合蛋白(GTP binding protein)由细胞核转运到细胞质中[13];(4)miRNA的成熟——pre-miRNA在细胞质中被核糖核酸酶ⅢDicer(ribonucleaseⅢDicer)切割形成约为20 nt左右的成熟miRNA双链复合体,并与RNA干扰效应分子Argonaute蛋白(Ago)一起被整合到效应分子中,形成RNA诱导的沉默复合物(RNA-induced silencing complex,RISC)复合体,通过解旋酶生成2条成熟的miRNA[14]。成熟后的miRNA主要是通过与其靶基因3'非编码区域(3'-untranslated region,3'-UTR)中特异性的“种子序列”(seed sequences)的结合进而对靶基因进行转录后调控[15]。此外,miRNA还可以通过与靶基因的编码区域(coding sequence)、5'非编码区域(5'-untranslated region,5'-UTR)及启动子区(promoter)进行结合后进一步行使其生物学功能[16-17]。
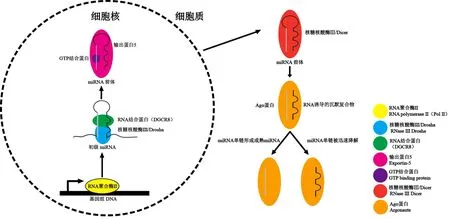
图1 动物体内miRNA的成熟过程示意图
2 海胆和海参中miRNAs的生物功能
2.1 参与调控生长与发育
生长发育是从受精卵至成熟个体的重要生命现象,也是一个极其复杂的动态变化过程。由于海胆作为胚胎发育生物学的模式生物已经有100多年的历史,因此,目前关于海胆和海参中参与调控生长发育的miRNAs的研究多集中于miRNAs对海胆胚胎发育的调控作用。
21世纪初,人们就已经发现miRNAs对海胆胚胎发育的调节有着至关重要的作用。Song等[18]的研究显示,miRNAs是紫球海胆(Strongylocentrotus purpuratus)胚胎发育基因调控网络的重要组成部分,通过抑制dicer和drosha基因的功能来抑制miRNAs的正常成熟会导致紫球海胆的胚胎无法正常发育,形成原肠胚而导致胚胎死亡。
Wnt信号通路(Wnt signaling pathway)是影响动物胚胎发育的重要蛋白信号网络,可介导动物胚胎发育过程中的细胞增殖分化、体轴发生和形态形成等多种细胞反应[19]。海胆中的miR-2007和miRDeep2-35240是2个最早被发现参与Wnt信号通路调控的miRNAs。在紫球海胆中,miR-2007的长度为25 nt,其种子序列为“-TAAAGTC-”,与Wnt信号通路中的βcatenin基因的3'非编码区有2个结合位点(图2A),miRDeep2-35240的长度为25 nt,其种子序列为“-TAACGTG-”,与紫海胆Wnt信号通路中的β-catenin基因的3'非编码区有1个结合位点(图2A)。有研究显示,阻断miR-2007和miRDeep2-35240与β-catenin基因的结合,会导致紫球海胆个体的肠和食道肌肉组织的发育缺陷[20]。值得注意的是,紫球海胆miRDeep2-35240和人类的miR-25有着相同的“种子序列”,且两者都可以影响Wnt信号通路中β-catenin基因的表达[20-21],提示海胆中的miRDeep2-35240与人类的miR-25可能具有相似的调节功能,但两者的系统进化轨迹仍需进一步的研究和探索。miR153-3p、miR-2002、miR-200和miRDeep2-30364是最新被证实参与调控海胆早期发育过程中Wnt信号通路的miRNAs,它们可分别调控海胆Wnt信号通路中的编码不同Dvl蛋白亚型的基因的表达。Dvl蛋白是Wnt信号通路中的关键蛋白,起着将细胞信息传递到各种发育途径中的重要作用,在海胆中,Dvl蛋白有4个亚型,分别由dvl5a、dvl1、dvl4a和dvl4b基因编码[22]。在紫球海胆中,miR-153-3p的长度为25 nt,其种子序列为“-TAAAAA-”,与紫球海胆Wnt信号通路中的dvl5a基因的3'非编码区有2个结合位点(图2B);miR-2002的长度为25 nt,其种子序列为“-CTTATGT-”,与紫球海胆Wnt信号通路中的dvl4a和dvl1基因的3'非编码区均有1个结合位点(图2C)。紫球海胆的miR-200的长度也为25 nt,其种子序列为“-GTATGAT-”,与紫球海胆Wnt信号通路中的dvl4b基因的3'非编码区有1个结合位点(图2D)。miRDeep2-30364的种子序列为“-TAACGTG-”,其在紫球海胆Wnt通路中dvl5a和dvl1基因的3'非编码区均有1个结合位点(图2B、E)。进一步的研究指出,阻断miR153-3p、miR-2002、miR-200和miRDeep2-30364与其靶基因dvl5a、dvl4a、dvl1和dvl4b的结合,可能会干扰紫球海胆Wnt信号的正常转导,对紫球海胆浮游幼体的骨针长度、初级间充质细胞(primary mesenchyme cell,PMC)的形态、肠道形态和纤毛均产生不同程度的影响[22]。此外,miR-2007也可以抑制紫球海胆Wnt信号通路中Dvl蛋白亚型编码基因dvl5a、dvl4a和dvl4b的表达,进而导致紫球海胆Wnt信号通路紊乱[22](图2C、E)。
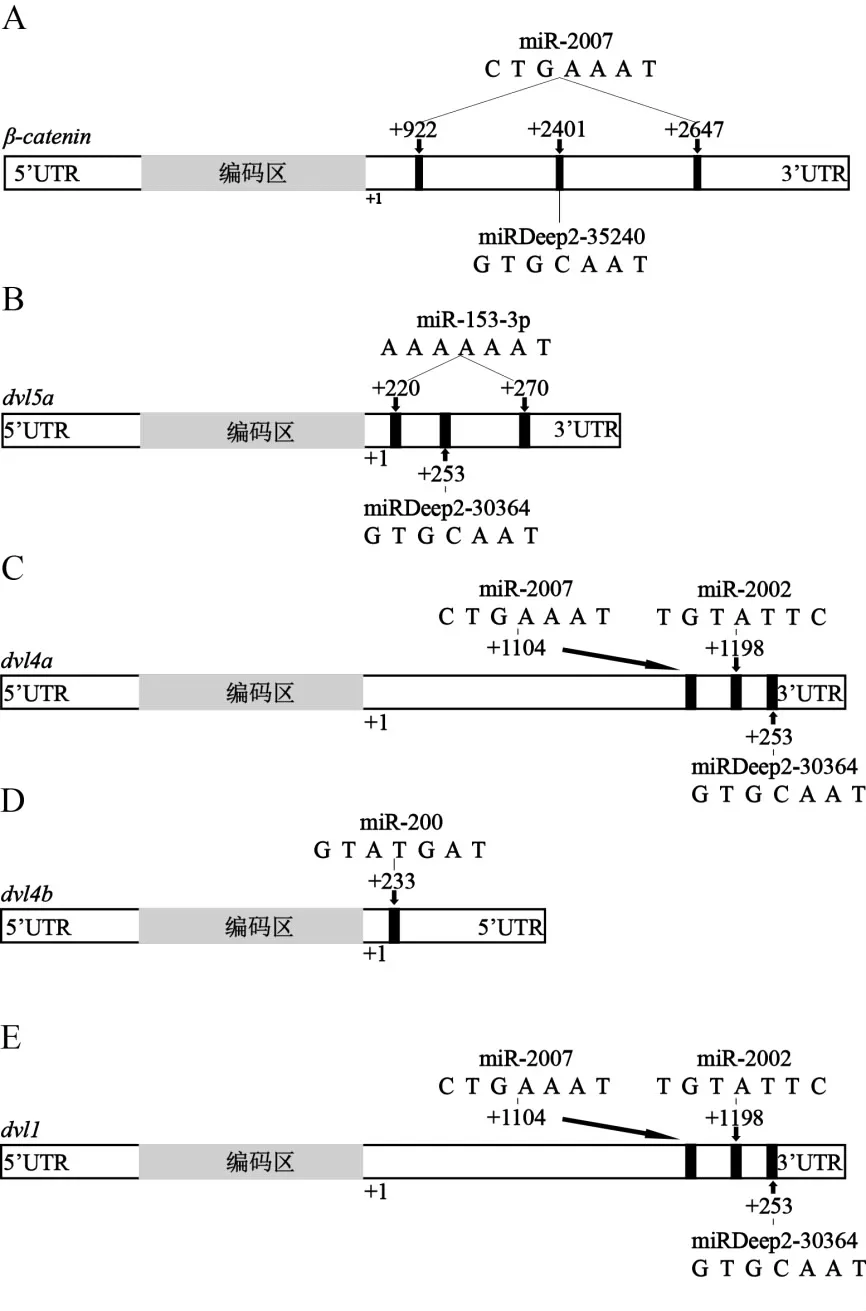
图2 miRNAs与Dvl蛋白亚型基因的结合位点
miRNAs除了通过调控Wnt信号通路影响海胆胚胎的发育外,还可通过其他途径对海胆的胚胎发育产生影响。比如,miR-31是一种高度保守的miRNA,其成熟序列的长度在21~24 nt之间并有长度为16 nt的保守碱基,在脊椎动物的成骨细胞分化中发挥着重要的作用[23]。在海胆中,miR-31不仅在海胆的早期胚胎发育中具有较高的相对表达水平,在海胆生活周期的其他阶段也保持着较为广泛的表达。在紫球海胆中,miR-31可以通过种子序列“-TCTTGCC-”与pmar1、alx1、snail和vegfr7基因的3'非编码区域完全结合来直接抑制这4个基因的表达,实现对紫球海胆初级间充质细胞的形态形成和骨骼形成的调控,进而影响紫球海胆的胚胎发育过程[24]。有趣的是,在海胆骨骼形成中发挥重要作用的除vegfr7基因外,还有与其同属于同一家族的vegf3基因[25]。虽然vegf3基因的非编码区并不存在与miR-31的结合位点,但是,当敲除miR-31基因后,紫球海胆胚胎中的vegf3基因的转录产物又会显著增加[24],因此推测miR-31可能是通过间接方式调控外胚层中vegf3基因的表达,但其具体的调控机制仍需进一步的研究。
目前,关于miRNAs调控海参生长发育方面的研究较少。现有报道显示,刺参中的miR-10a-5p、miR-10a和miR-200-3p可能会通过调控其潜在的靶基因acadl和hhadh的相对表达,影响刺参体内线粒体中的脂肪酸β-氧化的速度,进而对刺参的生长发育产生相应的影响[26-27]。
2.2 参与调控病原体免疫反应
海胆与海参都是推演先天免疫系统起源和进化的重要模式生物,但是,由于海参种类在养殖规模和经济价值上要高于海胆类,目前关于海胆和海参中参与病原体免疫防御反应的miRNAs多集中于海参类,尤其是重要的养殖种类——刺参。越来越多的证据表明,miRNAs对海参先天免疫防御的调控主要是通过调控海参体内补体系统(complement system)和Toll样受体(Toll like receptor,TLR)信号通路中的相关因子而实现的。其中,补体系统是海参先天免疫的重要组成部分,在消除病原菌和维持内环境稳态方面发挥着重要作用,而刺参的C3补体(complement component 3,C3)则是刺参补体系统的中心枢纽[28];而刺参体内的TLR信号通路则是通过特异性衔接子募集来激活核因子-κB(nuclear factor-kappa B,NF-κB)、干扰素调节因子(interferon-regulatory factors,IRFs)和肿瘤坏死因子(tumor necrosis factors,TNFs)等先天性免疫相关因子,参与和调控刺参的免疫应答反应[29]。
miR-133和miR-137是最早被证实参与调控刺参补体系统中心分子——C3补体的重要miRNAs。在刺参中,miR-133的长度为23 nt,其种子序列为“-UUG GUCC-”,与刺参补体系统中c3基因的3'非编码区有1个结合位点(图3)。利用脂多糖(lipopolysaccharide,LPS)对刺参进行免疫刺激后发现,在LPS刺激的第6~12 h中,刺参体内的miR-133的相对表达呈上调趋势且在第9 h时达到峰值,但在LPS刺激的第9~12 h中,刺参体内的c3的相对表达却呈现下调趋势[30],即,在LPS刺激后的第9~12 h中,刺参体内的miR-133和c3的相对表达呈负相关,据此推断,miR-133可能通过靶向抑制刺参体内c3的转录来调节补体系统的免疫应答。miR-137是一种通过控制细胞周期和细胞分化过程来影响动物疾病发展的miRNA[31]。在刺参中,miR-137的长度为22 nt,其种子序列为“-AUUGCUU-”,与刺参的c3基因的3'非编码区有1个结合位点(图3)。研究显示,在LPS刺激9 h后,刺参体内的miR-137的相对表达呈现下调趋势,进一步的分析发现,miR-137可以抑制刺参体腔细胞中c3基因的mRNA的翻译,推测miR-137可通过靶向调节C3蛋白的表达来参与刺参的免疫应答反应[32]。此外,最新的研究还证实,刺参中的miR-2004和miR-2006也可以通过靶向调节c3基因来参与免疫反应[32]。上述研究结果,不仅在一定程度上揭示了miRNAs对基因调节的多向性和刺参(乃至棘皮动物)先天免疫的复杂性,同时也为不同miRNAs可以执行相同功能来使基因组功能最大化提供了有力证据。

图3 miR-133、miR-137与c3基因的结合位点
在TLR信号通路调控方面,miR-200和miR-2008被证实可分别靶向调控2种TLR信号通路相关分子——tollip[33]和tlr3[34]参与刺参的先天免疫过程(图4)。在刺参中,miR-200是一种长为23 nt的小分子RNA,其种子序列为“-AAUACUG-”位于5'端的2~8位,与TLR信号通路中tollip基因3'非编码区有1个结合位点(图5)。研究表明,miR-200可以靶向TLR通路的成员来参与TLR信号的级联调控[35]。例如,在被灿烂弧菌(Vibrio splendidus)感染的刺参个体和被LPS刺激的刺参初级体腔细胞(primary coelomocytes)中,miR-200和Toll相互作用蛋白(toll-interacting protein,Tollip)在所有检测的时间点均呈正表达相关,这一结果说明,刺参中的miR-200具有增强体腔细胞的抗菌活性和抑制LPS启动的双重功能[33]。刺参中的miR-2008的长度为21 nt,其种子序列为“-UCAGCCU-”,与刺参抗细菌感染关键基因——tlr3的3'非编码区有1个结合位点(图5),是海参皮肤溃疡综合征(sea cucumber skin ulceration syndrome,SUS)爆发的重要调节因子[34]。研究发现,在灿烂弧菌感染后的第12 h,刺参中的miR-2008的相对表达呈显著增加趋势而tlr3的相对表达则呈现显著降低趋势[34],提示在受细菌感染的刺参中,miR-2008可能通过靶向调控与TLR途径相关的基因来参与免疫应答,但其具体的机制尚待深入研究。除了上述miRNAs外,miR-133、miR-31和miR-210也被证实可以通过靶向调控irapk-1、p105和toll的表达来介导刺参中TLR信号的级联激活(图4)[34,36]。
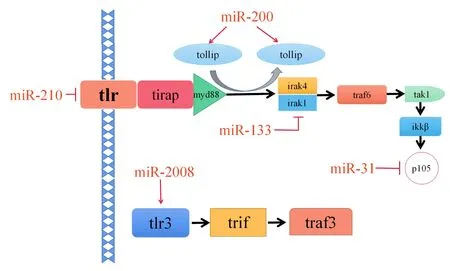
图4 miRNAs参与TLR信号通路相关基因调控模式图

图5 miR-200与tollip基因及miR-2008与tlr3基因的结合位点
现有研究显示,miRNAs对海参的免疫调节机制非常复杂,除上述2种途径外,miR-92a对14-3-3ζ的调节作用也说明miRNAs可以通过参与活性氧(reactive oxygen species,ROS)的调节和细胞凋亡途径来影响海参的免疫反应[37]。最近还有研究发现,一些miRNA可能对患海参皮肤溃疡综合征的刺参的病原菌附着和识别,信号转导和病变修复起重要作用[38]。这对海参的先天免疫应答及机制的研究具有重要的学术意义,同时也对海参产业的可持续发展性有着重要的意义。
2.3 参与响应环境应激
环境应激是由于外界环境条件改变而引起的生物个体生理代谢发生变化的一种反应,也是生物对生存环境变化产生的适应的前提和基础。海洋是海胆和海参类动物赖以生存的媒介,半开放式的循环系统决定了海胆和海参类动物时刻与海水发生着液体交换,因此,海洋环境因子的而变化对海胆和海参类动物的生存、生理代谢和种群规模等都具有重要影响。
海水盐度(sea-water salinity,SS)指的是海水质量与水中可溶固体质量的比,是影响海胆和海参类生存的重要环境因子之一。有研究显示,海胆和海参类动物主要通过渗透压调节来适应海水盐度的变化。研究证实,刺参中的miR-10具有1个长度为7 bp的种子序列“-UGUCCCA-”可以通过与tbc1d5基因的3'UTR相结合,以实现对tbc1d5基因的转录进行负调控[39]。TBC1D5不仅是细胞外环境中内体运输与应激性自噬之间的关键分子开关,还参与了反向转运(antiport)和葡萄糖摄取等生理反应[40],这一结果提示,miR-10在刺参渗透压调控方面可能发挥重要作用。Xian等[41]的研究表明,盐度胁迫会影响刺参体内K+和Cl-的浓度,此外,向盐度胁迫处理后的刺参体内注射miR-10的模拟物和抑制剂都会对刺参体内的K+和Cl-浓度产生影响[39],提示,miR-10在刺参响应盐胁迫和维持细胞稳态方面具有重要意义。此外,有研究表明,与自然海水盐度(SS=32)相比,低盐度胁迫(SS=18)会诱导刺参体内的miRNAs出现差异表达,其中,miR-124、miR-2010和miR-2013的相对表达量在低盐胁迫组呈下调趋势,而miR-2010、miR-278-3p和miR-2005的相对表达量则在低盐胁迫组呈上调趋势,对这些差异表达的miRNAs及其靶基因进行研究推测,刺参可能利用碳水化合物和脂肪酸所代谢的能量通过改变氨基酸代谢、离子通道和转运蛋白等方式来应对低盐度胁迫[42]。
海胆和海参类动物属于海洋耗氧生物,因此海水的溶氧量(dissolved oxygen,DO)也是影响海胆和海参类动物生存和生理代谢过程的重要海洋环境因子。Huo等[43]利用比较miRNA组方法研究了不同溶解氧水平下刺参呼吸树中miRNAs的差异表达,结果发现,与对照组(DO=8 mL/L)相比,在严重缺氧条件下(DO=2 mL/L),miR-31-5p和miR-184的相对表达量分别上调了3.2倍和3.7倍。进一步分析发现,miR-31-5p可以在人类(Homo sapiens)大肠癌中表皮生长因子受体(epidermal growth factor receptor,EGFR)下游的信号转导途径发挥作用[44],而egfr基因又与缺氧相关,提示,刺参体内的miR-31-5p可能通过靶向调控EGFR途径的关键信号分子的表达应对严重缺氧条件。在哺乳动物中,miR-184的过度表达不仅会在人类成神经细胞瘤细胞(neuroblastoma cells)中会引起细胞凋亡[45],还会在老年大鼠的肾小球系膜细胞(glomerular mesangial cell)中加剧氧化损伤并抑制细胞内的自噬(autophagy)反应[46],结合低氧条件下刺参呼吸树中miRNAs的差异表达结果,推测刺参可通过miR-184的差异表达来靶向调控细胞增殖、氧化损伤和自噬相关等生理过程应对和适应低氧胁迫。
海水温度(sea-water temperature,ST)是表示海水热力状况的一个物理量,是海洋生物生长繁殖的关键环境限制因子之一,主要受太阳辐射以及海洋与大气热交换的作用而发生改变[47],大量研究已经证实,环境温度的改变不但能影响海胆和海参类动物的生长发育、摄食行为、生理免疫,还会影响其新陈代谢和基因的表达[48-49]。Li等[49]发现,与对照组(16℃)相比,高温(26℃)处理6 h后,刺参的肠组织中的miR-493-3p和miR-2981的表达量均呈显著上调趋势,其中,miR-493-3p可通过靶向调控ythdf2基因的表达而激活细胞的增殖和迁移[50];而miR-2981则可通过靶向调控scl13a5基因增加细胞中β-氧化的速率[49,51]。因此,上述结果提示,刺参可能通过改变其体内的细胞活动提高自身能量代谢来应对不同程度的高温胁迫。
3 总结
综上可以看出,目前关于海胆和海参乃至棘皮动物中miRNAs的研究仍相对滞后。其中,对于海胆类miRNAs的研究多局限于探究其对胚胎发育过程的调控,而对海参类miRNAs的研究则多强调其在先天免疫防御和应对环境胁迫方面的作用。此外,除紫球海胆和刺参外,其他种类海胆和海参中miRNAs的相关信息仍相对匮乏。因此,在今后的研究中,首先可以利用高通量测序技术和生物信息分析方法,拓宽海胆和海参miRNAs检测的物种范围,大规模获取其他海胆、海参种类中miRNAs的序列和结构信息,进一步丰富和扩充海胆和海参miRNAs数据库的基础资料,同时,分析海胆和海参中miRNAs之间的系统进化关系,进一步系统和深入地了解海胆和海参,乃至棘皮动物中miRNAs的演化关系。此外,通过多组学联动分析技术,进一步筛选和鉴定与海胆和海参中miRNAs具有潜在靶向关系的候选基因,建立miRNAs及其靶基因的互做调控网络,深入系统开展不同发育阶段、不同地理区域以及不同病理生理状态下海胆和海参中miRNAs及其靶基因的表达规律及靶向互做模式,为进一步深入阐明海胆和海参中miRNAs的生物调控功能,全面挖掘海胆和海参中具有学术意义和产业价值的miRNAs奠定一定的基础。
