程序性细胞死亡蛋白1配体抑制剂Atezolizumab引起免疫相关性心肌炎一例报道
2021-03-26龙浪罗锋王力鄢国清
龙浪,罗锋*,王力,鄢国清
免疫检查点抑制剂在多种实体瘤中被证实具有抗肿瘤活性,其作用机制为通过激活机体自身免疫系统,产生持久的抗肿瘤反应。目前应用比较广泛的免疫检查点抑制剂主要包括细胞毒性T淋巴细胞相关抗原4(CTLA-4)和程序性细胞死亡蛋白1及其配体(PD-1/PD-L1)抑制剂。Atezolizumab是一种人源化免疫球蛋白G(IgG)1单克隆抗体,通过阻断PD-L1与PD-1结合,减少肿瘤微环境中的免疫抑制信号,从而增强T淋巴细胞介导的抗肿瘤免疫[1]。
免疫检查点抑制剂在激活自身免疫系统杀伤肿瘤细胞的同时也会产生一系列毒副作用,有些甚至是致命的,称为免疫相关不良事件(irAE),主要涉及肠道、皮肤、内分泌腺、肝脏和肺,也包括免疫相关性心肌炎[2]。免疫相关性心肌炎的发生率小于1%,死亡率却高达39.7%[3]。因此,有必要提高对这一罕见并发症的认识,以便早期发现,及时治疗。本文报道1例转移性B3型胸腺瘤患者使用Atezolizumab后出现免疫相关性心肌炎,以期提高临床诊治水平。
1 病例简介
患者,女,35岁,2010年7月因“气促”就诊于四川大学华西医院,行胸部计算机断层扫描(CT)示:前上纵隔不规则软组织肿块影,包绕相邻大血管,左侧胸膜明显增厚。纵隔肿块穿刺活检证实为AB型胸腺瘤。患者于2010年12月行纵隔肿瘤+胸膜转移瘤切除术,术后病理检查提示AB型胸腺瘤。术后患者规律复查,未见复发转移。2018年3月患者因左侧腰部疼痛入院行胸腹部CT示:左侧胸壁见软组织密度肿块,左侧胸膜多发结节,左侧膈肌抬高。2018年5月行左侧胸膜结节+部分心包+部分膈肌+胸壁肿瘤切除术,术后病理检查提示B3型胸腺瘤(见图1),免疫组化示:肿瘤细胞PD-L1(+,>80%)(见图2)。患者肿瘤病灶切除完整,术后无可评估病灶,于2018-08-28、2018-09-18在外院接受单药Atezolizumab(1 200 mg,每3周1次)辅助治疗。在接受第二周期Atezolizumab治疗结束后第3天,患者出现胸闷伴乏力就诊于本院,实验室检查显示肌酸激酶(CK)水平显著升高2 251 U/L(参考范围20~140 U/L),肌钙蛋白T 292.6 ng/L(参考范围<0.02 ng/L),脑钠肽(BNP)168 ng/L(参考范围0~88 ng/L),肌红蛋白901.5 ng/ml(<58 ng/ml),肌酸激酶同工酶(CK-MB)59.67 ng/ml(参考范围<2.88 ng/ml),丙氨酸氨基转移酶(ALT)56 U/L(参考范围<40 U/L)和天冬氨酸氨基转移酶82 U/L(参考范围<35 U/L)。自身免疫性肝炎抗体、肝炎病毒、巨细胞病毒、EB病毒检测均为阴性,心电图、超声心动图及甲状腺功能未见明显异常,心脏磁共振(MRI):左心室心肌T2信号稍增高,心肌轻度水肿(见图3)。患者被诊断为急性免疫相关性心肌炎,给予甲泼尼龙80 mg/d(第1~3天),40 mg/d(第4~7天),实验室检查提示肌钙蛋白T呈现下降趋势(见表1)。请心内科会诊后,转入心内科继续就诊,给予酒石酸美托洛尔控制心率,辅酶Q 10片及盐酸曲美他嗪片营养心肌,并停用激素。在停用激素的4 d中,患者临床症状不断恶化,出现阵发性心悸伴乏力、颈部无力、四肢肌肉酸痛、心肌酶学持续上升,再次给予甲泼尼龙80 mg/d,2 d,并行多学科讨论(MDT),考虑免疫相关性心肌炎合并肌无力征象,建议行激素治疗,同时完善乙酰胆碱受体抗体,特异性肌炎抗体检查,给予地塞米松20 mg/d(第1~3天),15 mg/d(第4~6天),12.5 mg/d(第7~9天),并逐渐减量。经激素治疗后患者心肌酶学指标有所改善,临床症状改善不明显,全身无力症状持续存在,乙酰胆碱受体抗体阳性,特异性肌炎抗体全阴性。联合心内科、肿瘤科及神经内科行第二次MDT讨论,考虑患者重症肌无力诊断明确,给予溴吡斯的明40 mg,3次/d,甲泼尼龙40 mg/d(2~4周逐渐减量),加用免疫抑制剂硫唑嘌呤50 mg,1次/d,丙种球蛋白20 mg/d,治疗5 d,并行血浆置换。患者症状明显好转,心肌酶学逐渐下降,随后6周内,患者逐渐停用激素及免疫抑制剂,长期口服溴吡斯的明45 mg,4次/d,心肌酶学未再反弹,症状好转。在免疫相关不良事件后1年,患者复查胸腹部CT未见肿瘤复发转移,心电图、心脏彩超、心肌酶学未见异常。

图1 病理诊断为B3型胸腺瘤(HE染色,×200)Figure 1 Pathological diagnosis of type B3 thymoma
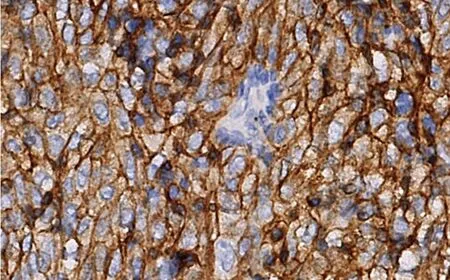
图2 免疫组化示肿瘤细胞PD-L1(+,>80%)Figure 2 Immunohistochemistry shows PD-L1 on tumor cells
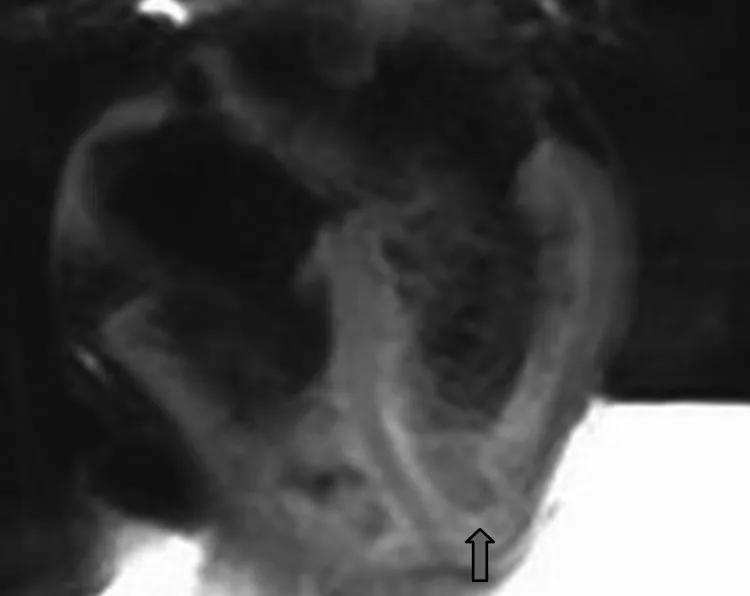
图3 心脏MRI提示左心室心肌轻度水肿Figure 3 Cardiac MRI reveals mild left ventricular myocardial edema
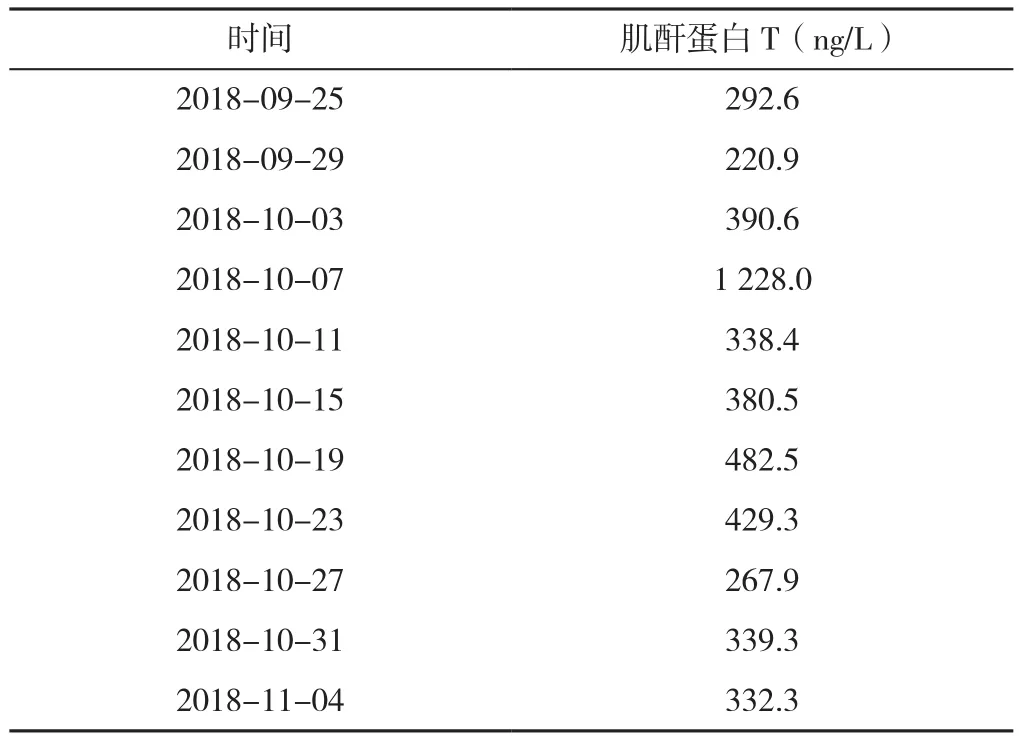
表1 治疗过程中肌钙蛋白T的变化Table 1 The changes of troponin T during treatment
2 讨论
免疫检查点抑制剂是一种有效的抗肿瘤手段,然而在应用的过程中也出现了一些独特的irAE。目前,很多关于免疫检查点抑制剂的临床试验没有对心脏参数和肌钙蛋白的水平进行常规监测。因此,与免疫检查点抑制剂相关的心脏毒性在真实世界中的发生率还不得而知。MAHMOOD等[4]在观察了散发的免疫检查点抑制剂相关心肌炎的病例后,创建了一个多中心的研究来观察免疫相关性心肌炎的特点。作者于2013年11月—2017年7月收集了35例免疫检查点抑制剂相关性心肌炎患者,免疫相关性心肌炎的患病率为1.14%,中位发病时间在第一次使用免疫检查点抑制剂后的34 d(21 d,75 d),其中71%为男性患者,年龄为(65±13)岁,54%的患者未合并其他免疫相关不良反应,同时观察到免疫相关性心肌炎在免疫联合治疗或合并糖尿病的患者中更常见。
免疫相关性心肌炎的发病机制目前尚不清楚,潜在的机制可能是过度激活的自身免疫细胞侵入心肌组织导致连续的自我攻击。CHEN等[5]报道1例使用Nivolumab治疗B3型胸腺瘤后出现免疫相关性心肌炎,心肌活检示广泛的心肌细胞损伤、T淋巴细胞浸润,PD-L1在受损的心肌细胞高表达。在动物实验小鼠模型中观察到T淋巴细胞介导的心肌炎,心肌细胞表面PD-L1的表达上调,这可能是一种保护机制,限制免疫介导的心肌损害,然而这种保护机制可能会被抗PD-L1抗体抵消,导致免疫相关性心肌炎[6]。MATSON等[7]报道了1例Nivolumab治疗非小细胞肺癌导致免疫相关性心肌炎,对心肌浸润的T淋巴细胞进行克隆性分析,发现与肿瘤中浸润的T淋巴细胞完全相同。推测心肌细胞与肿瘤细胞之间具有相似的靶抗原,免疫检查点抑制剂在抗肿瘤的同时引起免疫相关性心肌炎。
免疫相关性心肌炎的诊断目前尚无统一的标准,对于这种罕见但潜在致命的并发症,如果临床怀疑应该快速诊断。由于没有典型的临床表现,对于正在使用或者使用过免疫检查点抑制剂的患者,如果出现胸部不适、周围组织水肿、呼吸困难、疲劳、心悸、心源性休克、心搏骤停等任何症状均应考虑免疫相关性心肌炎的可能[8]。对于情况稳定的患者,应详细询问病史并行心电图及心肌标志物的检测;对于情况不稳定,合并心源性休克、心搏骤停的患者紧急抢救并请心脏内科/肿瘤科会诊[9]。当患者出现临床表现时,94%的患者肌钙蛋白升高,89%的患者心电图异常,66%的患者钠尿肽异常,51%的患者左心室射血分数(LVEF)正常[4]。心内膜心肌活检是诊断的金标准,心脏磁共振T1加权和T2加权图像以及晚期钆增强的灵敏度和特异度分别为76%和96%[8]。同时还应与病毒性心肌炎、自身免疫性心肌炎、冠状动脉疾病、肺栓塞、肺炎以及其他心脏相关疾病等相鉴别[10]。这些鉴别诊断需要详细地询问病史,仔细的体格检查,以及一些客观的实验室检查来协助诊断。
本例患者在使用PD-L1抑制剂Atezolizumab后,出现胸闷乏力等症状,心肌酶学提示肌钙蛋白升高,心脏磁共振提示心肌水肿,既往无心脏病病史及自身免疫性疾病,激素治疗后心肌酶学有所下降,停药后心肌酶学出现反弹,症状逐渐加重,再次使用激素、免疫抑制剂、丙种球蛋白、血浆置换等治疗,患者症状好转,心肌酶学降低,这些均支持患者为Atezolizumab所导致免疫相关性心肌炎。
治疗方面缺乏有效的指南,与其他irAE的治疗方式相同,给予类固醇激素治疗。由于病情呈暴发性进展,怀疑存在免疫相关性心肌炎时应及时治疗,迅速给予大剂量皮质类固醇(1~2 mg/kg强的松或者甲泼尼龙1 g/d),对大剂量类固醇激素没有立即反应的患者,应根据一般心肌炎的治疗策略考虑血浆置换、大剂量静脉注射免疫球蛋白、抗胸腺球蛋白或者使用其他免疫抑制药物如英夫利昔单抗、霉酚酸酯、他克莫司等[11]。考虑到部分免疫检查点抑制剂的t1/2较长,对于经过激素治疗临床症状改善的患者,应在至少4~6周的过程中逐渐减量,避免症状出现反弹。最近ESFAHANI等[12]报道了1例黑色素瘤患者在使用Pembrolizumab治疗过程中出现免疫相关性心肌炎,经过大剂量激素、免疫抑制剂治疗后,症状进一步恶化,给予患者单剂量针对CD52的人源化单克隆抗体Alemtuzumab 30 mg,用于诱导免疫细胞快速溶解,这种治疗的目的是快速清除T淋巴细胞。经流式细胞检测患者T淋巴细胞迅速耗尽,解除了心脏毒性,随后患者心肌炎症状缓解,各项实验室检查指标逐渐正常化。SALEM等[13]报道了1例肺癌患者接受Nivolumab治疗后出现免疫相关性心肌炎,在接受大剂量激素和血浆置换后,患者的肌钙蛋白T持续上升,临床症状加重,给予患者CTLA-4激动剂Abatacept,抑制CD28-B7介导的T淋巴细胞共刺激,导致T淋巴细胞系统失能,逆转对免疫检查点的阻断作用,发挥拮抗irAE的作用,患者肌钙蛋白水平迅速下降,临床症状逐渐减轻。以上两例个案报道也为临床抢救糖皮质激素难治性免疫相关性心肌炎提供了案例支持。本例患者在诊断免疫相关性心肌炎后给予了激素治疗,停药后病情呈爆发性进展,再次给予激素联合免疫抑制剂、丙种球蛋白,并且进行血浆置换,患者症状明显好转,心肌酶学逐渐下降。因此,激素的使用必须持续并且减量应缓慢。由于免疫相关性心肌炎的发病率低,目前缺乏前瞻性或者回顾性研究来比较一线使用激素联合免疫球蛋白、血浆置换、免疫抑制剂等方式治疗免疫相关性心肌炎能否降低其死亡率。对于这种高病死率的疾病,目前迫切需要有效的指南来指导其治疗。
关于免疫相关性心肌炎的预后,FAN等[14]对2004年1月—2018年6月美国食品药物管理局关于真实世界中免疫检查点抑制剂导致心肌炎数据的统计分析得出,免疫相关性心肌炎通常提示预后不良,约一半(51.11%)的病例死亡。在单药治疗中,使用Nivolumab后发生心肌炎的患者死亡风险相对较高,125例中有63例(50.40%)死亡,而使用Atezolizumab后发生心肌炎的患者死亡风险相对较低,18例中有4例(22.22%)死亡,4例使用Avelumab发生心肌炎死亡患者中有3例(75.00%)死亡,3例使用Durvalumab发生心肌炎的患者中有2例(66.67%)死亡;在联合治疗中,使用Ipilimumab+Nivolumab联合治疗发生心肌炎的患者73例中48例(65.75%)死亡,使用Ipilimumab+Pembrolizumab的患者仅有4例心肌炎,无死亡事件。MAHMOOD等[4]的多中心研究表明,及时开始大剂量静脉注射甲泼尼龙能够改善免疫检查点抑制剂相关心脏不良事件的预后。
免疫相关性心肌炎起病早、无典型临床症状,病情进展迅速,死亡率高。在进行免疫检查点抑制剂治疗时早期筛查非常必要,应用过程中鼓励每周监测心电图及心肌标志物,对于怀疑存在免疫相关性心肌炎的患者及时足量给予类固醇激素,情况严重者应协同心内科医生建立多学科共同治疗模式,对于发生过免疫检查点抑制剂相关心肌炎的患者应中止免疫抑制剂治疗,并避免重新启动免疫检查点抑制剂治疗[9]。
作者贡献:龙浪负责论文撰写和修订;罗锋负责论文指导,对文章整体负责;王力负责收集资料及图片;鄢国清负责查阅文献。
本文无利益冲突。
