间歇期痛风患者中性粒细胞/淋巴细胞比值的变化及其临床意义研究
2021-03-26杨颜瑜柳涛红王聃黄玉琴何欣青玉凤张全波
杨颜瑜,柳涛红,王聃,黄玉琴,何欣,青玉凤,张全波*
痛风是指单钠尿酸盐晶体沉积于关节滑液或其他组织,导致反复发生关节红肿热痛及组织损伤的一种慢性疾病[1]。其中,高尿酸血症与痛风的发生发展密切相关。当血清尿酸盐>408 µmol/L时,在适宜的温度与pH值下可形成单钠尿酸盐晶体,其可触发机体免疫系统,诱导NOD样受体蛋白3(nod-like receptor protein,NLRP3)炎性体激活和白介素1β(interleukin-1β,IL-1β)产生,从而导致痛风急性发作[2]。尿酸排泄方式主要分两种,其中经肾脏排泄量占尿酸排泄总量的2/3左右,1/3经肠道排泄[3]。目前,肾脏排泄不足被认为是痛风患者发生高尿酸血症的主要原因[4]。评价尿酸经肾脏排泄水平的指标主要包括24 h尿尿酸、尿酸清除率、肌酐清除率、尿酸排泄分数(fractional excretion of uric acid,FEUA)、尿尿酸/尿肌酐等。研究表明,FEUA是更能准确反应肾脏排泄功能的一个指标[5]。而在临床工作中,计算FEUA常需要患者留置24 h的尿液标本进行送检,其过程繁琐、所需时间较长、患者依从性较低,因此常不能获得满意的诊断结果。而中性粒细胞/淋巴细胞比值(neutrophil-to-lymphocyte ratio,NLR)作为炎性反应标志物,可参与多种疾病的发生发展[6-8](如癌症、类风湿关节炎、心血管疾病等),且相对于白细胞、中性粒细胞、单核细胞等炎性细胞更加稳定[9],在临床上检测方便、经济实用。有研究表明,NLR与痛风密切相关,对疾病活动与治疗后病情的评估有一定价值,是高尿酸血症的独立危险因素[10-11]。本文通过比较NLR在间歇期痛风患者及其在FEUA分期中的变化,探讨是否可为FEUA分期提供新的参考指标。
1 对象与方法
1.1 研究对象 选取2013年12月—2019年7月在川北医学院附属医院门诊及住院部就诊的386例间歇期痛风患者,其中男384例,女2例;年龄17~90岁,平均(45.0±16.0)岁;就诊前2周未接受过降尿酸治疗及服用影响尿酸代谢的药物(如利尿剂、喹诺酮、环孢素、阿司匹林等)。同时选择与痛风患者年龄、性别相匹配的154例健康体检者。纳入标准:(1)痛风患者均符合2015年美国风湿病学会/欧洲抗风湿病联盟(EULAR)的痛风分类标准[12];(2)有急性痛风性关节炎反复发作病史及高尿酸血症,目前处于疾病间歇期。排除标准:(1)药物、血液系统、肝肾疾病等引起的继发性痛风;(2)患有其他风湿性疾病;(3)患有恶性肿瘤;(4)有急性或慢性感染。本研究经川北医学院附属医院伦理委员会审批〔2019ER(A)017〕。研究对象均签署知情同意书。
1.2 方法 采用自行设计的量表收集研究对象的年龄、性别、身高、体质量、吸烟史(吸烟定义:每天≥1支烟,持续1年以上)、饮酒史〔饮酒定义:平均每日饮白酒(酒精含量50%以上)≥100 ml,持续1年以上〕、24 h尿量、24 h尿尿酸、24 h尿肌酐、血尿酸(UA)、肌酐(Cr)、FEUA、尿酸清除率、肌酐清除率、尿尿酸/尿肌酐、尿pH值、估算肾小球滤过率(eGFR)、首次就诊时的实验室检查〔包括白细胞计数(WBC)、中性粒细胞计数(GR)、淋巴细胞计数(LYM)、血小板计数(PLT)、平均红细胞体积(MCV)〕,所有研究对象低嘌呤饮食5 d后收集24 h尿液送检(弃掉前1 d早晨7:00排尿,然后收集至第2天早晨7:00的全部尿液)。其中386例间歇期痛风患者有206例完成了24 h尿液检查作为痛风组,154例健康体检者中有39例完成24 h尿液检查作为对照组。根据FEUA分型,FEUA<7%为排泄减少型,FEUA 7%~12%为混合型,FEUA>12%为生成增多型[13];收集不同分型痛风患者的受累关节数、痛风石、高原居住史、高血压、糖尿病、高脂血症、肾结石、痛风家族史情况。
1.3 研究方法 采用深圳迈瑞公司生产的全自动血细胞分析仪BC6900检测血常规,德国SIEMENS公司生产的全自动生化分析仪ADVIA-2400检测生化指标。采用化学法测定24 h尿量、尿尿酸及尿肌酐。
FEUA(%)=尿酸清除率(ml/min)/肌酐清除率(ml/min)×100%
尿酸清除率(ml/min)=尿尿酸(µmol/L)×每分钟尿量(ml/min)/UA(µmol/L)
肌酐清除率(ml/min)=尿肌酐(µmol/L)×每分钟尿量(ml/min)/Cr(µmol/L)。
eGFR 计 算[14]: 若 Cr≤ 0.9 mg/dl(80 µmol/L),eGFR=141×(Cr/0.9)-0.411×(0.993)年龄;若 Cr>0.9 mg/dl(80µmol/L),eGFR=141×(Cr/0.9)-1.209×(0.993)年龄
1.4 统计学方法 采用SPSS 22.0软件进行统计学分析。符合正态分布的计量资料采用(±s)表示,两组间比较采用成组t检验;非正态分布的计量资料以M(P25,P75)表示,组间比较采用Mann-Whitney U检验;计数资料以相对数表示,组间比较采用χ2检验;采用多因素Logistic回归分析探讨痛风的影响因素;相关性分析采用Spearman秩相性分析;采用受试者工作特征(receiver operating characteristic,ROC)曲线探讨NLR诊断痛风、不同FEUA分期的价值。以P<0.05为差异有统计学意义。
2 结果
2.1 386例痛风患者与154例健康体检者实验室检查结果比较 痛风患者WBC、GR、NLR均大于健康体检者,差异有统计学意义(P<0.05);痛风患者LYM、PLT、MCV与健康体检者比较,差异无统计学意义(P>0.05,见表1)。
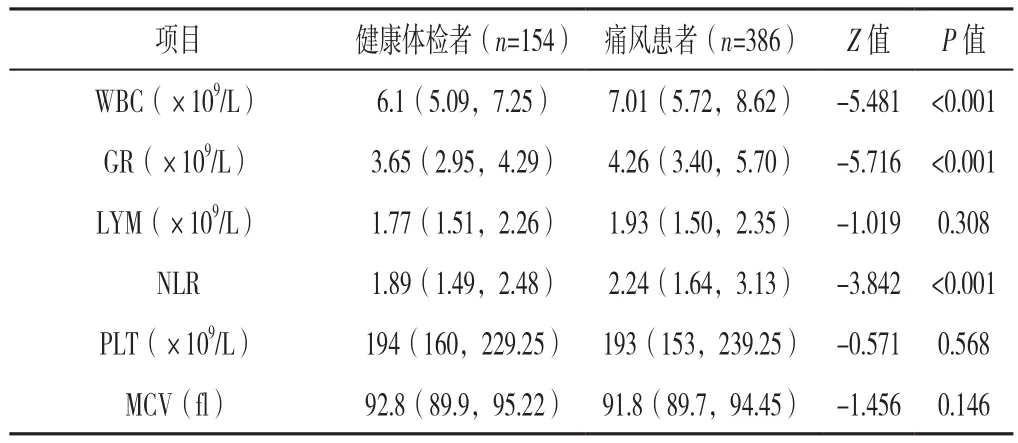
表1 痛风患者与健康体检者实验室检查结果比较〔M(P25,P75)〕Table 1 Comparison of laboratory test results between gout patients and healthy people
2.2 24 h尿液检查完成患者与未完成患者一般情况比较 完成24 h尿液检查的206例患者中男206例,女0例;平均年龄(43.8±15.4)岁。未完成24 h尿液检查的180例患者中男178例,女2例;平均年龄(46.4±16.7)岁。两组性别(χ2=2.301,P=0.217)、年龄(t=0.253,P=0.111)比较,差异均无统计学意义。
完成24 h尿液检查者NLR为2.52(1.79,4.16),未完成24 h尿液检查者NLR为2.41(1.90,3.29),两者相比,差异无统计学意义(Z=1.213,P=0.225)。
2.3 痛风组与对照组一般资料比较 痛风组体质指数(BMI)、吸烟史比例、饮酒史比例、24 h尿量、UA、GR、NLR高于对照组,FEUA、尿酸清除率、eGFR均低于对照组,差异有统计学意义(P<0.05);两组年龄、24 h尿尿酸、24 h尿肌酐、Cr、肌酐清除率、尿尿酸/尿肌酐、尿pH值、LYM比较,差异无统计学意义(P>0.05,见表2)。
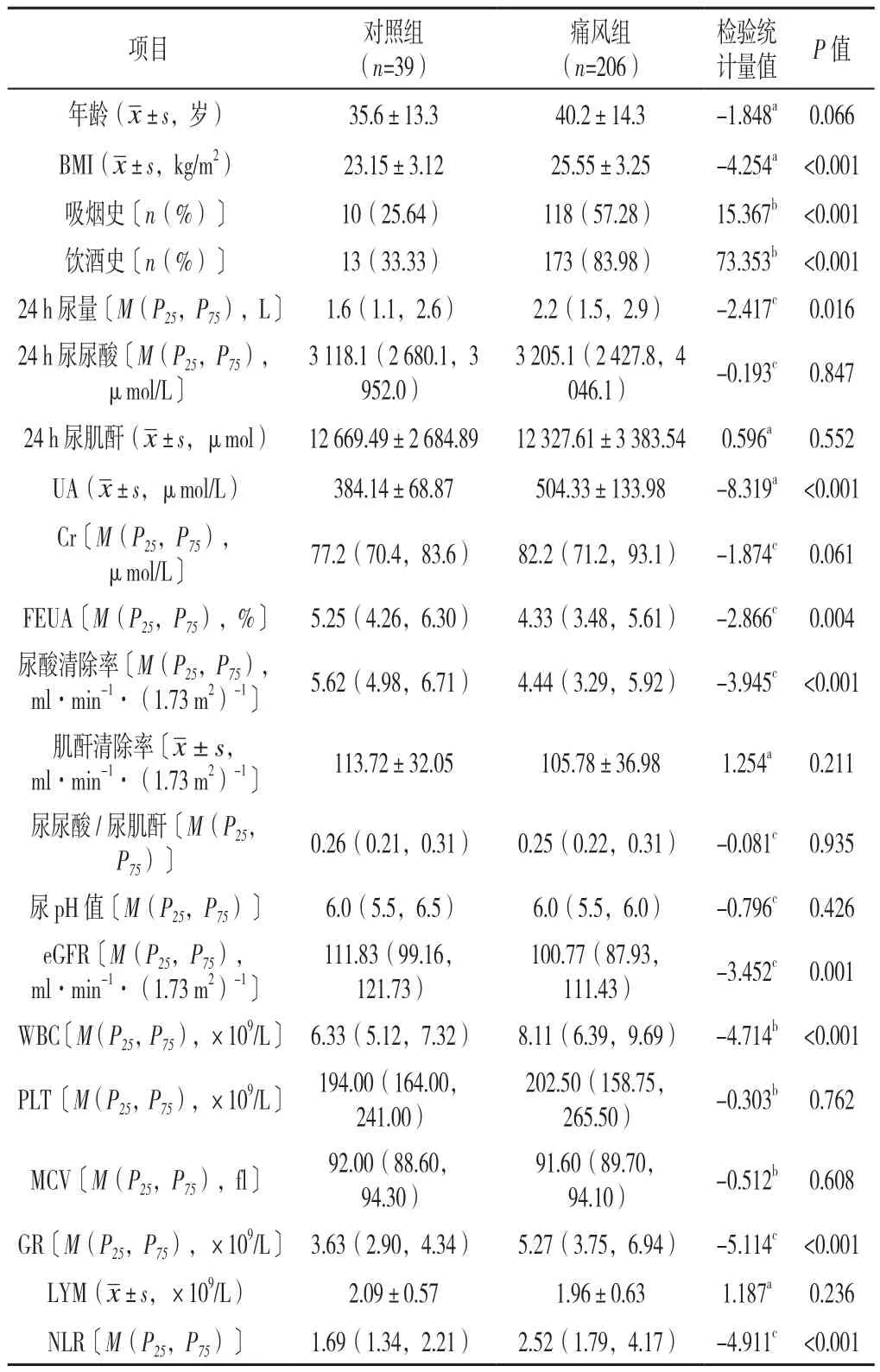
表2 痛风组与对照组一般资料比较Table 2 Comparison of general data between gout group and control group
2.4 痛风组NLR与尿酸排泄各指标的相关性分析 痛风患者NLR水平与FEUA呈正相关(rs=0.242,P<0.01),与肌酐清除率呈负相关(rs=-0.150,P<0.01),与尿酸清除率、UA无直线相关关系(P>0.05,见表3)。
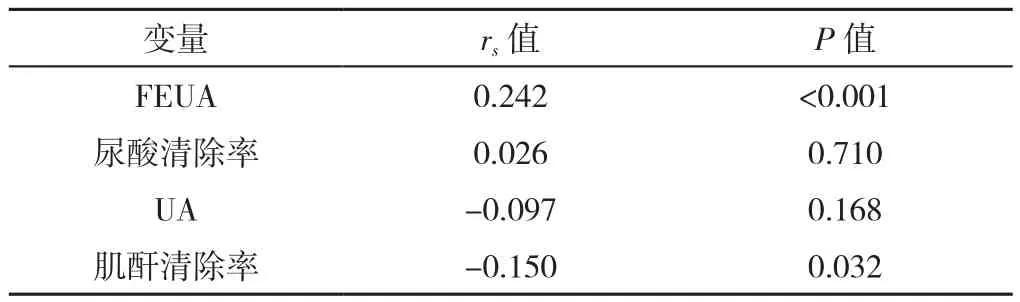
表3 NLR与尿酸排泄各指标的相关性分析Table 3 Correlation between NLR and uric acid excretion index
2.5 不同痛风分型患者一般资料比较 206例痛风患者中尿酸排泄减少型183例(88.8%),混合型15例(7.3%),生成增多型8例(3.9%)。不同痛风分型患者饮酒史比例、肾结石比例、24 h尿量、UA、Cr、FEUA、尿酸清除率、肌酐清除率、尿尿酸/尿肌酐、GR、NLR比较,差异有统计学意义(P<0.05)。尿酸排泄减少型患者饮酒、肾结石所占比例高于其余两型,差异有统计学意义(P<0.05,见表4)。

表4 不同痛风分型患者一般资料比较Table 4 Comparison of general data of patients with different gout types
2.6 痛风影响因素的多因素Logistic回归分析 以是否发生痛风为因变量(赋值:是=1,否=0),将单因素分析结果(表2)中有统计学意义的指标:BMI(赋值:实测值)、吸烟史(赋值:有=1,无=0)、饮酒史(赋值:有=1,无=0)、24 h尿量(赋值:实测值)、UA(赋值:实测值)、FEUA(赋值:实测值)、尿酸清除率(赋值:实测值)、eGFR(赋值:实测值)、NLR(赋值:实测值)为自变量纳入多因素Logistic回归分析,结果显示饮酒、24 h尿量、UA、FEUA、eGFR、NLR是痛风发生的影响因素(P<0.05,见表5)。
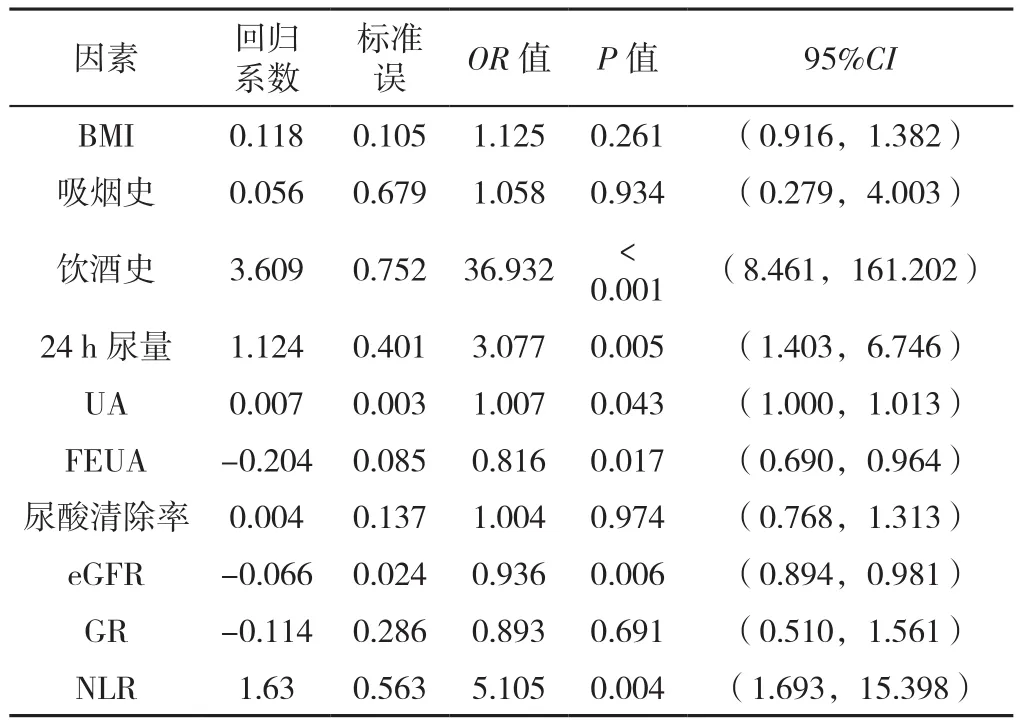
表5 痛风影响因素的多因素Logistic回归分析Table 5 Multivariate Logistic regression analysis of the influencing factors of gout
2.7 NLR诊断痛风的ROC曲线 NLR诊断痛风的ROC曲线下面积(AUC)95%CI为0.748(0.674,0.822),NLR最佳截断值为1.76时,其标准误最小(SE=0.038),灵敏度为78.16%,特异度为61.54%(见图1)。
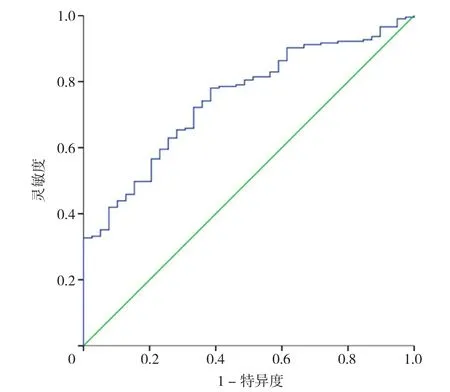
图1 NLR诊断痛风的ROC曲线Figure 1 ROC curve of NLR in diagnosis of gout
2.8 NLR诊断不同痛风分型的ROC曲线 NLR诊断排泄减少型痛风的AUC 95%CI为0.739(0.662,0.816),最佳截断值为1.76,灵敏度为77.60%,特异度为61.54%(见图2);NLR诊断混合型痛风的AUC 95%CI为0.758(0.601,0.915),最佳截断值为3.54,灵敏度为50.00%,特异度为100.00%(见图3);NLR诊断生成增多型痛风的AUC 95%CI为0.936(0.844,1.000),最佳截断值为4.07,灵敏度为75.00%,特异度为100.00%(见图4)。
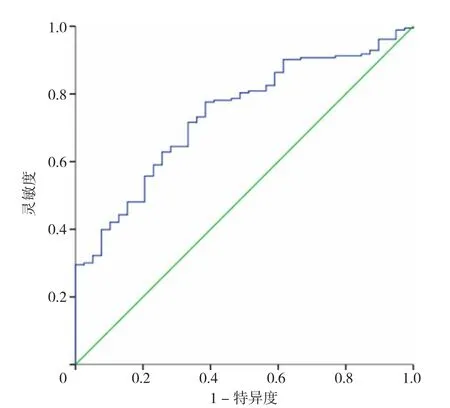
图2 NLR诊断排泄减少型痛风的ROC曲线Figure 2 ROC curve of NLR in diagnosis of reduced excretion gout
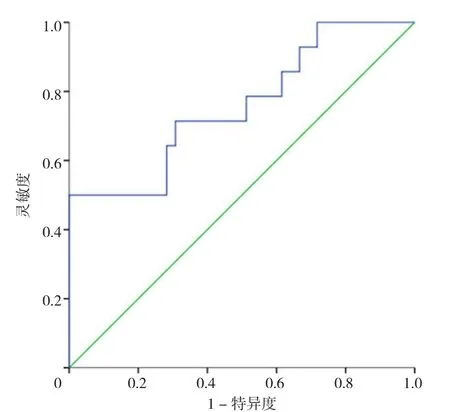
图3 NLR诊断混合型痛风的ROC曲线Figure 3 ROC curve of NLR in diagnosis of mixed gout

图4 NLR诊断生成增多型痛风的ROC曲线Figure 4 ROC curve of increased gout diagnosed by NLR
3 讨论
近年来,随着人们生活习惯和饮食结构的改变,痛风患病率呈逐年上升趋势。高尿酸血症作为痛风发生最重要的生化基础,其主要包括尿酸排泄减少和尿酸生成增多两种机制,是痛风发生发展的独立危险因素[15]。当其沉积析出尿酸盐(monosodium urate,MSU)晶体时,可触发机体的固有免疫系统,诱导炎性细胞因子产生,从而导致痛风发生[16]。在临床上常以24 h尿尿酸定量法作为区分高尿酸血症分型的指标,但其易受嘌呤摄入量、饮水、肾功能、尿量及血尿酸的影响,故现多采用FEUA来代替24 h尿尿酸定量法[13]。测定FEUA是指经肾小球滤过的UA最终从尿液中排出的百分率,可排除某些因素的干扰,能比较全面准确的反应肾脏UA的排泄情况[17]。但在实际工作中,其检测由于需留置24 h尿液,耗费时间长,患者依从性低、常失访,不能得到及时诊治。有研究表明,NLR可作为判断痛风患者疾病活动度与治疗情况的指标[10]。但目前尚无有关NLR与痛风患者FEUA的研究。
NLR作为全身炎症反应标志物,其稳定性高,方便易得,费用低廉,与疾病预后密切相关。中性粒细胞可通过释放活性氧(reactive oxygen species,ROS),抑制NO合成,直接释放ROS,导致肾小球动脉损伤和肾硬化,血清尿酸水平升高,而升高的血尿酸又可激活肾内肾素-血管紧张素-醛固酮系统(renal-angiotensin-aldosterone system,RAAS),诱导炎性细胞因子产生,引起血管内皮细胞功能障碍,加重肾功能损伤[18-19],两者相互作用,形成恶性循环,最终可导致痛风及慢性肾衰竭的发生。LYM降低与炎症相关,痛风无论是在急性发作期还是间歇期,都存在炎症状态,本研究结果显示,痛风组NLR水平高于正常对照组,与相关研究结果相似[20]。
本研究结果显示,在不同FEUA分期中,血清NLR水平差异明显,尿酸生成增多型NLR高于尿酸排泄减少型与混合型。原因可能是GR的增加可以促进细胞因子和趋化因子如白介素 1(interleukin-1,IL-1)/白介素 6(interleukin-6,IL-6)的上调,可损伤肾小球及肾小管间质,导致肾血管硬化、肾血流动力学异常、肾小球滤过率降低、肾小管重吸收功能下降[21-23],从而导致尿酸排泄增多。痛风具有明显性别差异,男性多于女性。有研究报道,雌激素可调节免疫系统,其增加可使中性粒细胞增多、淋巴细胞减少,从而导致NLR水平增高,并且雌激素具有促进尿酸排泄作用,故随着绝经期的到来,失去雌激素的保护作用,女性痛风发病率明显增加[24-26]。有研究表明,NLR与雄激素水平呈正相关,在痛风患者中,雄激素合成减少,使用雄激素治疗痛风患者后可使机体血尿酸水平显著减低,其作用机制可能是通过调整肾脏尿酸盐转运蛋白对尿酸的转运,促进尿酸排泄[27-29]。
本研究结果显示,痛风组BMI高于对照组。这与既往报道一致,痛风患者血尿酸水平与BMI呈正相关[15]。这可能与BMI可通过介导胰岛素抵抗导致机体血尿酸水平增高发生痛风有关。本研究中痛风患者与健康对照组相比FEUA降低,与国内既往研究结果相似[5]。在肾脏中,尿酸排泄主要依赖于肾小管上皮细胞分泌的尿酸盐转运蛋白[3]。在全基因组关联研究(genome-wide association studies,GWAS)中证实了尿酸排泄在痛风发展中的重要性,并确定了35个与血清尿酸盐浓度有关的基因位点,其中SLC2A9可编码葡萄糖转运蛋白9(glucose transporter9,GLUT9),GLUT9可调节近端小管基底外侧膜处的尿酸排泄;ABCG2在近端小管与肠的尿酸盐排泄中起重要作用,其功能丧失突变已成为高尿酸血症的主要原因[3,30]。
多因素Logistic回归分析发现,FEUA、NLR为痛风发生的影响因素。进一步通过ROC曲线分析发现,NLR对痛风及不同FEUA分期具有重要的辅助诊断价值。但本研究的不足之处在于尿酸排泄混合型与生成增多型病例数较少,后期有待进一步扩大样本量进行验证。
综上,痛风患者NLR明显异常,可作为痛风发生的预测指标,同时其检测方便、成本低廉,在临床上对痛风患者可通过检测NLR确定FEUA分期,从而指导临床用药,针对性选择降尿酸药物。
本研究局限性:
(1)本研究为回顾性分析,纳入病例数量太少且受地域影响,后期仍需要通过更多的研究来证实。(2)本文的炎性指标只纳入了中性粒细胞/淋巴细胞比值(NLR),未对其他炎性指标如:单核细胞与中性粒细胞指标之比(MLR)、血小板与淋巴细胞之比(PLR)、全身免疫炎症反应指数(SII)及C反应蛋白等进行分析比较。
作者贡献:杨颜瑜、青玉凤、张全波进行文章的构思与设计;杨颜瑜、柳涛红、王聃、黄玉琴、何欣进行研究实施、评估及资料收集;杨颜瑜、王聃进行数据整理;杨颜瑜进行统计学分析及文章撰写;张全波负责文章的质量控制及审校,对文章整体负责。
本文无利益冲突。
