芍药苷固体脂质纳米粒凝胶剂的制备与体外透皮研究
2021-03-26徐丽清刘丹唐文娟
徐丽清,刘丹,唐文娟
(1.大连市第三人民医院药剂部,大连 116033;2.上海市杨浦区中心医院药学部,上海 200090)
芍药苷(Paeoniflorin)是从毛茛科植物芍药、牡丹、紫牡丹等芍药属植物的干燥根中提取的一种糖苷类单体化合物,具有抗炎、止痛、降糖、保肝、免疫调节等多种药理学作用[1],目前临床上主要用于治疗类风湿性关节炎、强直性脊柱炎、乙型肝炎、肥胖症等疾病[2-3]。近年来研究发现,芍药苷对炎症性皮肤病(如:扁平苔鲜、干燥综合征、接触性皮炎)和自身免疫性皮肤病(银屑病、红斑狼疮)等具有良好的治疗效果[4],目前已将其制备成凝胶剂[5]用于皮肤病的治疗。然而,芍药苷属于水溶性、脂溶性均较差的药物(LogP值为-0.42,正辛醇/水),不利于药物透皮吸收,影响到药物的治疗效果[6],因此需要通过合适的药物载体以提高芍药苷的皮肤透过性,有效发挥药物疗效。固体脂质纳米粒(SLNs)是以固态脂质作为基质,将药物包裹在其内核或吸附在其表面,构成的新型药物载体系统,可提药物的渗透性,延长作用时间,在药物透皮系统中具有广阔的应用前景[7-9]。另外,可将固体脂质纳米粒进一步分散在凝胶系统中,形成澄清透明、均一稳定凝胶网状结构,可以增加药物与皮肤黏附性和涂展性,便于药物使用[10]。因此,本研究针对芍药苷的脂溶性差、不利于透皮吸收的缺点,将其制备成固体脂质纳米粒凝胶系统,以增加芍药苷的透皮性能、改善药物的治疗效盯,为芍药苷的皮肤疾病治疗提供一种新的给药途径。
1 仪器与材料
1.1 仪器 LYD500W-T-24G型高速分散均质机(上海岚誉智能化科技有限公司);iChrom 5100高效液相色谱仪(大连依利特分析仪器有限公司);LVEM5型台式透射电子显微镜(QUANTUM量子科学仪器贸易北京有限公司);Malvern Zetasizer 1600 Nano ZS型激光粒度测定仪(英国Malvern公司);DF-101S集热式恒温加热磁力搅拌器(巩义市予华仪器有限责任公司);超滤管(截留分子量:100 000道尔顿,密理博中国有限公司)。
1.2 试药 芍药苷原料药(上海赢瑞生物医药科技有限公司,含量:99.4%,批号:L730213);山嵛酸甘油酯(Compritol 888 ATO),双硬脂酸甘油酯(Precirol ATO 5),单硬脂酸甘油酯(GLycerol Monostearate),三肉豆蔻酸甘油酯(Dynasan 114)均由嘉法狮上海贸易有限公司惠赠;大豆磷脂(上海太伟药业股份有限公司)。
SD 大鼠,雄性,SPF 级,体质量(250±20)g,由大连医科大学实验动物中心提供,动物合格证号:SCXK(辽)310101045。
2 方法与结果
2.1 固体脂质种类筛选 分别选择Compritol 888 ATO(山嵛酸甘油酯,熔点:70~72℃),Precirol ATO 5(双硬脂酸甘油酯,熔点:56℃),Dynasan 114(三肉豆蔻酸甘油酯,熔点:61~65℃),GLycerol Monostearate(单硬脂酸甘油酯,熔点:78~81℃)作为固体脂质纳米粒的脂质相,通过测定芍药苷在固体脂质相与水形成的体系中分配系数(D)来筛选固体脂质。依次取400 mg上述固体脂质分别与20 mL纯化水混合,水浴温度加热至固体脂质熔融,称取10 mg芍药苷分散在熔融混合液中,磁力搅拌30 min;将混合物冷却并离心(10 000 r/min,10 min),测定芍药苷在水相中的含量(Qw)。根据公式计算分配系数:D=(10-Qw)/Qw;同时评估芍药苷在上述固体脂质中的溶解度,取10 mg芍药苷和400 mg固体脂质,在高于脂质熔点温度10℃保温15 min,冷却放置24 h,在光学显微镜下观察。结果显示,芍药苷在Compritol 888 ATO,Precirol ATO 5,Dynasan 114 和 GLycerol Monostearate和水体系中的分配系数(D)分别为:(4.2±0.3)、(11.7±0.4)、(2.2±0.3)、(2.9±0.6)。芍药苷与 Compritol 888 ATO,Dynasan 114和 GLycerol Monostearate形成的混合物中均能够观察到药物晶体,而与Precirol ATO 5形成的混合物中未观察到有药物晶体析出。基于芍药苷在固体脂质中的分配系数以及在固体脂质中的溶解性,选择Precirol ATO 5作为固体脂质纳米粒的脂质载体。
2.2 芍药苷固体脂质纳米粒的制备 本研究以Precirol ATO 5作为固体脂质,以大豆磷脂作为表面活性剂,采用热熔乳化辅助均质法[11]制备芍药苷固体脂质纳米粒。制备工艺如下:称取处方量的Precirol ATO 5和大豆磷脂加入到5 mL乙醇中,超声溶解,再按照处方比例称取处方量芍药苷加入到上述脂质溶液中,搅拌至药物完全溶解,水浴加热至60℃保温;另称量取50 mL纯化水,水浴加热至60℃保温;在高速(3 000 r/min)磁力搅拌,将含药有机相快速加入到纯化水中,分散形成白色乳状液,保持60℃水浴温度,持续高速搅拌30 min,挥干乙醇,补加同温度纯化水至总体积50 mL;在将该溶液放入到高速分散均质机中均质处理,均质速度为20 000 r/min,均质10 min,均质过程样品始终保持(60±2)℃水浴温度。均质结束后将乳液迅速放入到冰水浴中,即得到芍药苷固体脂质纳米粒,放置到4℃冰箱中保存,备用。
2.3 粒径测定 使用Malvern Zetasizer 1600 Nano ZS型激光粒度测定仪测定芍药苷固体脂质纳米粒粒径分布(nm)。移取0.2 mL样品溶液加入到石英比色杯中,轻轻摇匀,放入到激光粒度测定仪中检测,设置检测参数为:检测温度为25℃,检测波长为633 nm,入射角为90°。每个样品平行测定3次,取平均值。
2.4 包封率测定 本研究作者采用超滤离心法测定芍药苷固体脂质纳米粒的包封率。选择截留分子量为100 000道尔顿超滤离心管,精密移取1 mL芍药苷固体脂质纳米粒样品置超滤离心管上腔中,固定到离心管上,放入到台式离心机中离心,转速为 4 000 r/min,离心半径 10 cm,离心20 min,收集离心管中的超滤液,全部转移至10 mL量瓶中,加入流动相定容,摇匀,过滤,取续滤液经高效液相色谱法(HPLC)测定药物含量,得到游离药物质量(W游离);另取该批次芍药苷固体脂质纳米粒1 mL加入到100 mL量瓶中,加入少量甲醇破坏,再加入流动相定容,摇匀,过滤,取续滤液经HPLC测定药物含量,得到总药物质量(W总);参照文献,本研究选择测定芍药苷含量的色谱条件[5]如下:色谱柱为Dikma Diamasil C18柱(4.6 mm×250 mm,5 μm),检测波长为230nm,流动相为乙腈-0.1%磷酸溶液(14∶86),流速为1.0 mL/min。按照下列公式计算芍药苷固体脂质纳米粒的包封率:EE(%)=(1-W游离/W总)×100%。每个样品平行测定3次,包封率取平均值。
2.5 处方优化
2.5.1 Box-Behnken实验设计优化处方 根据预实验考察结果并参考文献[12-13]资料,筛选出对芍药苷固体脂质纳米粒的粒径分布和包封率影响较显著的处方变量作为考察对象,即以脂药比(X1)、固体脂质浓度(X2)及表面活性剂浓度(X3)作为自变量,以平均粒径(Y1)和包封率(Y2)为评价指标,采用 3因素3水平的Box-Behnken设计优化芍药苷固体脂质纳米粒处方。设计包括重复实验的中心点和一系列多维实验点,实验设计因素水平见表1。
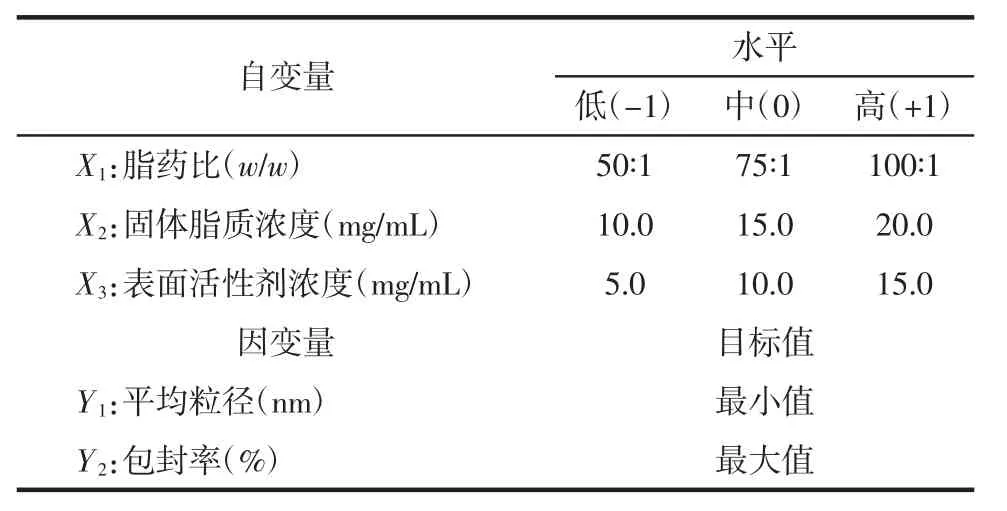
表1 Box-Behnken实验设计中的变量水平Tab.1 Variable level in Box-Behnken experimental design
2.5.2 方差统计分析 应用“Design Expcrt 10.0”统计软件对表2中的实验数据进行方差分析,结果见表3。粒径分布(Y1)和药物包封率(Y2)的两个模型方程的P值分别为0.000 3和0.000 7,差异均有统计学意义(P<0.01);失拟项P值分别为0.066 7和0.331 0,模型预测值与实际值之间差异不存在显著,模型拟合具有足够高的可信度。Y1、Y2多元二次方程分别为:
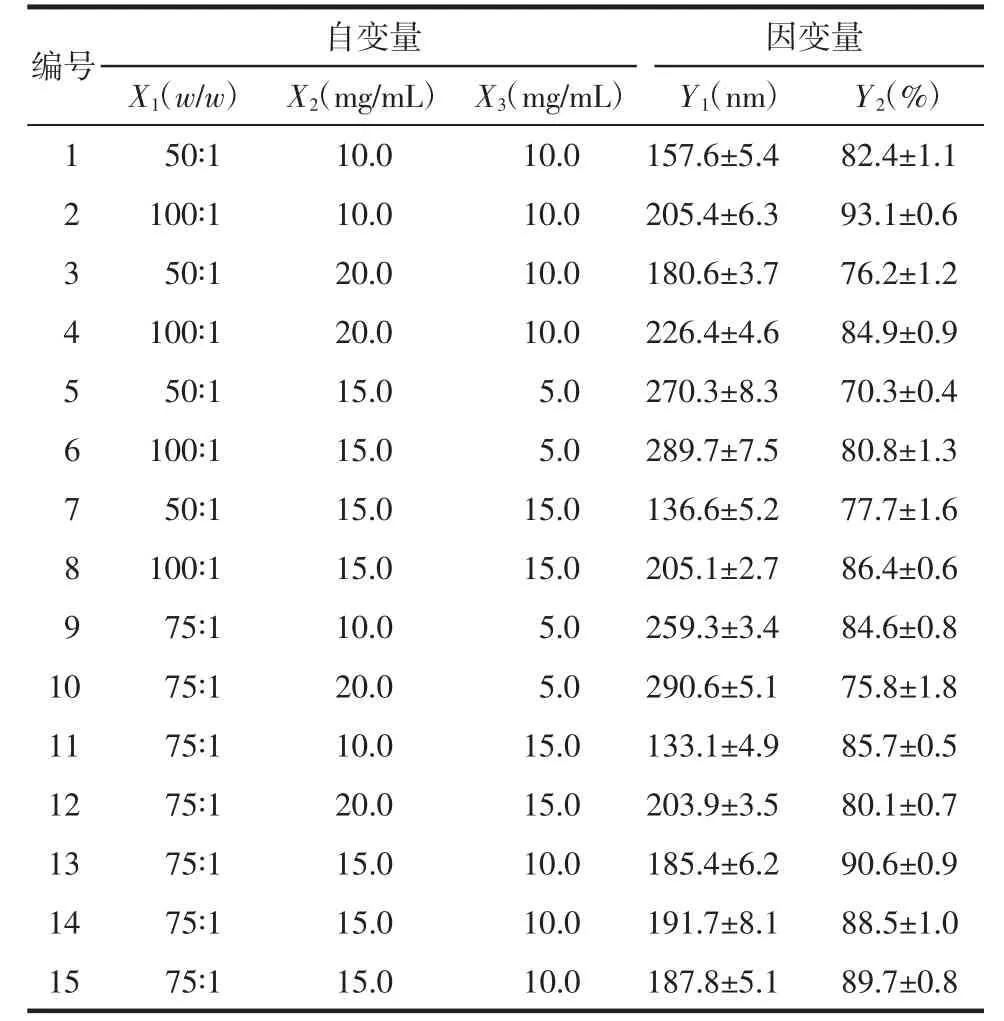
表2 实验设计中的自变量(X)和因变量(Y)Tab.2 Independent variables(X)and dependent variables(Y)in Box-Behnken experiment design

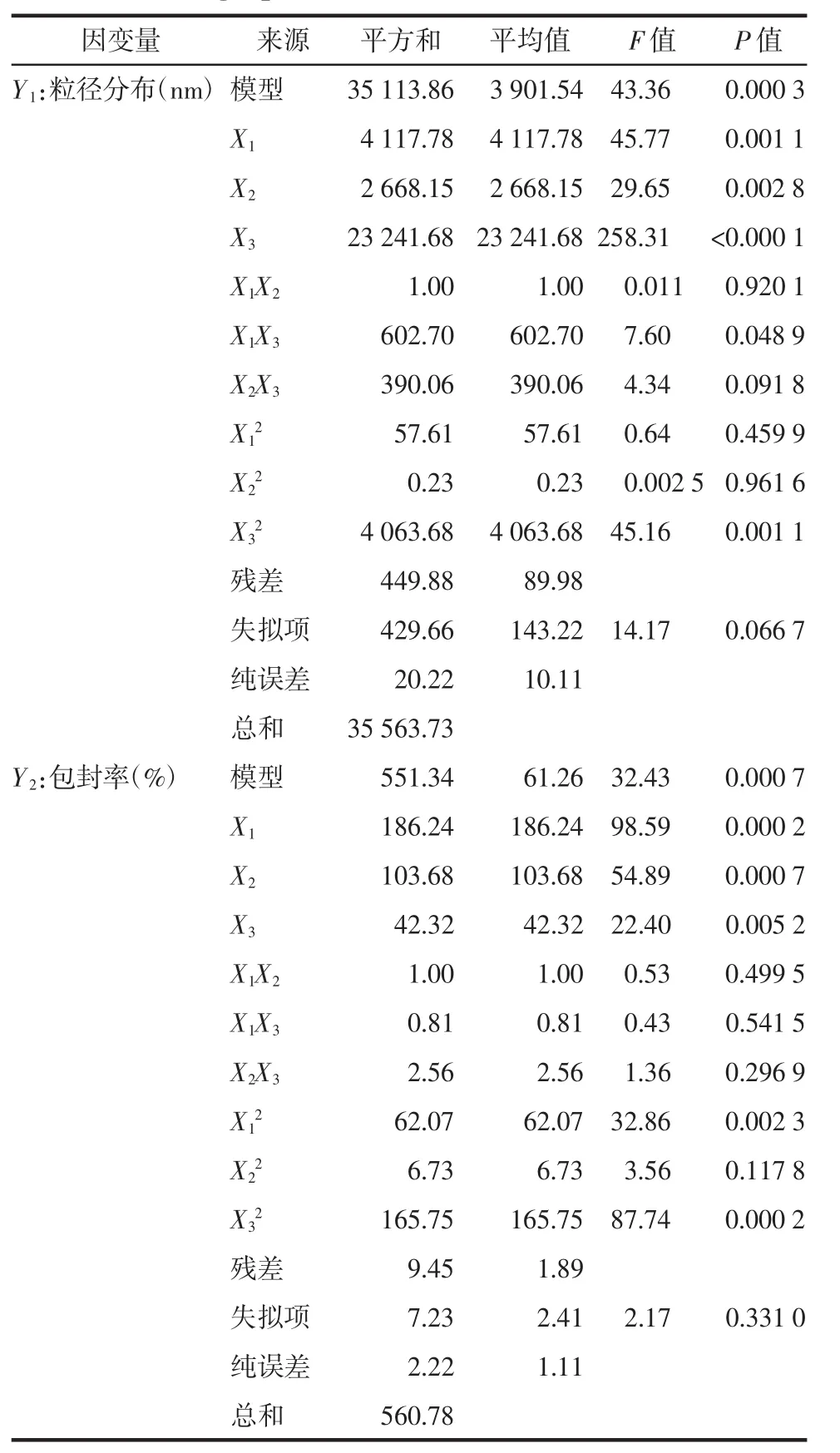
表3 拟合方程中各项系数及方差分析结果Tab.3 Fitting equation coefficients and ANOVA results
通过3D响应面图可直观解释自变量与因变量之间的关系,响应面的弯曲程度反映了自变量对因变量的变化敏感性。曲面弯曲程度大,说明自变量对因变量的变化敏感性较大,反之则说明自变量对因变量的变化敏感性较小。脂药比、固体脂质浓度及表面活性剂浓度对芍药苷固体脂质纳米粒的粒径分布的曲面弯曲程度影响较大,即随着脂药比和固体脂质浓度的增加,粒径增大,随着表面活性剂浓度的增加,粒径减小,这是由于固体脂质浓度的增加或是表面活性剂浓度减小,没有足够的多的表面活性剂包裹在纳米粒周围,因此得到的固体脂质纳米粒粒径较大。见图1。脂药比、固体脂质浓度及表面活性剂浓度对芍药苷固体脂质纳米粒的包封率的曲面弯曲程度影响较大,包封率随着脂药比和固体脂质浓度的增加而增大,随着表面活性剂浓度的增加出现先增大后减小趋势。见图2。
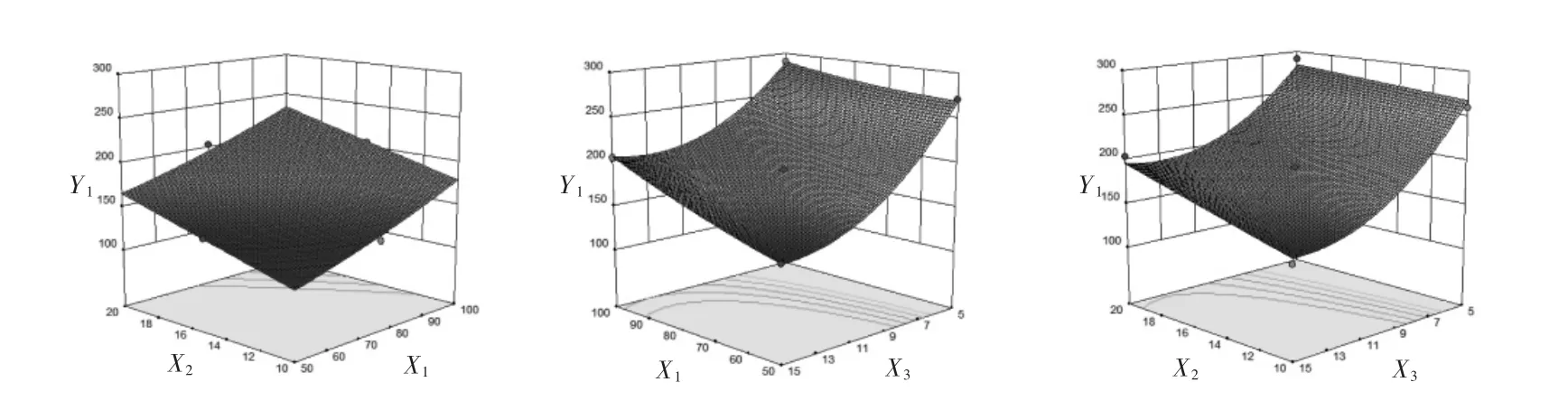
图1 脂药比(X1)、固体脂质浓度(X2)及表面活性剂浓度(X3)对芍药苷固体脂质纳米粒的粒径分布(Y1)的响应面图Fig.1 Response surface diagram of lipid-drug ratio(X1),solid lipid concentration(X2)and surfactant concentration(X3)to average particle size(Y1)of paeoniflorin solid lipid nanoparticle
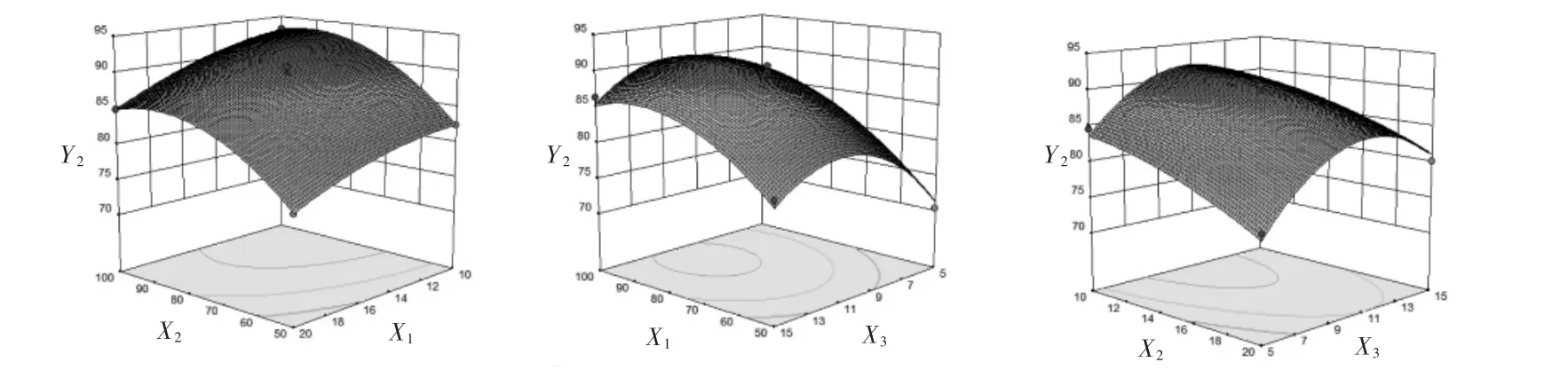
图2 脂药比(X1)、固体脂质浓度(X2)及表面活性剂浓度(X3)对芍药苷固体脂质纳米粒的包封率(Y2)的响应面图Fig.2 Response surface diagram of lipid-drug ratio(X1),solid lipid concentration(X2)and surfactant concentration(X3)to encapsulation efficiency(Y2)of paeoniflorin solid lipid nanoparticle
2.5.3 最佳处方预测与验证 本研究要求制备的芍药苷固体脂质纳米粒粒径分布达到“最小值”,包封率达到“最大值”[14],通过软件拟合得到芍药苷固体脂质纳米粒的最佳处方为脂药比为80∶1、固体脂质浓度为12.0mg/mL,表面活性剂浓度为10.0mg/mL,软件预测纳米粒的粒径分布为171.4 nm,包封率为92.2%。通过制备3批芍药苷固体脂质纳米粒验证最佳处方的可靠性,结果显示粒径分布平均值为(179.3±10.9)nm,包封率为(91.1±0.9)%,实测值与预测值接近,最佳处方的可信度较高。
2.6 芍药苷固体脂质纳米粒凝胶的制备 本研究以卡波姆940作为凝胶基质制备芍药苷固体脂质纳米粒凝胶。称取0.5 g卡波姆940加入到50 mL纯化水中,持续搅拌直至分散均匀;另取50 mL芍药苷固体脂质纳米粒溶液加入到卡波姆940溶液中,搅拌混合均匀;在持续搅拌下加入三乙胺至pH值6.5左右[15],形成凝胶溶液,即得到芍药苷固体脂质纳米粒凝胶,冰箱中保存备用。
参照文献[16]冲和凝胶制备工艺如下:称取50 mL蒸馏水,称取6 g甘油(保湿剂)和87.5 mg亚硫酸氢钠(稳定剂)加入到蒸馏水中搅拌溶解,再称取0.75 g卡波姆940分散到溶液中分散均匀,用三乙胺调节pH值至6.5,形成凝胶状溶液,最后加入0.568 g芍药苷和0.170 g蛇床子,搅拌分散均匀,既得到冲和凝胶,冰箱中保存备用。
2.7 微观形态观察 取芍药苷固体脂质纳米粒,加入少量蒸馏水稀释,并滴加到300目的铜网格上均匀铺展,用滤纸在边缘吸干水分,自然干燥,再滴加一滴5%(W/V)磷钨酸溶液,负染10 min,挥干水分;另取芍药苷固体脂质纳米粒凝胶加入蒸馏水稀释,按照上述方法操作制备样品,将样品放置在透射电子显微镜下观察固体脂质纳米粒的微观形态。通过透射电镜照片可知,芍药苷固体脂质纳米粒在制备成凝胶前后粒径大小几乎未发生变化,粒径大约在200 nm左右,均为球状或类球状,表面光滑圆整,也未观察到有药物晶体析出。

图3 芍药苷固体脂质纳米粒及其凝胶透射电镜图Fig.3 Transmission electron microscopy of paeoniflorin solid lipid nanoparticle and their gels
2.8 体外透皮渗透实验 本研究采用Franz扩散池法评估芍药苷固体脂质纳米粒凝胶的体外透皮渗透性[17-18]。取雄性SD大鼠,实验前禁食不禁水1夜,用电推剪剪下大鼠腹部毛发,再脱毛剂彻底去除,将大鼠处死并剪下腹部皮肤,用镊子去除皮下脂肪和肌肉组织,经生理盐水清洗干净,将鼠皮夹在Franz扩散池中间,角质层面向供给池,真皮层面向接收池。透皮面积约为3.14 cm2,接收池中加入20%(V/V)PEG 400的磷酸盐缓冲液(pH 7.4)8.45 mL作为接收液以满足漏槽条件,将接收池放入到(32±0.5)℃维持恒定温度,同时接收池中放入一枚搅拌磁子,转速为200 r/min。
分别取1.0g冲和凝胶(芍药苷含量均为10mg/g)和1.25 g芍药苷固体脂质纳米粒凝胶(芍药苷含量均为8 mg/g)加入到供给池中进行透皮实验。分别在 1、2、3、4、6、8、10、12 h 时间点从接收池中取出0.5 mL接收液(并补加同温同体积空白接收液),离心,取上清液适当稀释,经HPLC法测定各时间点的药物含量(Ci),并根据公式1-1计算各时间点的单位面积累积透皮量(Qi,μg/cm2),并以 Qi对 t进行线性回归,根据公式1-2计算药物的稳态渗透速率(Js,μg/h/cm2)。
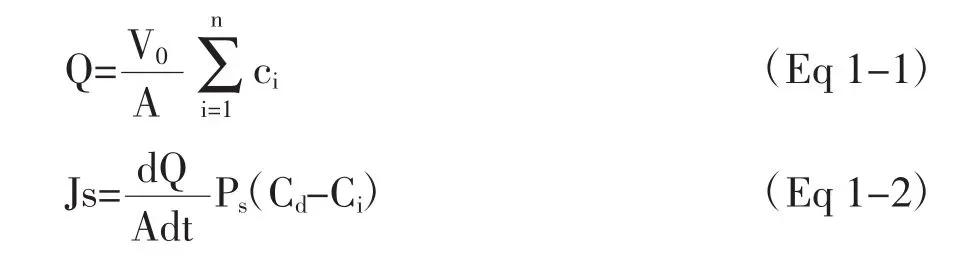
式中:V0为接收液体积,A为皮肤透皮面积(3.14cm2),Cd为供给池中药物浓度,Ci为第i(i≤n-1)个取样点药物浓度。
实验结束后取下鼠皮,用生理盐水洗净,剪碎鼠皮,加入1.0 mL生理盐水研磨成浆状液,转移至10 mL容量瓶中,加入少量乙腈超声20 min,定容,取适量溶液离心,取上清液,经HPLC法测定药物含量,计算两种凝胶剂在皮肤中的滞留量。
冲和凝胶和芍药苷固体脂质纳米粒凝胶的透皮动力学参数见表4。结果显示,与冲和凝胶相比芍药苷固体脂质纳米粒凝胶的透皮吸收显著性提高(P<0.05),芍药苷固体脂质纳米粒凝胶组的Q12和Js分别是冲和凝胶组的3.1倍和3.4倍,表明芍药苷固体脂质纳米粒凝胶能够显著提高药物的透皮性能;另外,芍药苷固体脂质纳米粒凝胶组的药物在皮肤中的滞留量是冲和凝胶组的4.8倍,表明芍药苷固体脂质纳米粒凝胶可以黏附性在皮肤表面,起到药物贮库作用,提高药物在皮肤中的滞留量,延长药物作用时间。

表4 冲和凝胶和芍药苷固体脂质纳米粒凝胶的透皮动力学方程及透皮参数Tab.4 Transdermal dynamic equation and transdermal parameters of Chonghe gel and paeoniflorin solid lipid nanoparticle gel
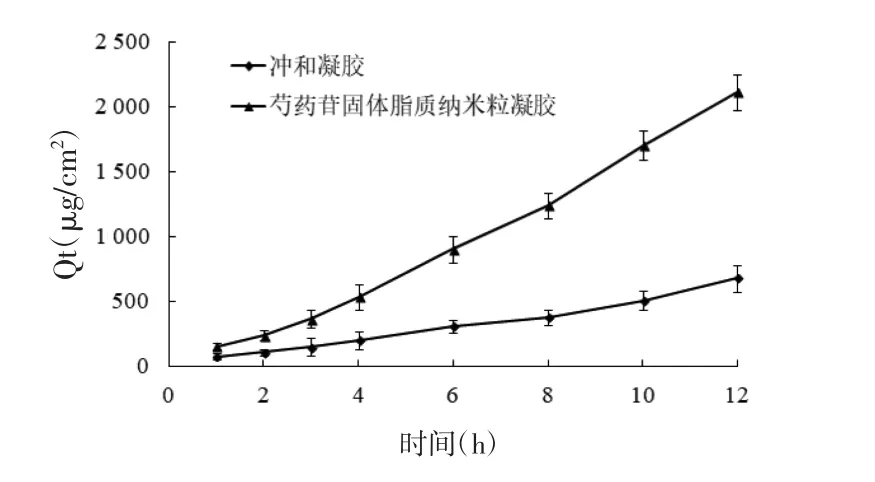
图4 冲和凝胶和芍药苷固体脂质纳米粒凝胶经皮Qi-t关系图Fig.4 Percutaneous Qi-t relationship between Chonghe Gel and paeoniflorin solid lipid nanoparticle gel
3 讨论
本研究将芍药苷制备成固体脂质纳米粒,并通过Box-Behnken设计优化得到最佳处方组成为:芍药苷与固体脂质质量比为80∶1,固体脂质Precirol A的浓度为12.0 mg/mL,表面活性剂大豆磷脂的浓度为10.0 mg/mL,制备得到芍药苷固体脂质纳米粒的粒径为(179.3±10.9)nm,包封率为(91.1±0.9)%,表面光滑圆整,无聚集,分散性良好。体外透皮实验结果显示,芍药苷固体脂质纳米粒凝胶的单位面积累积透皮量(Q12)和稳态渗透速率(Js)分别是冲和凝胶的3.1倍和3.4倍,且在皮肤中的滞留量是冲和凝胶的4.8倍,一方面是由于卡波姆作为凝胶基质黏附到皮肤上,可减少皮肤表面水分蒸发,增加角质层水合作用,改变角质层的结构,有利于药物渗透;另一方面是由于药物被包裹在脂溶性脂质载体中,增加了药物的亲脂性,同时由于表面活性剂大豆磷脂的存在,可以与皮肤之间相互作用,改变角质层的紧密结合,基于这两方面的综合作用导致芍药苷在皮肤中的渗透性及滞留量增加,有望提高芍药苷对皮肤病的治疗效果。