糖通饮对2 型糖尿病大鼠糖脂代谢的影响
2021-03-25高楠楠陈俞如潘艳伶
马 欢,高楠楠,陈俞如,肖 瑛,2,潘艳伶,3*
(1.贵州医科大学,贵州 贵阳 550004;2.贵州省常见慢性疾病发病机制及药物研究重点实验室,贵州贵阳 550025;3.贵州医科大学附属医院,贵州 贵阳 550004)
伴随肥胖人数的快速增多,2 型糖尿病 (type 2 diabetes mellitus,T2DM) 的发病率逐渐增加,预计到2040年患者将达到6.42 亿[1]。T2DM 是由于胰岛素分泌减少和(或) 胰岛素敏感性降低所导致的葡萄糖耐量降低和高血糖为特征的一类常见内分泌疾病[2],随着对T2DM 病理生理研究的不断深入,大量的药物已被应用于治疗糖尿病和阻止其进展,然而,大部分药物有一定不良反应,如乳酸性酸中毒、低血糖、水肿等[3],因此,寻找更安全有效地预防和治疗药物是非常必要的。近年来中医药治疗T2DM以其良好的疗效、较低的不良反应而备受关注[4],糖通饮在临床及前期实验中已被证实对T2DM 具有较好的治疗作用[5-8],但其分子作用机制并未完全清楚。本研究拟观察糖通饮对T2DM 大鼠糖脂代谢、胰岛素水平和氧化应激等生化指标的影响,并从分子水平研究该方对JNK 信号通路的影响,以探寻其分子作用机制,为临床应用提供实验依据。
1 材料
1.1 动物 SPF 级SD 雄性大鼠50 只,体质量(180±20)g,由解放军第三军医大学实验动物中心提供,生产许可证号SCXK (军) 2012-0011,饲养于贵州医科大学临床医学实验中心动物房,自由摄水摄食,并保持垫料干燥,定时予以更换。饲养条件:温度21~26 ℃,相对湿度40%~60%。实验动物使用许可证号SYXK (黔) 2015-005。
1.2 试剂与药物 糖通饮(方药组成为生地黄12 g、山药15 g、山茱萸15 g、茯苓15 g、泽泻9 g、丹皮10 g、黄芪15 g、丹参15 g、地骨皮15 g、草决明15 g),由贵州医科大学附属医院中药房提供。链脲佐菌素(STZ,北京索莱宝科技有限公司,批号615K0321);FFA、SOD、MDA 试剂盒(南京建成生物工程研究所,批号分别为20180613、20180608、20180606);逆转录试剂盒、荧光定量PCR 试剂盒 (日 本 TaKaRa 公 司,批号分别 为 AI40771A、AI21033A);兔SP 试剂盒(北京中杉金桥生物技术有限公司,批号K185910H)。
2 方法
2.1 造模、分组 50 只SPF 级SD 雄性大鼠适应性饲养1周后,按体质量随机取出10 只作为正常组,给予基础饲料喂养,其余大鼠给予高脂饲料(普通饲料58%,精炼猪油20%,糖20%,胆固醇2%,由贵州医科大学动物房提供)喂养8 周,诱发胰岛素抵抗,之后进行1~3 次小剂量(20~30 mg/kg) 腹腔注射1%链脲佐菌素(STZ) 制备T2DM 模型;正常组腹腔注射相应剂量的柠檬酸-柠檬酸钠缓冲液。STZ 注射72 h 后,尾静脉采血测定餐后血糖,以餐后血糖≥16.7 mmol/L[9],且尿量和饮水量明显增多者为T2DM 模型制备成功。将40 只造模成功的大鼠按餐后血糖值随机分为模型组及糖通饮低、中、高剂量组,每组10 只。
2.2 给药 糖通饮中药水煎浓缩成1 g/mL 煎剂,按照大鼠与成人等效剂量折算,低剂量组按10 g/kg (相当于成人公斤体质量用药量的5 倍) 灌胃给药,中剂量组按20 g/kg(相当于成人千克体质量药量的10 倍) 灌胃给药,高剂量组按30 g/kg (相当于成人千克体质量药量的15 倍) 灌胃给药,正常组及模型组给予等容量双蒸水灌胃,以上各组均每天灌胃1 次,连续8 周。实验过程中,因灌胃、大鼠自身免疫力低下等原因死亡7 只,其中模型组、低剂量组和中剂量组各2 只,高剂量组1 只。
2.3 标本采集 给药8 周后,大鼠禁食不禁水12 h,尾静脉采血测量空腹血糖,腹腔注射10%水合氯醛300 mg/kg,大鼠麻醉后快速开腹,腹主动脉采血并迅速摘除胰腺组织,将血液静置30 min 后3 000 r/min 离心10 min,分离血清,保存于-20 ℃冰箱中,以检测FINS、TG、TC、FFA、SOD及MDA。将胰腺组织分别置于-80 ℃冰箱和4%多聚甲醛中,以检测胰腺组织中JNK 信号通路相关因子JNK1、PDX-1 mRNA 及蛋白表达。
2.4 指标检测
2.4.1 空腹血糖(fasting blood glucose,FBG)、空腹血清胰岛素(Fasting serum lisulin,FINS) FBG 水平采用葡萄糖氧化酶法检测,FINS 水平采用ELISA 法测定,并计算胰岛素抵抗指数 (HOMA-IR),公式为HOMA-IR=FBG×FINS/22.5。
2.4.2 血清生化指标 采用全自动生化仪检测TG、TC 水平,按照试剂盒操作步骤,用分光光度计比色检测FFA 水平,黄嘌呤氧化酶法测定SOD 活力,硫代巴比妥酸显色法测定MDA 水平。
2.4.3JNK1、PDX-1 mRNA 表达 采用实时荧光定量PCR法,引物由英潍捷基(上海) 贸易有限公司合成,见表1。2-ΔΔCt计算各组基因相对表达量,并进行统计分析。

表1 引物序列
2.4.4 JNK、PDX-1 蛋白表达 采用免疫组化法。切片常规脱蜡至水,抗原热修复,滴加JNK1 (1 ∶150)、PDX-1抗体(1 ∶150),4 ℃过夜,滴加二抗,滴加SABC 复合物,DAB 显色,苏木素复染,常规脱水,透明,封片,计算平均光密度值。光镜下观察JNK1、PDX-1 蛋白阳性表达,以细胞内出现的淡黄色至棕黄色颗粒作为阳性细胞,颜色越深,表示蛋白表达量越高。
2.5 统计学分析 采用SPSS 17.0 软件进行分析,计量资料以() 表示,组间比较采用单因素方差分析和t检验。P<0.05 表示差异具有统计学意义。
3 结果
3.1 糖通饮对T2DM 大鼠空腹血糖的影响 给药前及给药8 周后,模型组大鼠空腹血糖与正常组相比均升高(P<0.01)。给药前,糖通饮各剂量组大鼠空腹血糖与模型组相比无明显差异(P>0.05);给药8 周后,糖通饮各剂量组大鼠空腹血糖与模型组相比降低(P<0.01),并具有剂量依赖性,但各剂量组之间比较,差异无统计学意义(P>0.05)。见图1。
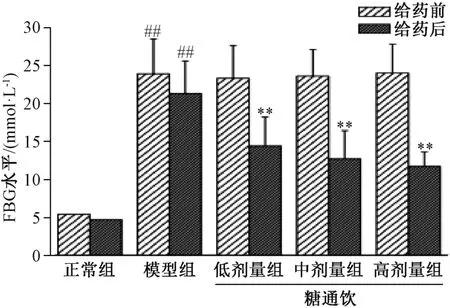
图1 糖通饮对T2DM 大鼠空腹血糖的影响
3.2 糖通饮对T2DM 大鼠空腹血清胰岛素和胰岛素抵抗指数的影响 模型组大鼠空腹血清胰岛素与正常组相比无明显差异(P>0.05),糖通饮各剂量组与模型组相比亦然(P>0.05)。模型组大鼠胰岛素抵抗指数与正常组相比增加(P<0.01),糖通饮各剂量组大鼠胰岛素抵抗指数与模型组相比降低(P<0.01),并具有剂量依赖性,但各剂量组之间比较,差异无统计学意义(P>0.05)。见图2。
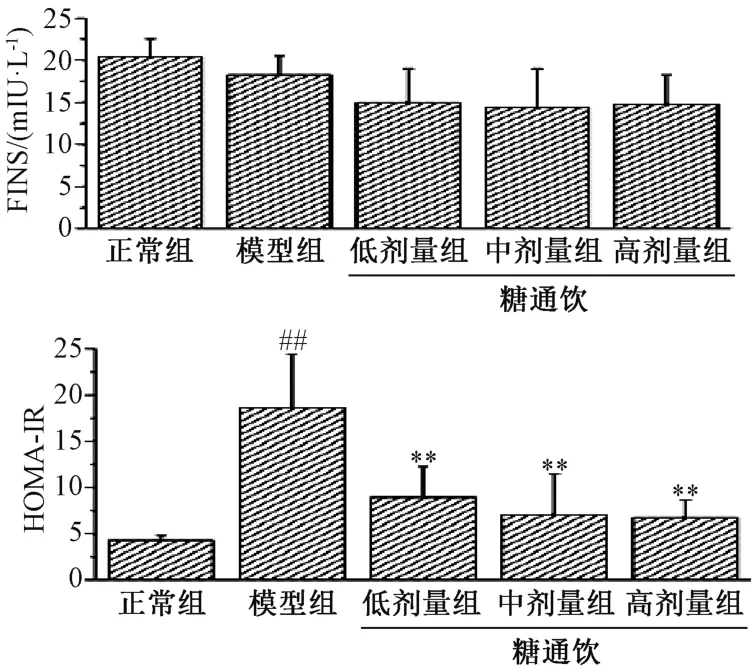
图2 糖通饮对T2DM 大鼠血清胰岛素和胰岛素抵抗指数的影响
3.3 糖通饮对T2DM 大鼠脂代谢的影响 与正常组相比,模型组大鼠血清TG、TC、FFA 水平均升高(P<0.01);与模型组相比,糖通饮各剂量组血清TG、TC、FFA 水平降低(P<0.05,P<0.01),并具有剂量依赖性。见图3。

图3 糖通饮对T2DM 大鼠脂代谢的影响
3.4 糖通饮对T2DM 大鼠氧化应激的影响 与正常组相比,模型组大鼠血清SOD 水平降低(P<0.01),MDA 水平升高(P<0.01);与模型组相比,糖通饮各剂量组大鼠血清SOD 水平升高(P<0.01),MDA 水平降低(P<0.05,P<0.01),并具有剂量依赖性。见图4。
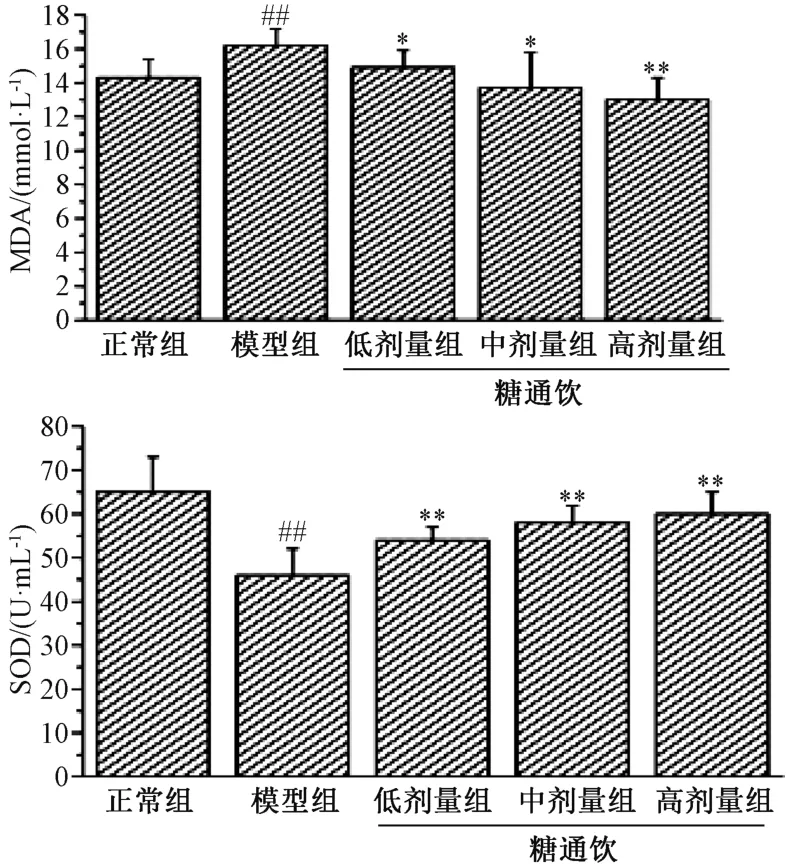
图4 糖通饮对T2DM 大鼠血清SOD、MDA 水平的影响
3.5 糖通饮对T2DM 大鼠胰腺组织JNK1、PDX-1 mRNA表达的影响 与正常组相比,模型组大鼠胰腺组织JNK1 mRNA 表达升高(P<0.01),PDX-1 mRNA 表达降低(P<0.01);与模型组相比,糖通饮各剂量组大鼠胰腺JNK1 mRNA 表达降低(P<0.05),PDX-1 mRNA 表达升高(P<0.05,P<0.01),并具有剂量依赖性。见图5。
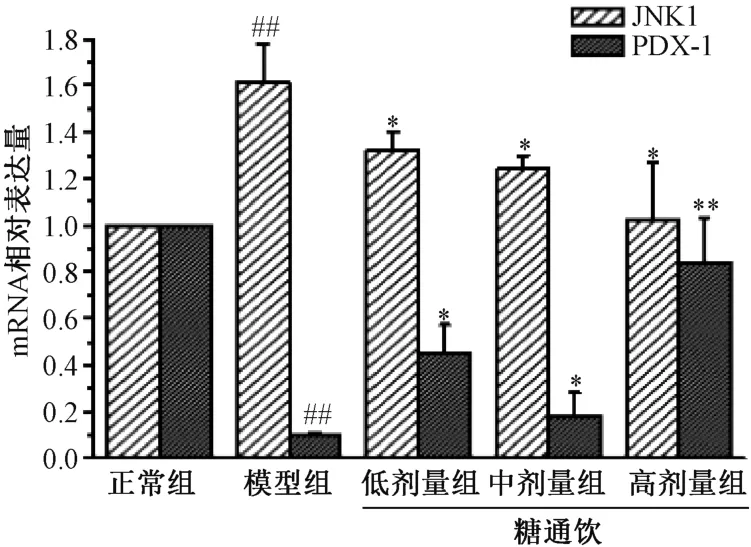
图5 糖通饮对T2DM 大鼠胰腺组织JNK、 PDX-1 mRNA表达的影响
3.6 糖通饮对T2DM 大鼠胰腺组织JNK1、PDX-1 蛋白的影响 JNK1 主要定位于胰岛的细胞浆,模型组胰岛部染色较深,正常组和糖通饮各剂量组染色较浅;PDX-1 主要定位于胰岛的细胞核,模型组胰岛组织阳性细胞数较少,正常组和糖通饮各剂量组阳性细胞数较多。与正常组相比,模型组大鼠胰腺组织JNK1 蛋白阳性细胞表达升高(P<0.01);与模型组相比,糖通饮各剂量组阳性细胞表达降低(P<0.01),并呈剂量依赖性;与正常组相比,模型组PDX-1 蛋白阳性细胞数降低(P<0.01);与模型组相比,糖通饮各剂量组PDX-1 蛋白阳性细胞数增加(P<0.01),并呈剂量依赖性。见图6。
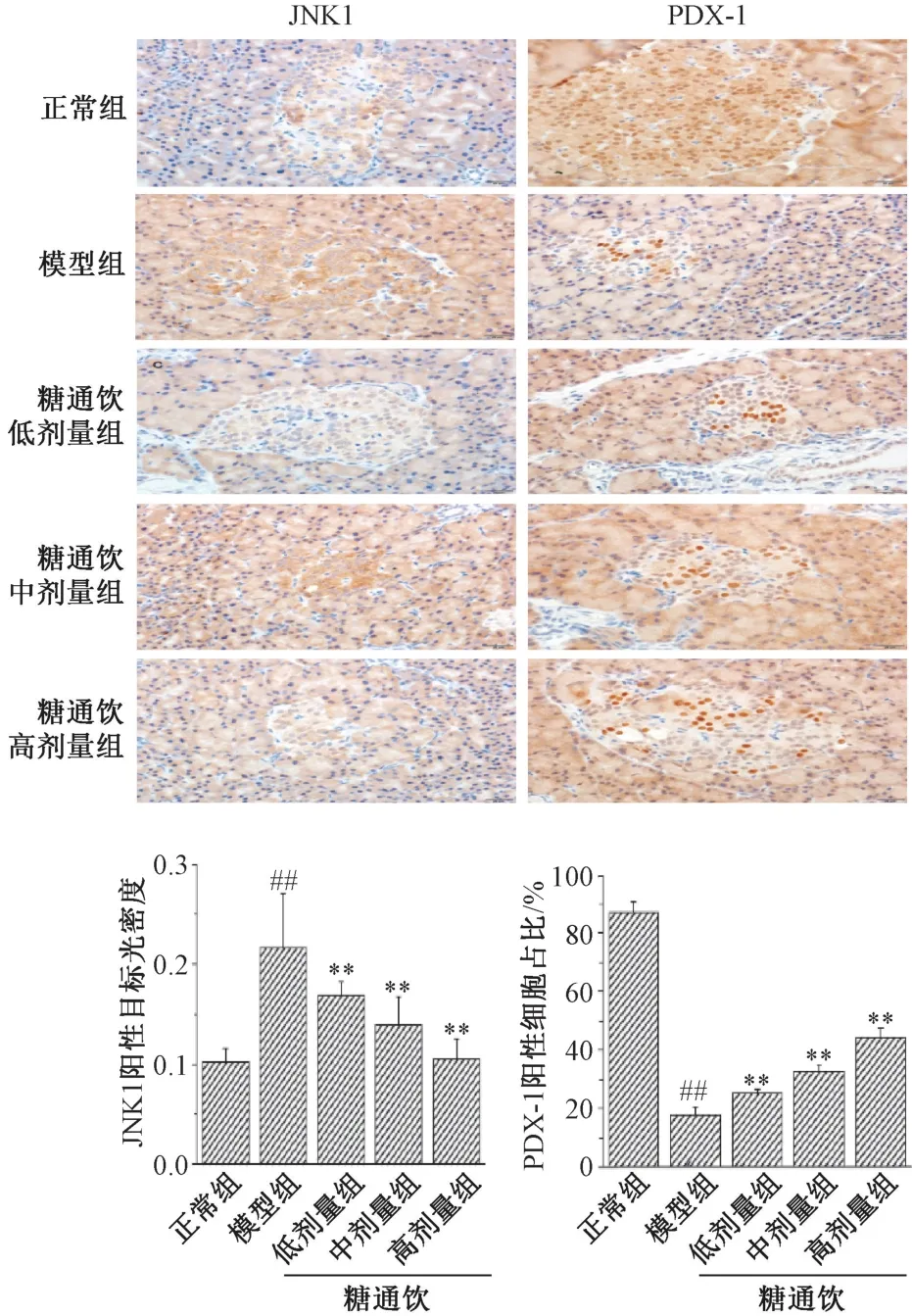
图6 糖通饮对T2DM 大鼠胰腺组织JNK1 和PDX-1蛋白表达的影响(×400)
4 讨论
全国名老中医凌湘力教授针对T2DM 气阴两虚为本、瘀血阻络为标的基本病机特点创制了经验方“糖通饮”,该方在六味地黄丸的基础上改熟地黄为生地黄,并配伍黄芪、丹参、地骨皮、草决明而成,具有益气养阴、活血化瘀之功[9-12]。据现代药理学研究证实,黄芪中的苷类、黄酮类成分和多糖类成分有很好的降糖和增强胰岛素敏感性的作用[9,11];丹参可减少氧化应激损伤、降脂降压;地骨皮、草决明可促进胰岛β 细胞分泌胰岛素,具有降糖降脂的作用。此方在临床治疗T2DM 的运用中也取得颇为满意的效果[12]。在本实验中再次证明中药方剂糖通饮可剂量依赖性地降低T2DM 大鼠的血糖。
糖、脂代谢紊乱是T2DM 发生和发展的重要标志,而胰岛素抵抗是引起糖、脂代谢紊乱的关键环节,持续高血脂水平所产生的脂毒性可导致高活性反应分子性氧簇和活性氮簇生成增多,因此启动氧化应激机制,损伤胰岛β 细胞,加重胰岛素抵抗,继而影响糖代谢[13]。FFA 增多可促进胰岛素受体底物1 的丝氨酸发生磷酸化,进而抑制胰岛素信号通路的活化,从而导致胰岛素抵抗[14]。TG 和TC 的升高,可引起胰岛β 细胞内脂类过量堆积,使胰岛β 细胞功能受损,进而加剧胰岛素抵抗程度[15]。本实验结果显示,T2DM 模型组大鼠血清FFA、TG 和TC 水平均明显升高,证明存在脂质代谢紊乱,应用糖通饮后,可剂量依赖性地降低2 型糖尿病大鼠血清FFA、TG 和TC 水平,改善大鼠的高脂状态。
氧化应激可以促进胰岛素抵抗的发生和进一步加剧脂代谢紊乱。氧化应激与脂代谢之间存在密切联系,脂代谢水平升高会增加耗氧量,进而产生大量的ROS,过量的ROS 又会导致脂肪、蛋白质等大分子变性,从而造成胰腺组织受损,反过来影响脂代谢,发生脂代谢紊乱[16]。SOD为体内抗氧化防御系统的重要组成部分,而MDA 水平的高低直接反映了机体氧化应激水平的严重程度。氧化应激反应引起体内SOD 活性降低,导致机体氧自由基大量产生,对本身缺乏抗氧化酶的胰岛β 细胞更易造成氧损伤,引起胰岛β 细胞功能受损,胰岛素分泌减少[17]。本研究发现,T2DM 模型组大鼠血清SOD 水平明显,血清MDA 明显升高,说明糖尿病时机体氧化应激反应增强。糖通饮可剂量依赖性地升高T2DM 大鼠血清SOD,降低血清MDA,提示糖通饮具有抗氧化作用,这可能是其改善T2DM 大鼠胰岛素抵抗及糖、脂代谢紊乱的作用机制。
胰岛素抵抗是指在胰岛素靶组织(骨骼肌组织、脂肪组织、肝组织等) 中胰岛素促进葡萄糖摄取和利用的能力下降,进一步引起糖代谢紊乱[18]。在T2DM 患者中,胰岛素抵抗的发生率超过80%,是T2DM 早期的主要特征,因此,改善胰岛素抵抗是治疗T2DM 的有效途径。HOMA-IR是研究和评价胰岛素抵抗的重要指标[19]。本实验结果显示,模型组大鼠HOMA-IR 值与正常组大鼠相比明显升高,而其血清胰岛素浓度与正常组大鼠无明显差异,表明模型组大鼠存在胰岛素抵抗,胰岛素抵抗的原因是由于胰岛素与其受体的亲和力降低,而非胰岛素的数量减少所致。糖通饮可明显降低T2DM 大鼠HOMA-IR 值,对血清胰岛素无明显影响,提示糖通饮可能通过增加胰岛素与受体的亲和力,从而改善胰岛素抵抗。此外,糖通饮无明显促进胰岛素分泌的作用,对胰岛组织具有一定保护作用。
c-Jun 氨基末端激酶 (c-Jun N-terminal kinase,JNK)由一组丝氨酸/苏氨酸激酶组成,属于丝裂原活化蛋白激酶家族中重要的一员,对氧化应激较为敏感,激活JNK 信号通路是氧化应激引起胰岛β 细胞损伤的主要机制[20]。激活胰岛β 细胞中JNK 可抑制胰腺十二指肠同源盒(PDX-1)转录因子和胰岛素靶基因的转录,减少血糖升高时胰岛素的分泌,产生胰岛素抵抗[21]。本实验结果显示T2DM 模型组大鼠胰腺组织JNK的mRNA 和蛋白表达明显增加,PDX-1 的mRNA 和蛋白表达明显降低,糖通饮干预后JNK1 的mRNA 和蛋白表达量显著下降,PDX-1 的mRNA 和蛋白的表达量显著升高,表明糖通饮可抑制JNK 信号通路的过度激活,从而降低氧化应激水平和改善胰岛素抵抗,进而改善T2DM 大鼠糖脂代谢。本实验结果还显示糖通饮对上述各项指标的影响具有剂量依赖性,大剂量组的治疗效果优于中、低剂量组,此结果为优化糖通饮的临床用药剂量提供了实验依据。
