氮营养形态和Ni2+浓度对三角褐指藻的影响
2021-03-25杨航常粟淮程薛霖黄旭光
杨航,常粟淮,程薛霖,黄旭光,*
1. 闽南师范大学化学化工与环境学院,漳州 363000 2. 污染控制与监测福建省高校重点实验室,漳州 363000 3. 福建省现代分离分析科学与技术重点实验室,漳州 363000
近年来,水体的富营养化有逐渐加剧的趋势,其主要是农业发展的氮负荷所引起的。大量氮营养盐排入近海海区,尤其是尿素(CO(NH2)2)已经成为近岸水体中溶解有机氮库的重要组成部分[1-2]。Huang等[3]的研究表明,氮源形态的不同会显著影响浮游植物的生长和改变浮游植物群落结构,进而改变近岸生态系统,造成一系列的环境问题。研究表明,近海富营养化特别是氮浓度的增加会影响浮游植物对微量金属的吸收,进而可能会影响到金属在整个海洋食物链中的传递[4]。自然界中,镍(Ni)是一种含量丰富的微量金属元素。有报道表明,高浓度的Ni对人类有致癌性[5],对水生生物也有明显的毒害作用[6]。研究表明一定浓度的Ni对藻具有毒性作用,例如Ni对纤维藻的96 h半抑制浓度(EC50)为0.33 μg·mL-1,当Ni浓度≥0.40 μg·mL-1时,纤维藻的生长受到明显抑制,生长滞期延长,光合作用受阻[7-8]。浮游植物利用尿素需通过脲酶将其分解成铵氮,而Ni是脲酶的金属辅基[9]。因此,氮源形态和Ni浓度必然对浮游植物的生长造成影响。
叶绿素荧光技术是一种以光合作用理论为基础,利用体内叶绿素作为天然探针,研究和检测植物光合生理状况及各种外界因子对其影响的新型植物活体测定和诊断技术。它具有快速、对细胞无损伤和需要样品量少等优点。正常情况下,植物吸收的光能大部分用来进行光化学反应,不能被利用的部分则以热或荧光的形式耗散掉。当藻受到胁迫时,光化学反应效率下降,而热消耗和叶绿素荧光增加,从而导致叶绿素荧光参数的改变。因此可以通过叶绿素荧光的变化来检测藻受环境因子的状况。通过对各种荧光参数的分析,可以得到有关光能利用途径的信息,也可以反映植物受胁迫的情况[10]。光系统Ⅱ(photosystem Ⅱ, PSⅡ)是类囊体膜中的一种光合作用单位,它含有2个捕光复合物和一个光反应中心。PSⅡ的功能是利用从光中吸收的能量将水裂解,并将其释放的电子传递给质体醌,同时通过对水的氧化在类囊体膜两侧建立质子梯度,ATP合成酶用于产生ATP。转移到质体醌的电子最终用于将NADP+还原成NADPH或用于非循环光合磷酸化。Fv/Fm表示PSⅡ的最大光化学量子产量,即PSⅡ的原初光能转换效率。Fv/Fm的下降表明,重金属离子使PSⅡ反应中心受损,抑制光合作用的原初反应,阻碍光合电子传递的过程。rETRmax表示PSⅡ表观电子传递速率,rETRmax的下降表明,重金属离子使藻类的电子传递效率下降[11]。
三角褐指藻(PhaeodactylumtricornutumBohlin),是海洋中最常见的硅藻种类之一,是海产养殖中的常用饵料,在海洋虾、贝类的苗种生产中起着重要的作用,同时也是海洋浮游生物毒性测试中常用的试验材料。本文拟从浮游植物的生长和光合作用荧光参数等方面研究不同氮源形态下,Ni2+对浮游植物的作用,探究近海营养盐结构变动和重金属污染对水生生物的毒性效应,并为进一步探讨其对海洋生态系统影响积累科学依据。
1 材料与方法(Materials and methods)
1.1 实验材料
实验藻种三角褐指藻来源于厦门大学近海海洋环境国家重点实验室藻种室。藻种保存在f/2培养基中,光照度为300 μmol·m-2·s-1,光暗周期L/D=14 h/10 h,温度为(20±1) ℃。
1.2 接种与培养
实验用海水取自中国台湾海峡,陈化1 a后使用。实验用海水经0.22 μm醋酸纤维膜过滤,消毒后用于实验。实验前检测海水中硝酸盐浓度低于4 μmol·L-1、Ni2+浓度低于0.01 μmol·L-1、尿素浓度未检出。将实验藻种于无菌条件下接种到100 mL锥形瓶,于室内光照培养箱(GZP型光照培养箱,广州康恒仪器有限公司)中饥饿培养2 d。培养条件:光照度为2 000 lx,光暗周期L/D=14 h/10 h,温度为20 ℃。
通过前期预实验,设置最终Ni2+浓度为0、10 μg·L-1、100 μg·L-1、1 mg·L-1、10 mg·L-1、50 mg·L-1和100 mg·L-1,以不加Ni2+的空白组为对照,每个梯度设置3个平行,每天定时摇动锥形瓶3次,每次10 s,使浮游植物悬浮。自接种起,每天定时取样进行叶绿素含量及叶绿素荧光各项参数的测定。本实验共持续96 h。
1.3 叶绿素荧光参数的测定
采用德国Walz公司生产的浮游植物荧光仪(Phyto-PAM)进行叶绿素荧光各项参数测定。测定前,将重金属Ni2+处理下的三角褐指藻样品进行暗适应8 min,然后测定Fv/Fm和rETRmax等参数[12]。
1.4 EC50的计算方法和数据统计检验
不同时间(24、48、72和96 h)的Ni2+对三角褐指藻的EC50计算,参照Huang等[13]的方法,使用Graphpad Prism8.0计算得出。软件利用体内叶绿素a荧光参数(rETRmax和Fv/Fm)和叶绿素a(Chla)含量进行主响应曲线(PRC)分析,以全面了解不同氮素营养对Ni毒害的影响。反映光合作用产量的Fv/Fm和Chla的剂量效应曲线遵循式(1)的3个参数对数模型。EC曲线呈S形,可测定EC50的数值。
(1)
式中:y是响应变量(抑制率),c是Ni2+浓度,d是浓度趋于无穷大时的响应,EC50是导致参数的50%被抑制的Ni2+浓度,b是比例因数。
采用SPSS 22.0软件进行多因素连续测量方差分析(Ni2+浓度、氮形态和胁迫时间)及相关性分析。
2 结果(Results)
2.1 Ni2+对三角褐指藻Chl a含量的影响
如图1所示,以硝酸钠为氮源时(图1(a)),在10 μg·L-1、100 μg·L-1、1 mg·L-1和10 mg·L-1Ni2+浓度胁迫96 h后,三角褐指藻Chla含量分别为对照组的106.60%、75.90%、69.40%和52.60%;以尿素为氮源时(图1(b)),在10 μg·L-1、100 μg·L-1、1 mg·L-1和10 mg·L-1Ni2+浓度胁迫96 h下,三角褐指藻Chla含量分别为对照组的117.50%、106.30%、95.90%和62.50%。Ni2+浓度达到50 mg·L-1时,处理24 h硝酸钠为氮源组内无Chla检出,尿素组Chla含量仅为14.10 μg·L-1。统计分析表明,硝酸钠为氮源的10 μg·L-1Ni2+处理组,尿素为氮源的10 μg·L-1和100 μg·L-1Ni2+处理组,对于三角褐指藻Chla含量均呈现明显的促进作用(P<0.05),Ni2+超过以上浓度对三角褐指藻生长的毒性作用显著(P<0.05)。
2.2 Ni2+对三角褐指藻光能转化效率(Fv/Fm)的影响
如图2所示,2种氮源条件下,浓度为10 μg·L-1~10 mg·L-1Ni2+对于三角褐指藻光能转化效率Fv/Fm影响均不显著(P>0.05)。与各自氮源下的对照组相比,尿素氮源的10 mg·L-1和50 mg·L-1Ni2+组和硝酸钠氮源的10 mg·L-1Ni2+处理组,Fv/Fm均在24 h下降到最低值,随后缓慢上升;尿素氮源的100 mg·L-1Ni2+处理组和硝酸钠氮源的50 mg·L-1和100 mg·L-1Ni2+处理组,Fv/Fm均在24 h下降到接近于0,且并未随着时间的增加而恢复。

图1 不同氮源下Ni2+对三角褐指藻叶绿素含量(Chl a)的影响注:(a)以硝酸钠为氮源;(b)以尿素为氮源。Fig. 1 Effects of Ni2 + on chlorophyll (Chl a) content of P. tricornutum Bohlin under different nitrogen sourcesNote: (a) Sodium nitrate as nitrogen source; (b) Urea as nitrogen source.
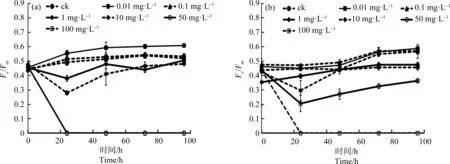
图2 不同氮源下Ni2+对三角褐指藻光能转化效率(Fv/Fm)的影响注:(a)以硝酸钠为氮源;(b)以尿素为氮源。Fig. 2 Effects of Ni2+ on the light energy conversion efficiency (Fv/Fm) of P. tricornutum Bohlin under different nitrogen sourcesNote: (a) Sodium nitrate as nitrogen source; (b) Urea as nitrogen source.
2.3 Ni2+对三角褐指藻最大电子传递速率(rETRmax)的影响
如图3所示,不同氮源条件下,三角褐指藻rETRmax在Ni2+浓度(10 μg·L-1~1 mg·L-1)处理组中,随着处理时间(0~96 h)均无显著性变化(P>0.05)。不同氮源条件下,三角褐指藻rETRmax在Ni2+浓度10、50和100 mg·L-1处理组中,随着处理时间的变化(0~96 h),整体呈现下降趋势(P>0.05)。96 h后,在Ni2+浓度10、50和100 mg·L-1处理组(硝酸钠为氮源)中,rETRmax分别是对照组(无添加Ni2+)的63.30%、54.10%和2.90%;同样处理(尿素为氮源),rETRmax分别是是对照组(无添加Ni2+)的60.10%、10.30%和10.50%。
2.4 EC50值
在不同氮源条件下,Ni2+胁迫下三角褐指藻各参数的EC50变化情况如表1所示。由表1可知,重金属离子(Ni2+)对三角褐指藻的EC50值与胁迫时间以及测定的参数有关。以硝酸钠和尿素为氮源,三角褐指藻Chla的EC50值从24 h的15.50 mg·L-1和18.42 mg·L-1逐渐下降到96 h的10.02 mg·L-1和11.24 mg·L-1。成对T检验表明,以尿素为氮源的三角褐指藻Chla的EC50值高于以硝酸钠为氮源的(P<0.05)。由表1可知,使用三角褐指藻Fv/Fm和rETRmax计算EC50值时,软件拟合并通过检验的仅为部分数据。

图3 不同氮源下Ni2+对三角褐指藻最大电子传递速率(rETRmax)的影响注:(a)以硝酸钠为氮源;(b)以尿素为氮源。Fig. 3 Effect of Ni2+ on the maximum electron transfer rate (rETRmax) of P. tricornutum Bohlin under different nitrogen sourcesNote: (a) Sodium nitrate as nitrogen source; (b) Urea as nitrogen source.
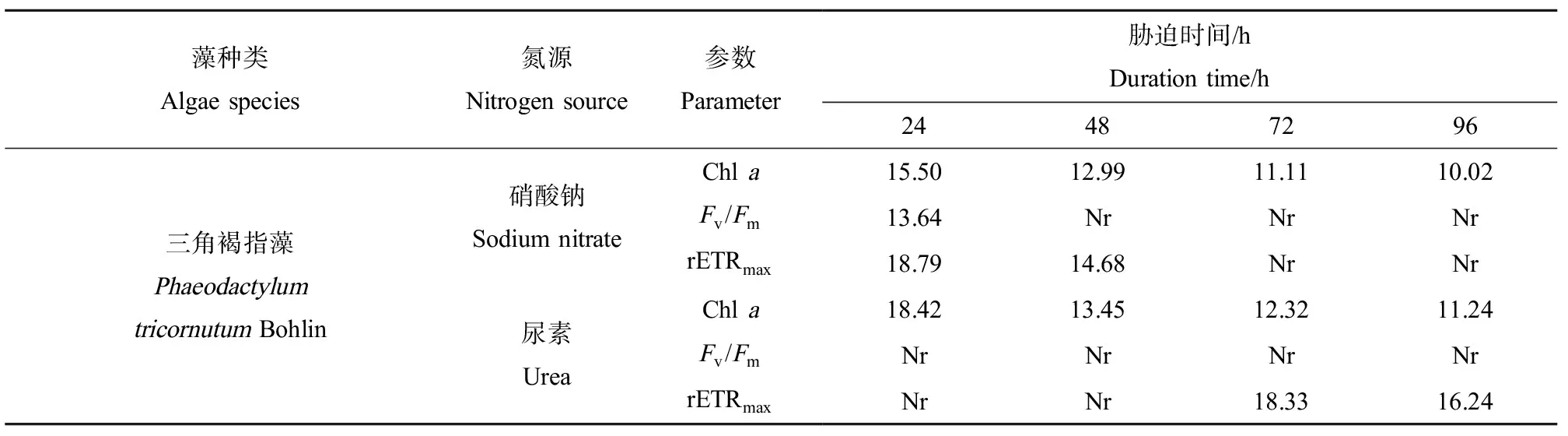
表1 不同氮源下Ni2+对三角褐指藻各参数的EC50Table 1 EC50 of various parameters of Phaeodactylum tricornutum Bohlin under different nitrogen sources exposed to Ni2+ (mg·L-1)
3 讨论(Discussion)
近年来,富营养化特别是尿素在海洋环境中浓度增加已被广泛关注。近40年来,尿素作为氮肥的用量在全球范围内已增加了100倍,特别近10年内就翻了1倍[14]。大量尿素随江(河)水进入海水,造成近海环境中尿素浓度逐渐增高。而浮游植物利用尿素必须通过脲酶分解[15-16]。同时,脲酶的活性离不开Ni作为辅助因子[17]。因此氮营养形态和Ni对浮游植物的影响,需要进一步研究[18]。
Ni是浮游植物生长必需的微量元素,过量也会阻碍其生长发育[19]。浮游植物对微量Ni的吸收促进了体内相关酶(如超氧化物歧化酶和脲酶等)的合成,促进浮游植物的生长。本实验结果表明,低浓度的Ni2+(10 μg·L-1)处理下,尿素氮源对Chla浓度的促进作用显著高于硝酸钠为氮源,而相应处理组中的Fv/Fm和rETRmax也表现出类似的趋势,这表明与硝酸盐浓度相比,低浓度的Ni2+更能促进尿素氮源下的三角褐指藻的生长,这与浮游植物需要摄入微量的Ni(特别是在尿素氮源下)以合成脲酶等含Ni酶有关[4]。
然而,当水体环境中Ni2+的浓度过高,藻细胞在代谢过程中被迫吸收环境的Ni2+,而这些多余的Ni2+并未参与到脲酶等辅基的作用中,细胞自身的调节机制进行细胞自我保护,就可能对藻细胞构成毒性效应[20],进而使其光能转化效率、最大电子传递效率和叶绿素含量降低。本研究也表明,不论何种氮源下,10~100 mg·L-1Ni2+处理对三角褐指藻Chla有明显的毒性作用,并且随着Ni2+浓度增大、胁迫时间延长,毒性作用越显著。藻类细胞壁上带有负电荷、羟基和氨基等官能团,对含有正电荷的金属离子有着较大的亲和力,随着金属离子浓度的增加,藻细胞表面的官能团与其结合而丧失活性,从而影响了藻正常的生化反应进程,最终导致藻的生长受到抑制,甚至死亡[21-23]。可见,氮源形态(尿素和硝酸钠)和Ni2+浓度均能影响到浮游植物的生长,且表现出较明显的差异。
另外,尿素为唯一氮源时,三角褐指藻Chla的EC50值均高于以硝酸钠为氮源的,这表明氮源形态能影响浮游植物对Ni的耐受性。三角褐指藻在尿素氮源下对Ni的耐受性强于硝酸钠氮源。浮游植物在以尿素为唯一氮源时,需要水体中存在Ni离子[24],尿素必须通过脲酶水解,生成铵态氮,然后才能被浮游植物利用。而Ni是脲酶组成的必要辅基,没有Ni的存在,脲酶无法合成并完成其功能[25]。尿素为氮源时,浮游植物合成较多的蛋白质减低体内离子态Ni的浓度,从而降低其毒性。另外,尿素氮源时,浮游植物也可能需要较多的Ni参与藻细胞的生理生化反应,因而能耐受比较高浓度的Ni环境。
三角褐指藻Fv/Fm、rETRmax的EC50值仅有少数被软件计算出并通过检验,说明藻的叶绿素荧光参数随环境的变化具有不确定性,而选择藻类Chla含量的EC50评价藻类的金属耐受性更具可行性。
综上所述,在尿素和硝酸钠为氮源下,低浓度Ni2+均能显著促进三角褐指藻的生长,高浓度的Ni2+对三角褐指藻都有显著的毒性效应。比较不同氮源下浮游植物Chla的EC50值表明,三角褐指藻在尿素氮源下对Ni的耐受性强于硝酸钠氮源,且均随着时间的增加而减弱。与Fv/Fm、rETRmax相比,浮游植物的ChlaEC50更适合用于评价藻类对金属离子毒性和耐受性。
