半夏酚酸类化感物质积累规律研究
2021-03-25万子玉李巧赖月月刘佳灵敬勇李敏
万子玉,李巧,赖月月,刘佳灵,敬勇,李敏
成都中医药大学中药材标准化教育部重点实验室,中药资源系统研究与开发利用省部共建国家重点实验室培育基地,成都 611137
半夏(Pinelliaternata(Thunb.) Breit.)作为流通广泛的大宗药材,近年来需求量不断增加,但野生的半夏资源不断衰减,使得栽培半夏所占的比重越来越大。连作障碍(continuous cropping obstacles; replant problems; replant disease),即在同一块土壤中连续栽培同种或同科作物时,即使在正常的栽培管理状况下,也会出现生长势变弱、产量降低、品质下降和病虫害严重的现象,连作障碍在早期研究中被称为“土壤病”。连作障碍是药用植物栽培中的一种常见现象,尤以根或根茎入药的药材生产中表现最为突出,如半夏、人参、地黄、三七和丹参等[1-4]都存在着严重的连作障碍问题,表现为轻则减产,重则绝收。引起作物连作障碍的主要因素可以归纳为化感自毒作用、土壤微生态发生改变,土传病虫害严重、土壤理化性质改变等[5-8],其中化感自毒作用是目前连作障碍研究热点之一。李培栋等[9]分析花生(ArachishypogaeaLinn.)连作土壤中酚酸类化感物质,发现土壤中对羟基苯甲酸、香草酸、香豆素和苯甲酸会抑制花生幼苗生长并提高花生的发病率。杜家方等[10]在研究连作地黄(RehmanniaglutinosaLibosch.)根际土壤中酚酸类物质的动态变化过程中发现阿魏酸、香豆酸、丁香酸和对羟基苯甲酸酚酸类物质会抑制地黄块根生长,引发连作效应。课题组前期研究发现半夏连作土壤中含有对羟基苯甲酸、香草酸、丁香酸、香草醛、对香豆酸和阿魏酸,这6种酚酸均是文献中经常报道的酚酸类化感物质,且对半夏的生长发育具有较强的化感作用[10-11],故推测半夏的连作障碍现象也与以上酚酸类物质所引起的化感自毒作用有关。目前,对半夏酚酸类化感物质的积累和分泌少有研究,半夏的酚酸类化感物质在不同时期的分泌和积累的研究更是缺乏。实验针对连作土壤中已分离鉴定的6种酚酸类化感物质,对不同生长时期的半夏植株、根际土壤中的酚酸类成分进行分析研究,探究半夏植株中6种酚酸类成分的积累规律,为缓解半夏化感自毒作用和消减连作障碍、为提高其产量和质量提供理论依据。
1 材料与方法(Materials and methods)
1.1 材料
半夏种茎来源于四川省南充市龙门镇的野生种茎,直径1.5~2.0 cm。经成都中医药大学的李敏教授鉴定,为天南星科植物半夏(Pinelliaternata(Thunb.) Breit.)的块茎。
方形花盆、河沙、珍珠岩、蛭石和配方全营养液购于广东天禾农资股份有限公司。
1.2 试剂与仪器1.2.1 试剂
98%对羟基苯甲酸(批号:wkq17060502)、99%丁香酸(批号:wkq17112307)、98%香草酸(批号:wkq17112206)、98%香草醛(批号:wkq17052406)、99%对香豆酸(批号:wkq17081114)和98%阿魏酸(批号:wkq17112004)均购自成都维克奇生物科技有限公司,上述各对照品质量分数均≥98%。水为蒸馏水,乙腈和磷酸为色谱纯,浓盐酸、氢氧化钠、乙酸乙酯和甲醇等均为分析纯,均购自成都市科隆化学品有限公司。
1.2.2 仪器
WATERS E2695高效液相色谱仪(沃特世科技(上海)有限公司),Inertsil ODS-3 C18(4.6 mm×250 mm, 5 μm)色谱柱(岛津公司);Allegra 64R Centrifuge型冷冻离心机(Beckman Coulter);DUG-9070B智能型电热恒温鼓风干燥箱(上海琅玕实验设备有限公司);SQP万分之一天平(赛多利科学仪器(北京)有限公司);PHS-3E型pH剂(雷磁-上海仪电科学仪器股份有限公司);KQ-500DE超声波清洗器(江苏省昆山市超声仪器有限公司);SHB-ⅢS循环水式多用真空泵(郑州长城科工贸有限公司);HY-BⅡ回旋振荡器(江苏金怡仪器科技有限公司)。
1.3 方法1.3.1 实验设计
取半夏种茎,用蒸馏水反复冲洗,除去泥沙杂质。浸泡5 h,消毒,取出沥干备用。将半夏整齐放置于铺有洁净石英砂的育苗盘中,置于温度为20~23 ℃的生化培养箱中催苗。待半夏发芽后,取生长情况一致的半夏移栽至含河沙、珍珠岩和蛭石的混合配方基质中,置于20~25 ℃玻璃人工气候室中培养,期间每隔4 d浇一次0.075%的全营养液(以保证半夏植株正常生长)。半夏出苗后15 d开始取样,之后每隔半个月对半夏植株进行取样,每个育苗盘每次取5株,共取6次。将半夏植株分为须根、块茎(去皮)、块茎皮和叶4个部分,50 ℃烘干备用;收集半夏根际土壤(半夏植株取出后小心抖掉粗沙,用软毛刷刷下附着在须根上面的少量沙子,除去残根等杂质)自然风干备用。
取半夏种茎,用清水反复冲洗,除去泥沙杂质。浸泡5 h,取出沥干备用。称取300 g经消毒的洁净石英砂置于发芽盒中,移取0、0.0016、0.0162、0.0812、0.1624和0.6496 mg·L-1的对香豆酸胁迫液各50 mL,加入石英砂中并充分拌匀,同时设置空白对照,每个处理设置3组平行实验。处理后石英砂中酚酸含量分别为0.00、0.27、2.73、13.67、27.33和109.33 μg·g-1。取36颗已消毒的半夏种茎种整齐植入处理好的发芽盒中。将布置好的发芽盒放入(20±1) ℃的恒温生化培养箱中,避光培养。
1.3.2 色谱条件
色谱条件参考吴立洁等[12]建立的测定6种酚酸的方法,并进行优化。WATERS E2695高效液相色谱仪,Inertsil ODS-3 C18(4.6 mm×250 mm, 5 μm)色谱柱,以乙腈-0.1%磷酸溶液为流动相进行梯度洗脱,洗脱条件如表1所示;流速为1 mL·min-1,进样量10 μL;检测波长为275 nm;柱温为25 ℃。
1.3.3 半夏酚酸含量测定
供试品溶液的制备:根际土壤制备方法参考吴立洁等[12]的方法,并进行优化。称取土样(过4号筛)100 g,置于500 mL锥形瓶中,加入1 mol·L-1NaOH溶液100 mL,振摇6 h,静置18 h,离心,取上清液,用浓盐酸调节pH至2.5左右,8 000 r·min-1离心5 min,取上清20 mL,加乙酸乙酯40 mL萃取5次。合并乙酸乙酯层,减压浓缩干燥。准确吸取2 mL甲醇溶解残渣,0.22 μm微孔滤膜过滤,取续滤液,即得。
半夏植株各部位半夏酚酸提取参考饶国栋和张建国[13]的方法,并进行优化。称取样品粉末(过4号筛)2 g,置150 mL锥形瓶中,加1 mol·L-1NaOH 50 mL,振摇6 h,静置18 h,离心,取上清液,用浓盐酸调节pH至2.5,8 000 r·min-1离心5 min,取上清10 mL,用乙酸乙酯萃取5次,每次20 mL,合并萃取液,减压干燥。准确吸取2 mL甲醇溶解残渣,0.22 μm滤膜过滤,取续滤液,即得。
对照品溶液的制备:分别精密称取对羟基苯甲酸、香草醛、香草酸、对香豆酸、丁香酸和阿魏酸对照品,置于10 mL容量瓶中,以甲醇制成每1 mL含羟基苯甲酸100 μL、香草醛100 μL、香草酸100 μL、对香豆酸100 μL、丁香酸400 μL和阿魏酸100 μL混合对照品溶液。
1.3.4 发芽指标测定
待半夏种茎开始发芽时,每天记录半夏种茎的发芽数,共记录14 d。待实验结束,用刻度尺测定各处理半夏植株的根长。
1.3.5 评价方法
发芽率(%)=(萌发终期正常发芽种子数/供试种子数)×100%;
发芽势(%)=(萌发高峰期正常发芽种子数/供试种子数)×100%,萌发高峰期指发芽过程中日发芽种子数达到最高峰的时期;
发芽指数=∑Gt/Dt,式中:Gt为在td时的种子发芽数,Dt为相对应的发芽时间(d);
化感效应指数(response index, RI)采用Bruce Wiliamson和Richardson[14]的方法:RRI=1-C/T(当T≥C时)或RRI=C/T-1(当T

表1 高效液相色谱(HPLC)梯度洗脱条件Table 1 Gradient elution conditions of high performance liquid chromatography (HPLC)
RRI绝对值代表化感作用强度。
1.3.6 分析方法
试验数据整理采用Excel2016,分析作图采用GraphPad6,数据进行统计分析采用SPSS21.0。
2 结果(Results)
吸取供试品溶液、对照品溶液各10 μL注入高效液相色谱仪,对半夏根际土及半夏各部位所含酚酸进行定性和定量分析。从半夏植株的须根、块茎(去皮)、块茎皮和叶中均鉴定出6种相同的酚酸类成分,分别为对羟基苯甲酸、香草酸、丁香酸、香草醛、对香豆酸和阿魏酸(图1);根际土的鉴定结果与半夏植株的相同(图2)。
2.1 不同生长时间的半夏须根中酚酸含量的积累变化
不同生长时间的半夏须根中酚酸含量测定结果如表2所示,半夏须根中总酚酸含量范围为238.59~
578.65 μg·g-1,不同生长时间总酚酸含量存在显著性差异(P<0.05),随生长时间的延长,总酚酸含量呈波动上升的趋势,当生长时间为90 d时达到最高,约为生长15 d含量的2.4倍。同一时期各酚酸的含量均有所差异,具体表现为对香豆酸>香草醛>对羟基苯甲酸>香草酸>阿魏酸>丁香酸,含量最高的对香豆酸约为含量最低的丁香酸63倍。随生长时间的延长,须根中的6种酚酸的含量皆呈波动上升的趋势,且存在显著性差异(P<0.05),除丁香酸在60 d时含量达到最高外,其余5种酚酸均在90 d时含量达到最高。
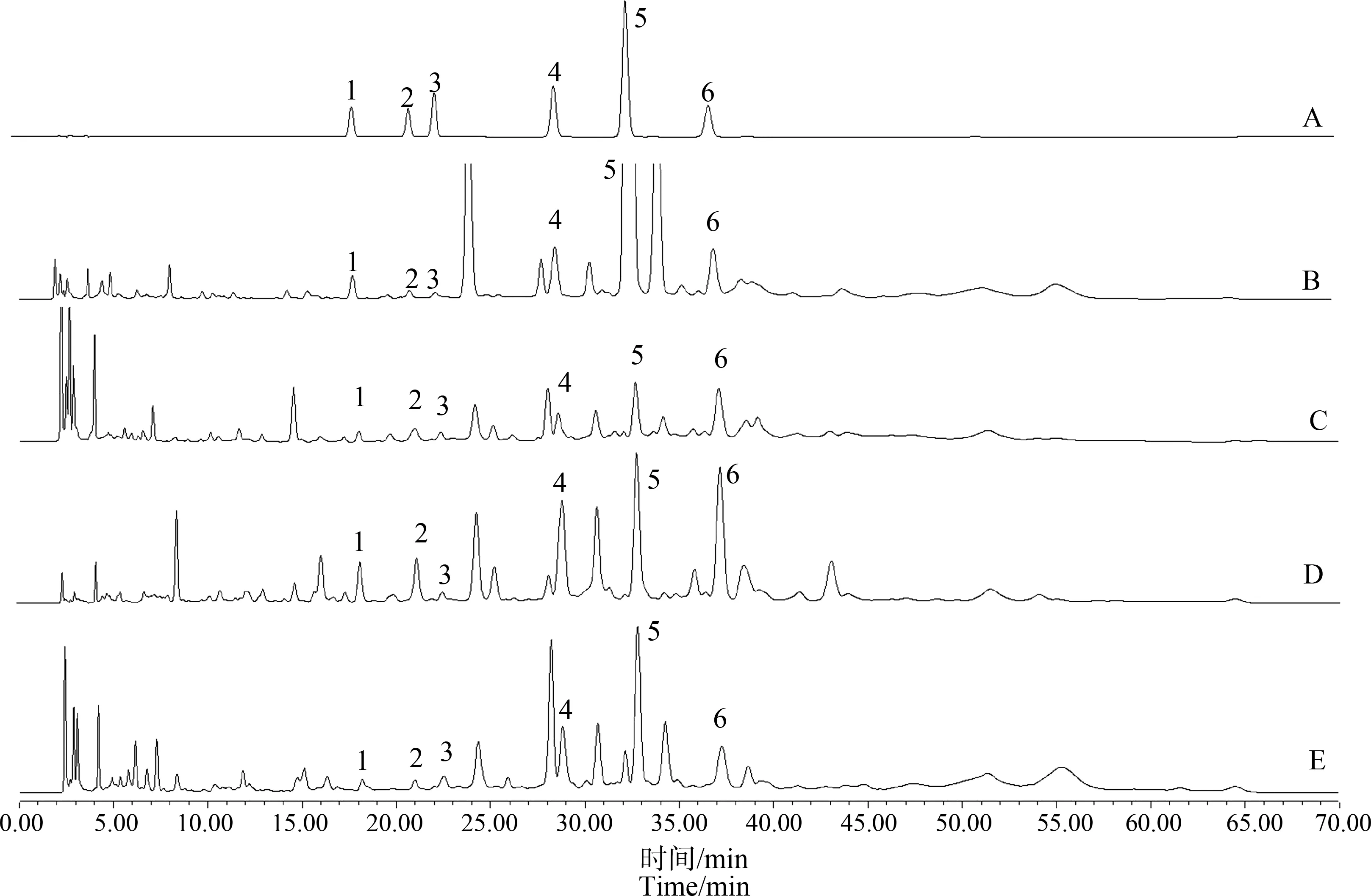
图1 对照品及供试品HPLC色谱图注:A.对照品,B.须根,C.块茎(去皮),D.块茎皮,E.叶;1.对羟基苯甲酸,2.香草酸,3.丁香酸,4.香草醛,5.对香豆酸,6.阿魏酸。Fig. 1 HPLC chromatogram of reference substance and sampleNote: A. Control, B. Fibrous root, C. Tuber (peeled), D. Tuber skin, E. Leaf; 1. p-hydroxybenzoic acid, 2. Vanillic acid, 3. Syringic acid, 4. Vanillin, 5. p-coumaric acid, 6. Ferulic acid.
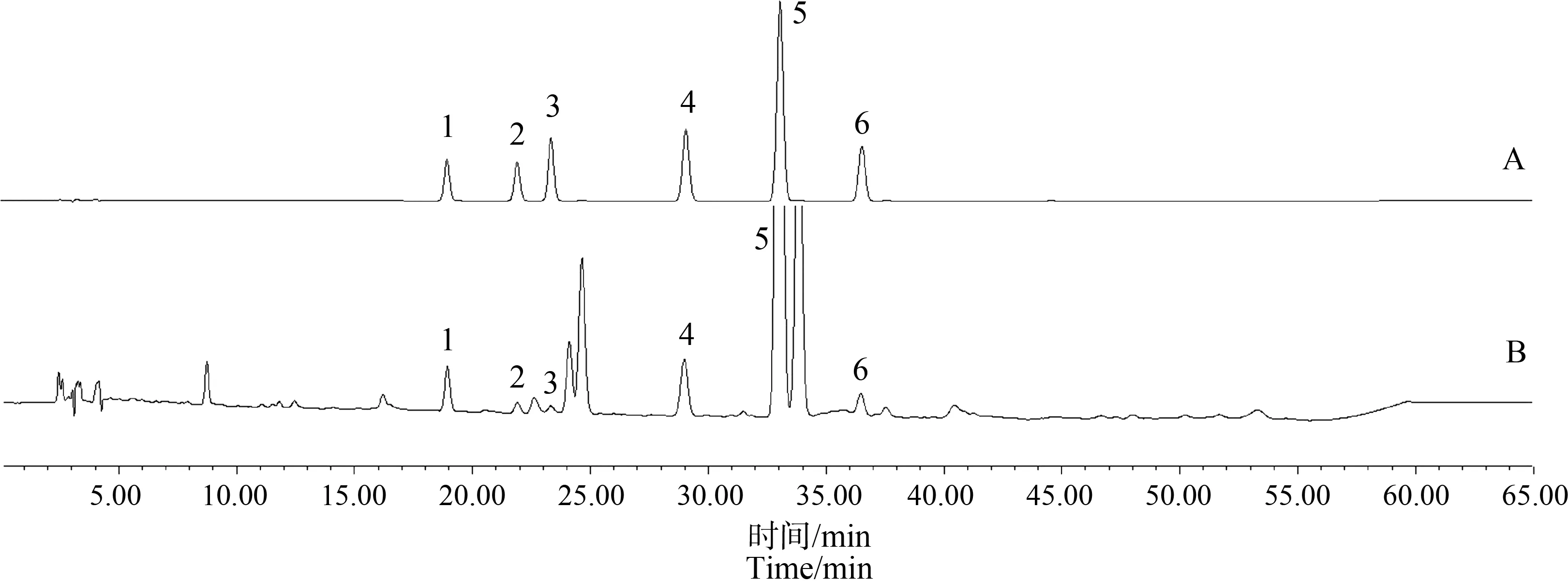
图2 对照品(A)及根际土样品(B)HPLC色谱图注:1.对羟基苯甲酸;2.香草酸;3.丁香酸;4.香草醛;5.对香豆酸;6.阿魏酸。Fig. 2 HPLC chromatogram of reference substance (A) and rhizosphere soil sample (B)Note: 1. p-hydroxybenzoic acid; 2. Vanillic acid; 3. Syringic acid; 4. Vanillin; 5. p-coumaric acid; 6. Ferulic acid.
2.2 不同生长时间的半夏块茎(去皮)中酚酸含量的积累变化
不同生长时间的半夏块茎(去皮)中酚酸含量测定结果如表3所示,半夏块茎(去皮)中总酚酸含量范围为9.86~16.58 μg·g-1,不同生长时间总酚酸含量之间存在显著性差异(P<0.05),随生长时间的延长,总酚酸呈先升后降的趋势,当生长时间为60 d时达到最高,约为生长15 d含量的1.7倍。在同一时期半夏块茎中各酚酸的含量有所差异,具体表现为香草醛>香草酸>对羟基苯甲酸>丁香酸>阿魏酸>对香豆酸,香草醛含量约为对香豆酸的11倍。随生长时间的延长,块茎(去皮)中除丁香酸呈逐渐升高的趋势外,其余5种酚酸的含量皆呈先升后降的趋势,且存在显著性差异(P<0.05),对羟基苯甲酸和香草醛在45 d时含量达到最高,香草酸和阿魏酸在45 d时含量达到最高,对香豆酸和丁香酸分别在75 d和90 d时含量达到最高。
2.3 不同生长时间的半夏块茎皮中酚酸含量的积累变化
不同生长时间的半夏块茎皮中酚酸含量测定结果如表4所示,半夏块茎皮中总酚酸含量范围为324.58~399.91 μg·g-1,不同生长时间总酚酸含量存在显著性差异(P<0.05),随生长时间的延长,总酚酸含量呈波动上升的趋势,当生长时间为90 d时含量达到最高,约为生长60 d时含量的1.2倍。半夏块茎皮中各酚酸的含量有所差异,具体表现为香草醛>香草酸>对羟基苯甲酸>阿魏酸>对香豆酸>丁香酸,香草醛含量约为丁香酸的31倍。随生长时间的延长,块茎皮中除对羟基苯甲酸外,其余5种酚酸皆呈波动上升的趋势,且存在显著性差异(P<0.05)。
表2 不同生长时间半夏须根中酚酸含量变化Table 2 Changes of phenolic acids contents in fibrous roots of Pinellia ternata (Thunb.) Breit. at different growth times n=3) (μg·g-1)
表3 不同生长时间半夏块茎(去皮)中酚酸含量变化Table 3 Changes of phenolic acids contents in Pinellia ternata (Thunb.) Breit. tubers (peeled) at different growth times n=3) (μg·g-1)
2.4 不同生长时间的半夏叶中酚酸含量的积累变化
不同生长时间的半夏叶中酚酸含量测定结果如表5所示。总酚酸含量范围为18.94~70.04 μg·g-1,不同生长时间总酚酸之间存在显著性差异(P<0.05),随生长时间的延长,总酚酸呈逐渐上升的趋势,当生长时间为90 d时达到最高,约为生长15 d含量的3.7倍。叶中各酚酸的含量有所差异,具体表现为香草醛>香草酸>对羟基苯甲酸>对香豆酸>丁香酸、阿魏酸,香草醛含量约为丁香酸的6倍。随生长时间的延长,叶中除阿魏酸含量呈先升高后降低的趋势外,其余5种酚酸含量皆呈波动上升的趋势,且存在显著性差异(P<0.05),除香草酸、阿魏酸分别在60 d和75 d时含量达到最高外,其余酚酸均在90 d时含量达到最高。
2.5 不同生长时间的半夏根际土中酚酸含量的积累变化
不同生长时间的半夏根际土中酚酸含量测定结果如表6所示,半夏根际土中总酚酸含量范围为0.5773~1.2694 μg·g-1,不同生长时期总酚酸含量存在显著性差异(P<0.05),随时间的延长总酚酸含量呈先升后缓慢下降的趋势,当生长时间为75 d时达到最高,约为生长15 d含量的2.2倍。根际土中各酚酸的含量有所差异,具体表现为对香豆酸>对羟基苯甲酸>香草醛>香草酸>丁香酸>阿魏酸,对香豆酸含量约为阿魏酸含量的22倍。随生长时间的延长,根际土中除对香豆酸含量呈逐渐升高的趋势外,其余酚酸的含量皆呈先升后降的趋势,且存在显著性差异(P<0.05),除丁香酸和对香豆酸分别在60 d和90 d时含量达到最高外,其余酚酸均在75 d时含量达到最高。
2.6 半夏植株不同部位酚酸最终积累量
半夏植株不同部位酚酸最终积累量测定结果如表7所示,半夏植株不同部位酚酸除丁香酸和对香豆酸外,其余酚酸的最终积累量均存在显著性差异(P<0.05),总酚酸积累量以半夏须根最高,块茎(去皮)最低,大小规律为:须根>茎皮>叶>块茎(去皮)(P<0.01),须根约为块茎(去皮)的42倍。半夏植株中6种酚酸的积累规律为:对香豆酸>香草醛>香草酸>对羟基苯甲酸>阿魏酸>丁香酸,其中对香豆酸积累量以须根最高,达410.92 μg·g-1,块茎(去皮)最低,须根积累量约为块茎(去皮)积累量的708倍。对羟基苯甲酸、香草酸、丁香酸、香草醛和阿魏酸则均以块茎皮积累量最高,块茎(去皮)最低。
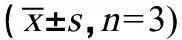
表4 不同生长时间半夏块茎皮中酚酸含量变化Table 4 Changes of phenolic acids contents in tuber skin of Pinellia ternata (Thunb.) Breit. at different growth times n=3) (μg·g-1)
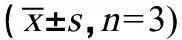
表5 不同生长时间半夏叶中酚酸含量变化Table 5 Changes of phenolic acids contents in leaf of Pinellia ternata (Thunb.) Breit. at different growth times n=3) (μg·g-1)
2.7 对香豆酸对半夏种茎萌发的影响
由表8可知,半夏种茎在对香豆酸胁迫下,除根长随胁迫浓度的升高呈下降的趋势外,其余3个指标皆随胁迫浓度的升高呈先升后降的趋势。其中,当胁迫浓度达到0.6496 mg·L-1,即石英砂中浓度为109.33 μg·g-1时,半夏的发芽率、发芽指数、发芽势和根长皆显著低于对照组(P<0.05),分别较对照组(0.00 mg·L-1)降低了13.93%、17.31%、45.00%和24.43%,化感指数分别为-0.14、-0.17、-0.21和-0.24。
3 讨论(Discussion)
半夏植株各部位总酚酸最终积累量的规律为须根>块茎皮>叶>块茎(去皮);随生长时间的延长,半夏植株不同部位中6种酚酸不断积累,均在60~90 d时达到最高,其中对香豆酸含量最高,且大部分存在于须根中,此时半夏根际土中对香豆酸和总酚酸含量达到最高。实验所用根际土为石英砂,故最终半夏根际土中对香豆酸和总酚酸均来自半夏植株,推测半夏分泌的酚酸类物质对香豆酸占主要地位。半夏块茎(去皮)的对香豆酸和总酚酸均是先增加后降低,但最终块茎(去皮)的对香豆酸和总酚酸较初始时有所增加的。第75天半夏块茎(去皮)中对香豆酸和总酚酸开始降低,而第75天时半夏须根和块茎皮中的对香豆酸和总酚酸开始急剧增加,推测半夏块茎(去皮)中的对香豆酸和总酚酸均向半夏的须根和块茎皮中转移。
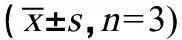
表6 不同生长时间半夏根际土中酚酸含量变化 Table 6 Changes of phenolic acids contents in rhizosphere soil of Pinellia ternata (Thunb.) Breit. at different growth times n=3) (μg·g-1)
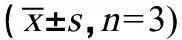
表7 半夏植株不同部位酚酸最终积累量Table 7 Final accumulation of phenolic acids in different parts of Pinellia ternate (Thunb.) (μg·g-1)
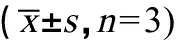
表8 对香豆酸对半夏种茎萌发的影响Table 8 Effect of p-coumaric acid on seed stem germination of Pinellia ternate n=3)
当对香豆酸浓度达到109.33 μg·g-1时,能显著降低半夏种茎的发芽率,而在第90天时半夏须根中的对香豆酸含量为410.92 μg·g-1,远大于胁迫的浓度。据此可以推测半夏植株会向土壤中释放酚酸,使得半夏土壤中总酚酸和对香豆酸达到胁迫的阈值,从而使得半夏在连作过程中产生化感自毒作用。何志贵[11]的研究表明,化感自毒物质是引起半夏连作障碍的重要因素,其中酚酸是其重要的组成成分。张丹等[15]的研究表明栽培过程中随黄连生长年限的增加,连作地土壤中总酚酸的含量均表现为增加。吴立洁等[12]研究发现,三七根际土壤中对羟基苯甲酸、香草酸、丁香酸、对香豆酸、阿魏酸和苯甲酸6种酚酸类物质是由三七植物须根残体腐解产生。徐小军等[16]的研究表明,随着阿魏酸质量浓度的提高,西瓜根和茎中的超氧阴离子浓度及膜质过氧化程度显著增加;张恩平等[17]研究发现,苯甲酸和肉桂酸会破坏番茄根部保护酶系统的平衡,造成了根系的膜质过氧化,沈玉聪等[18]在研究酚酸类物质对三七幼苗的化感影响时发现,外源性添加对香豆酸会降低幼苗根系活力和株高。有研究表明,对香豆酸处理幼苗后,植株体内可溶性蛋白含量、过氧化氢酶活性、过氧化物酶活性以及超氧化物歧化酶活性均有所降低,从而抑制了小麦的地下根的生长[19]。对香豆酸处理大豆后会显著降低干物质产量、叶片膨胀、高度、叶片产量、净同化率(单位叶面积干物质产量的比率)和叶面积持续时间(处理间隔期间存在的总叶面积)[20]。据此分析,本研究中当半夏植株的须根中的对香豆酸浓度≥109.33 μg·g-1时,须根的抗氧化酶系统皆开始遭到破坏,无法抵抗对香豆酸引起的自毒作用,最终抑制了半夏幼苗的生长发育,乃至通过影响半夏根系的生长发育和植株叶片的化合作用引起半夏长期连作的提前倒苗,进而导致减产和土壤病的发作。推测半夏产地的连作障碍可能是每年半夏采收后残留的须根残体经腐解后产生了对香豆酸、阿魏酸和对羟基苯甲酸等酚酸类物质,对其产生了毒害作用。
Bai等[21]研究发现,烟草的连作降低土壤pH,促进酚酸积累,从而改变细菌群落结构和多样性,最终影响烟草生长。有研究发现,对香豆酸通过增加镰刀菌型等有害菌群,减少有益菌群,改变了黄瓜根际细菌和真菌群落的结构和组成,导致黄瓜发生自毒效应[22-23]。据此分析,在半夏产地长期连作过程中,土壤中的对香豆酸不断积累,在这个过程中对香豆酸可能会改变半夏土壤中的微生物平衡,通过促进有害微生物增加,抑制有益型微生物的生长,从而导致半夏的化感自毒作用。本研究发现对香豆酸浓度达到较高浓度时能显著抑制半夏种茎的萌发,在不同时间段半夏植株各部位酚酸最终积累量均是以半夏须根中对香豆酸含量最高,可以推测半夏植株特别是半夏须根可能是连作土壤中酚酸类化感物质的潜在来源,对香豆酸为重要的酚酸类化感物质,对香豆酸可能为半夏植株中重要的次生代谢产物,其对半夏植株生长的意义还有待进一步研究。
综上所述,半夏植株不同部位均含相同的6种酚酸类成分,分别为对香豆酸、香草醛、香草酸、对羟基苯甲酸、阿魏酸和丁香酸,其总酚酸含量以半夏的须根最高,规律为须根>块茎皮>叶>块茎(去皮)。随生长时间的延长,半夏的块茎皮、须根、叶和根际土中的对香豆酸和总酚酸呈波动上升的趋势,不断积累,最终在第90天时达到最高;而半夏块茎(去皮)中的对香豆酸和总酚酸在75 d时达到最高,但此时半夏块茎(去皮)的对香豆酸和总酚酸开始向半夏的须根和根际土壤中转移,进一步使半夏须根和根际土在第90天时积累的对香豆酸和总酚酸含量达到更高。而其他5种酚酸均在60~90 d时达到最高。第75天时半夏须根中对香豆酸含量达410.92 μg·g-1,是引发半夏自毒作用而抑制半夏幼苗生长发育所需浓度的2倍。
