阿替普酶联合长春西汀对急性缺血性脑卒中患者的有效性及安全性研究
2021-03-25董智强陈旭过岚洪媛曹锦秀朱培红曹立梅
董智强,陈旭,过岚,洪媛,曹锦秀,朱培红,曹立梅
上海市第八人民医院神经内科1、老年护理病区2,上海 200235
急性缺血性脑卒中(acute ischemic stroke,AIS)是所有脑卒中类型疾病中发病率最高的疾病之一,具有较高的病死率与致残率[1]。目前临床治疗AIS 的有效溶栓药物包括重组组织型纤溶酶原激活剂(recombinant tissueplasminogen activator,rtPA)-阿替普酶(Alteplase),常在AIS发病后的3~4.5 h 内进行治疗,但由于阿替普酶在治疗时机与禁忌证方面的局限,往往获得有效救治的患者仅占3%~5%[2-3]。长春西汀药理可提高病灶区血氧运输,加快脑细胞有氧代谢与腺苷三磷酸合成,参与神经元的保护,也可用于AIS 的治疗[4]。现阶段关于阿替普酶联合长春西汀用药研究报道较少,疗效有待进一步证实。本文重点探讨阿替普酶联合长春西汀治疗AIS患者的有效性及安全性。
1 资料与方法
1.1 一般资料 回顾性分析2017年12月至2019年1 月上海市第八人民医院神经内科收治80 例符合以下纳入和排除标准的AIS患者的临床资料。纳入标准:(1)符合牛津郡社区卒中研究分型(OCSP)中完全前循环梗死、部分前循环梗死亚型标准[5];经头颅影像学检查未观察到颅内出血与早期出现大范围的梗死;(2)发病时间低于4.5 h;(3)美国国立卫生研究院卒中量表(NIHSS)评分>4分以上。排除标准:(1)脑部出血、创伤性脑外伤及严重昏迷患者;(2)治疗前血压上升(收缩压/舒张压>180/110 mmHg,1 mmHg=0.133 kPa);(3)合并严重心、肝、肺、肾疾病与血液系统疾病患者;(4)患者凝血酶原时间>15 s者;(5)6周中经大手术或严重创伤;(6)合并精神障碍、帕金森等疾病;(7)临床资料不全者。根据不同治疗方法将患者分为阿替普酶组40例,联合组(阿替普酶联合长春西汀治疗)40例,两组患者的性别、年龄、合并症、发病时间、梗死部位及梗死体积与HINSS 评分等一般资料比较差异均无统计学意义(P>0.05),具有可比性,见表1。
表1 两组患者的一般资料比较[,例(%)]
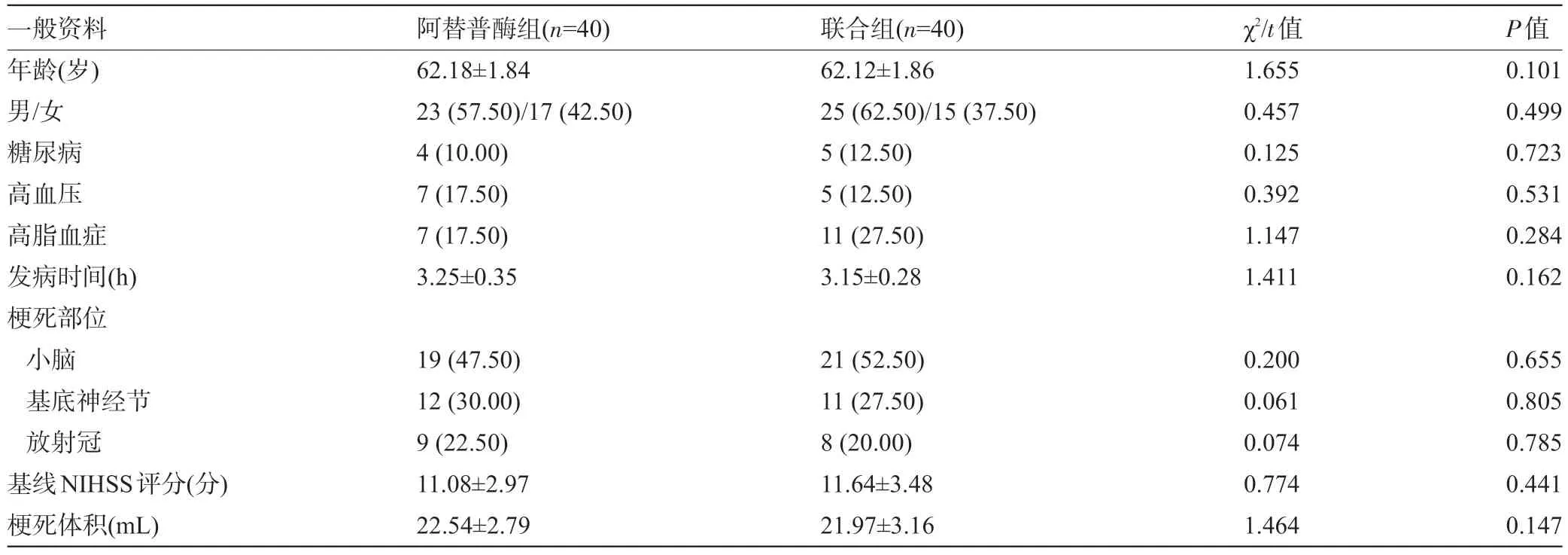
表1 两组患者的一般资料比较[,例(%)]
一般资料年龄(岁)男/女糖尿病高血压高脂血症发病时间(h)梗死部位小脑基底神经节放射冠基线NIHSS评分(分)梗死体积(mL)阿替普酶组(n=40)62.18±1.84 23(57.50)/17(42.50)4(10.00)7(17.50)7(17.50)3.25±0.35联合组(n=40)62.12±1.86 25(62.50)/15(37.50)5(12.50)5(12.50)11(27.50)3.15±0.28 χ2/t值1.655 0.457 0.125 0.392 1.147 1.411 P值0.101 0.499 0.723 0.531 0.284 0.162 19(47.50)12(30.00)9(22.50)11.08±2.97 22.54±2.79 21(52.50)11(27.50)8(20.00)11.64±3.48 21.97±3.16 0.200 0.061 0.074 0.774 1.464 0.655 0.805 0.785 0.441 0.147
1.2 方法
1.2.1 阿替普酶组 该组患者给予0.9 mg/kg 阿替普酶(最大剂量90 mg),总剂量的10%1 min团注,余下药物与0.9%生理盐水100 mL充分混合后滴注60 min。
1.2.2 联合组 该组患者给予0.9 mg/kg 阿替普酶(最大剂量90 mg),总剂量的10%1 min团注,剩余剂量与0.9%生理盐水100 mL 混合后静脉滴注60 min;长春西汀规格:商品名韩都,为针剂,10 mg/支;于溶栓时静滴20 mg,并于溶栓后第1 天至第5 天,每日静滴一次,每次20 mg。
所有患者同时进行血糖、血压监测,从治疗开始严密监测患者神志状态、四肢活动、眼球运动与瞳孔变化,若发生颅内出血,则根据个体现状参考美国国立神经疾病和卒中研究所(National Institutes of Neurological Disorders and Stroke,NINDS)研究[6]推荐的方案治疗。
1.3 观察指标与评价方法 (1)神经功能缺损程度:在溶栓治疗前、溶栓治疗24 h后、14 d及90 d 时采用美国国立卫生研究院卒中量表(NIHSS)评分对患者的神经功能缺损程度进行评估[7],评分越高表明患者神经功能缺损程度越严重;(2)淋巴细胞计数:所有入组患者静脉溶栓前,溶栓治疗24 h 后、14 d、90 d 取静脉血于EDTA抗凝管中采用流式细胞学(FACS)分析以获得血淋巴细胞计数(CD4+T、CD8+T、CD19+B 和CD56+自然杀伤细胞)变化情况;(3)神经功能:溶栓90 d后采用改良卒中后神经功能量表Rankin 量表(Modified Rankin Scale,mRS)评分评估患者神经功能恢复现状[8],评分越高表明患者神经功能恢复越差。(4)并发症与不良事件:并发症包括心肌梗死、脑梗死复发、脑疝;不良事件包括胃肠道出血、肺部感染、心律失常、体温升高。
1.4 统计学方法 应用SPSS20.0 统计软件对数据进行统计分析。计量资料经正态性和方差齐性检验,呈正态分布,以均数±标准差()表示,组间比较采用独立样本t 检验,计数资料组间比较采用χ2检验。以P<0.05为差异有统计学意义。
2 结果
2.1 两组患者溶栓前及溶栓后24 h、14 d 及90 d的NIHSS 评分比较 两组患者溶栓前的NIHSS 评分比较差异无统计学意义(P>0.05);溶栓治疗后,两组患者的NIHSS评分明显较溶栓前明显下降,且联合组在溶栓后 24 h、14 d 及 90 d 的 NIHSS 评分明显优于阿替普酶组,差异均具有统计学意义(P<0.05),见表2。
表2 两组患者溶栓前及溶栓后24 h、14 d 及90 d 的NIHSS 评分比较(,分)
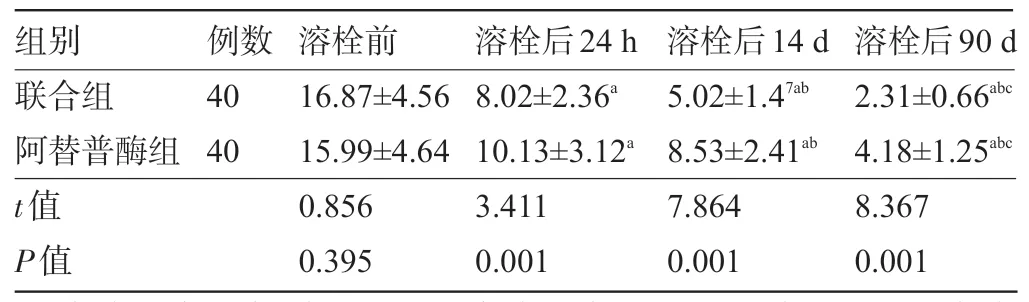
表2 两组患者溶栓前及溶栓后24 h、14 d 及90 d 的NIHSS 评分比较(,分)
注:与本组溶栓前比较,aP<0.05;与本组溶栓后24 h比较,bP<0.05;与本组溶栓后14 d比较,cP<0.05。
组别联合组阿替普酶组2.31±0.66abc 4.18±1.25abc 40 40 16.87±4.56 15.99±4.64 8.02±2.36a 10.13±3.12a 5.02±1.47ab 8.53±2.41ab t值P值溶栓后90 d 8.367 0.001例数 溶栓前0.856 0.395溶栓后24 h 3.411 0.001溶栓后14 d 7.864 0.001
2.2 两组患者溶栓后90 d的mRS评分比较 两组患者溶栓治疗后mRS 评分≥3 分患者明显减少,且联合组在溶栓后90 d 的mRS 评分明显优于阿替普酶组,差异有统计学意义(χ2=7.680,P=0.005),见表3。

表3 两组患者溶栓后90 d的mRS评分比较[例(%)]
2.3 两组患者溶栓前及溶栓后24 h、14 d 及90 d的淋巴细胞计数比较 联合组患者溶栓后24 h、14 d的CD4+T,CD8+T,CD19+B 和 CD56+自然杀伤细胞较溶栓前明显下降,差异均有统计学意义(P<0.05),但溶栓后90 d 与溶栓前比较差异无统计学意义(P>0.05);阿替普酶组患者溶栓后24 h、14 d 的CD4+T、CD8+T、CD19+B 和CD56+自然杀伤细胞较溶栓前明显下降,差异均有统计学意义(P<0.05),但溶栓后90d与溶栓前比较,差异无统计学意义(P>0.05);联合组患者溶栓后24 h、14 d 时的CD4+T、CD8+T、CD19+B 和 CD56+自然杀伤细胞与阿替普酶组比较明显下降,差异均具有统计学意义(P<0.05),但溶栓90 d 后,两组患者的CD4+T、CD8+T、CD19+B 和 CD56+自然杀伤细胞比较差异均无统计学意义(P>0.05),见表4。
表4 两组患者溶栓前及溶栓后24 h、14 d和90 d的淋巴细胞计数比较()

表4 两组患者溶栓前及溶栓后24 h、14 d和90 d的淋巴细胞计数比较()
注:与组内溶栓前比较,aP<0.05;与组内溶栓24 h比较,bP<0.05;与组内溶栓14 d比较,cP<0.05;与同时段的联合组比较,dP<0.05。
组别联合组例数40阿替普酶组40时间溶栓前溶栓后24 h溶栓后14 d溶栓后90 d溶栓前溶栓后24 h溶栓后14 d溶栓后90 d CD4+T 38.43±2.54 27.18±1.87a 18.61±1.95ab 37.52±2.31c 37.43±2.74 32.15±2.42ad 34.15±2.18abd 36.95±1.87ac CD8+T 39.18±2.48 28.64±1.92a 17.61±2.32ab 38.48±2.15c 39.45±3.03 37.64±1.52ad 33.64±2.68abd 38.64±1.82ac CD19+B 37.45±4.62 25.47±2.85a 21.97±3.21ab 35.97±2.95c 36.37±4.08 31.64±3.74ad 32.64±3.86ad 34.84±3.74ac CD56+自然杀伤(NK)细胞18.14±3.41 14.52±2.91a 11.47±2.10ab 17.44±3.72c 19.02±3.27 18.05±2.97ad 15.05±2.05abd 17.05±2.85ac
2.4 两组患者的并发症及不良事件比较 两组患者均未出现死亡、心肌梗死、脑梗死复发、脑疝等并发症。联合组中1 例患者出现胃肠道出血,不良事件发生率为2.50%(1/40);阿替普酶组中3例胃肠道出血、1 例疑似肺部感染,不良反应事件发生率为10.00(4/40),两组患者的不良反应发生率比较差异无统计学意义(χ2=1.920,P=0.166)。
3 讨论
诸多研究已证实,AIS 患者的预后与血管再通密切相关,而动脉再通、脑组织再灌注的关键则在于早期神经功能恢复,因此,临床中常把改善神经功能作为治疗AIS 疗效评估的重要指标[8-10]。本研究结果显示,AIS患者采用阿替普酶联合长春西汀治疗后,患者神经功能mRS 评分与神经功能缺损程度NIHSS 评分均显著低于阿替普酶组,表明与单一使用阿替普酶治疗比较,采用阿替普酶联合长春西汀治疗对改善神经功能的效果更明显。考虑其原因可能为,阿替普酶可将纤维蛋白溶酶转化为纤维蛋白溶酶,进一步降解纤维蛋白而清除血栓,短时间中改善缺血半暗带区脑组织血液循环,但该药易受年龄、疾病严重程度、症状及用药时间的影响而影响药物治疗效果。欧洲急性卒中协会研究结果发现,在AIS发病后的3~4.5 h静脉用阿替普酶有较好的临床疗效,但当中有部分患者神经功能缺损并未恢复,甚至出现神经功能恶化[11]。余爱军等[12]研究也发现,采用阿替普酶静脉溶栓后AIS 患者出现早期神经功能恶化的发生率为15.35%,并且发现年龄、糖尿病、白细胞计数、NIHSS评分较低等是影响阿替普酶治疗发生神经功能恶化的危险因素。上述文献中可以发现单一采用阿替普酶治疗AIS易受多方面因素影响而不利于神经功能及缺损的恢复,而联合组更好的改善了患者的神经功能及缺损,可能与长春西汀可提高病灶区血氧运输,加快脑细胞有氧代谢与ATP 合成,保护脑神经元有关,且该药物的稳定性较强,不易受年龄、合并症、白细胞计数等多方面因素的影响,可弥补阿替普酶的不足[13-14]。
本研究结果还显示,联合组患者溶栓后24 h、14 d时的CD4+T、CD8+T、CD19+B 和 CD56+自然杀伤细胞较阿替普酶组下降更明显。炎症是参与AIS 病情进展变化中的关键病理变化,有研究发现,CD4+T、CD8+T、CD19+B 和CD56+自然杀伤细胞在炎症反应及免疫应答中具有关键作用[15]。长春西汀长期用于脑血管疾病和认知损伤疾病的治疗中,被认为具有减轻炎性细胞浸润与炎性反应的作用[16]。临床动物试验发现,长春西汀参与作用于IKK 激酶,从而阻止I-κB 磷酸化水解,减弱NF-κB 作用,抑制炎症因子的基因转录功能[17]。ZHANG 等[18]研究发现,长春西汀治疗可降解 I-κBa 磷酸化,并提高 I-κBa mRNA 转录,调控NF-κB 活性减轻炎症反应。上述文献提示长春西汀具有一定的抗炎作用,可改善机体免疫促进AIS 患者尽快恢复。而两组在溶栓90 d 后CD4+T、CD8+T、CD19+B 和CD56+自然杀伤细胞比较无统计学意义,可能与患者疾病症状逐渐控制,机体逐渐恢复免疫力明显改善有关。
本研究在并发症及不良反应方面发现,两组患者均未出现死亡、心肌梗死、脑梗死复发、脑疝等并发症。联合组中1 例患者出现胃肠道出血不良反应,不良事件发生率为2.50%(1/40),阿替普酶组中3例胃肠道出血、1 例疑似肺部感染,并未见其他不良事件,不良反应事件发生率为10.00(1/40),无论是单一用药还是联合用药,均未出现严重并发症或不良反应事件,推测与本研究纳入对象在发病4.5 h 内获得及时治疗有关,减少了发病时间过长对药物作用的干扰。
综上所述,阿替普酶联合长春西汀疗效优于单一药物治疗,联合治疗可明显改善神经功能、神经功能缺损及免疫功能,本研究未见严重不良反应进一步验证了药物的安全性。但本研究仍存在不足之处是样本量小及属于单中心研究,待后续纳入更多病例展开多中心研究,其次是关于长春西汀抗炎治疗AIS的作用机制本并未明确,可作为未来的研究方向深入探讨。
