瘦素激活PI3K/Akt信号通路分泌白介素8促进乳腺癌MCF-7细胞上皮间质转化
2021-03-25王林樊清清段雯婷王维
王林,樊清清,段雯婷,王维
1.西安市第一医院检验科,陕西 西安 710002;2.西安市第一医院药剂科,陕西 西安 710002;3.西安市第一医院心血管内科,陕西 西安 710002;4.西安市儿童医院检验科,陕西 西安 710003
越来越多的流行病学证据表明,以脂肪堆积过多为特征性病变的肥胖,已经快速发展成全球性的健康问题[1]。肥胖不仅可以引起身体各种代谢并发症,亦可增加患者罹患多种激素依赖性肿瘤的风险,同时显著促进肿瘤的进展及不良预后过程,此现象在绝经后妇女乳腺癌患者的病例中尤为显著[2-4]。众所周知,细胞因子、炎性趋化因子和脂肪因子分泌失调所导致的脂肪细胞增生、肥大参与了肿瘤发生发展的病理过程。在众多因子中,有致癌性的脂肪因子——瘦素(Leptin),被认为是关联肥胖和乳腺癌的一种最重要的分子中介。相比于正常乳腺上皮细胞,瘦素在乳腺肿瘤细胞中过表达[5-7]。另有研究表明,Leptin 受体(Ob-R)广泛表达于人体内各种组织及肿瘤细胞上,Leptin 通过与肿瘤细胞上的Ob-R 结合可诱导其生存、迁移、侵袭等特性[8-9]。事实上除了研究Leptin 促进肿瘤细胞的发生和转移过程,人们对于Leptin 在乳腺癌细胞上皮细胞间质化(EMT)过程中所发挥的作用较少研究。
EMT 是贴壁上皮样细胞到间充质样细胞表型转换的过程,在胚胎形成、组织修复、伤口愈合以及各种病理情况如恶性肿瘤细胞的侵袭转移中起重要作用。近期研究表明EMT 是多种癌症进展中的一个重要的启动因子,与肿瘤的转移、复发以及不良预后关系紧密[7,10-12]。发生EMT 的细胞,其上皮细胞标志物钙黏蛋白(E-cadherin)表达受抑制,间质细胞标志物如波形蛋白(Vimentin)表达升高。研究表明发生EMT的癌细胞可分泌多种细胞因子、生长因子和趋化因子,如白介素8(IL-8)[13]。IL-8是一种由巨噬细胞、上皮细胞等分泌的趋化因子,和包括乳腺癌在内的多种肿瘤细胞的增殖、血管形成、侵袭移扩散等过程密切相关[14]。
本研究以人乳腺癌MCF-7细胞为体外研究对象,分析Leptin 对其EMT 的作用并以趋化因子IL-8 为切入点探讨其可能的分子途径,为Leptin 参与乳腺癌的发生发展机制的阐明提供依据和线索。
1 材料与方法
1.1 材料 人MCF-7乳腺癌细胞株由西安市第一医院检验科保存;Leptin 购买于Peprotech 公司;DMEM 培养基购买于Gibco 公司;胎牛血清购买于杭州四季青生物研究所;SDS-PAGE 蛋白缓冲液和封闭蛋白购买于武汉;蛋白Marker购买于北京赛百盛基因技术有限公司;细胞裂解液购买于碧云天生物研究所;HRP 发光试剂购买于Millipore公司;兔抗人Ob-R和IL-8 抗体购买于Santa Cruz 公司;兔抗人p-AKT、AKT 抗体购买于Cell Signaling 公司;兔抗人E-cadherin、Vimentin,鼠 抗 β-actin 抗 体 均 购 买 于Bioworld公司;二抗购于中杉金桥公司。
1.2 方法
1.2.1 细胞培养 MCF-7 细胞用含100 mL/L 胎牛血清的DMEM 培养基在37℃、50 mL/L CO2条件下进行培养。
1.2.2 免疫荧光法检测MCF-7 细胞Leptin 受体Ob-R蛋白表达 取常规培养对数生长期的MCF-7细胞,以3×105/孔的浓度于6孔板中培养,细胞加入兔抗人Ob-R(1:100)及FITC标记的二抗(羊抗兔IgG 1:1 000稀释),于荧光显微镜下观察荧光形态,其中细胞核经DAPI染色。
1.2.3 显微镜观察Leptin 对MCF-7 细胞形态的影响 实验分为对照组、Leptin 处理组,取对数期的MCF-7 细胞,经2.5 g/L 胰酶消化和磷酸盐缓冲液(PBS)洗涤后,用DMEM 培养液重悬,使细胞浓度为3×105/mL,按100 μL/孔的量加入 6 孔板中,于37℃、50 mL/L CO2培养 16 h,细胞同步化后,经 3 遍 PBS 清洗后加入DMEM培养液,PBS组、Leptin组分别经PBS及100 ng/mL Leptin处理,作用48 h 后,于显微镜观察MCF-7细胞形态。
1.2.4 Western blot 法检测 Leptin 对 MCF-7 细胞EMT 相关蛋白 E-cadherin、Vimentin 表达的影响 实验分组及处理同1.2.3,作用48 h 后,按试剂盒要求提取总蛋白,取120 μg 总蛋白行100 g/L SDS-PAGE,经干转的PVDF膜以TBST(含50 g/L脱脂奶粉)4℃封闭4 h后加入兔抗人E-cadherin,Vimentin(1∶1 000)一抗于4℃孵育过夜,经2次TBST洗涤和1次TBS洗涤;加入二抗(羊抗兔IgG 1∶1 000 稀释)室温孵育1 h,重复洗涤过程;滴加HRP 发光试剂,于暗室静置2 min,应用Bio-Rad 凝胶成像系统采集图像,用Quantity One4.6.6 软件分析条带光度值,检测经Leptin 作用后MCF-7 细胞 E-cadherin、Vimentin 蛋白表达变化,实验重复3次。
1.2.5 Western blot 法检测 Leptin 对 MCF-7 细胞IL-8 分泌及信号通路分子p-AKT 表达的影响 实验分组、细胞处理及Western blot 检测方法同上,其中一抗兔抗人 p-AKT、AKT,兔抗人 IL-8 按 1∶1 000 稀释。检测经Leptin作用后MCF-7细胞IL-8、p-AKT蛋白的表达变化,实验重复3次。
1.2.6 免疫荧光法检测IL-8 在Leptin 促MCF-7细胞EMT过程中的作用 实验分为PBS组、Lepin组、Leptin+anti-IL-8组及Leptin+IgG组。后两组在Leptin处理前1 h,分别加入IL-8 特异性抗体(1 μg/mL)及对照抗体IgG,孵育48 h,加入兔抗人E-cadherin、Vimentin (1∶100 稀释)及 FITC 标记的二抗(羊抗兔IgG 1∶1 000 稀释),于荧光显微镜下观察荧光形态。
1.3 统计学方法 应用SPSS19.0 软件进行数据统计分析,计量资料以均数±标准差()表示,组间比较采用t 检验,以P<0.05 为差异具有统计学意义。
2 结果
2.1 MCF-7 细胞Ob-R 的表达 免疫荧光检测表明 MCF-7 细胞 Ob-R 有表达(图 1)。

图1 免疫荧光检测MCF-7细胞上Ob-R的表达(×400)

图2 显微镜观察Leptin对MCF-7细胞EMT过程的影响(×200)
2.2 Leptin对MCF-7细胞EMT过程的影响 显微镜形态观察(图2)检测表明Leptin能引起MCF-7细胞发生EMT改变,形态表现为极性消失,黏附性下降,细胞间连接变松散。Western blot法(图3)检测上皮标记物E-cadherin和间质标记物Vimentin蛋白的相对表达量,其中 E-cadherin 的表达 Leptin 组(0.14±0.04)较PBS 组(0.84±0.06)显著下降,差异有统计学意义(t=17.033,P<0.05),Vimentin 的表达Leptin 组(1.04±0.14)较PBS 组(0.12±0.02)显著增加,差异有统计学意义(t=11.153,P<0.05)。 以 上 结 果 均 表 明 Lepin 可 促 进MCF-7细胞上EMT过程。
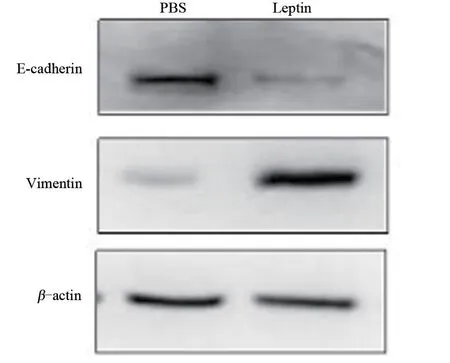
图3 Western blot检测Leptin对MCF-7细胞EMT过程的影响
2.3 Leptin 促进 MCF-7 细胞 p-Akt 的表达及IL-8 的分泌 Western blot 法(图 4)检测 p-Akt、Akt、IL-8 蛋白的相对表达量,其中p-Akt 的表达Leptin 组(0.81±0.07)较PBS组(0.11±0.03)显著上调,差异有统计学意义(t=15.566,P<0.05),Akt 的表达 Leptin 组(0.91±0.04)较PBS 组(0.89±0.07)上调,差异无统计学意义(t=0.349,P>0.05),IL-8 的表达 Leptin 组(0.90±0.07)较PBS 组(0.14±0.03)显著上调,差异有统计学意义(t=17.239,P<0.05)。
2.4 IL-8在Leptin促MCF-7细胞EMT过程中的作用 免疫荧光结果(图5)显示,相对于Leptin+IgG组,Leptin+anti-IL-8 组上皮相关分子 E-cadherin 相对荧光表达量由29.73±1.51 降低为6.29±0.54,差异有统计学意义(t=25.23,P<0.05);间质相关分子Vimentin 相对荧光表达量由 3.90±0.39 升高为 23.38±0.81,差异有统计学意义(t=37.55,P<0.05)。表明Leptin促MCF-7 细胞EMT 作用可被IL-8 的特异性抗体逆转,即Leptin 主要通过促进MCF-7细胞分泌IL-8进而介导其EMT过程。

图 4 Western blot 检测 Leptin 对 MCF-7 细胞 p-AKT 的表达及IL-8 分泌的影响

图5 Western blot检测IL-8在Leptin促MCF-7细胞EMT过程中的作用(×400)
3 讨论
EMT是上皮细胞转化为间质细胞的过程,参与胚胎发生、伤口愈合、组织再生等过程。近年来EMT在多种肿瘤包括乳腺癌的形成、发展中发挥的作用成为人们关注的热点。发生EMT过程的细胞-细胞、细胞-细胞外基质的相互作用被重塑,导致上皮细胞之间以及上皮细胞与基底膜之间的黏附性降低,促进肿瘤细胞的侵袭和迁移以及增加了肿瘤对临床干预的耐受[15-17]。
Leptin 是一种脂肪组织分泌的激素,据文献报道其可促进多种肿瘤细胞EMT 过程,包括乳腺癌。Leptin 所诱导的乳腺癌发生发展是否与其促进EMT过程相关以及所涉及的中介分子和信号级联机制有哪些成为近年来研究的热点。研究表明肿瘤EMT 的发生依赖于肿瘤微环境中的各种可溶性生长因子、细胞因子或细胞外基质成分等信号刺激,包括EGF、TGF-β、IL-6、IL-8 等因子,这些细胞因子在各类癌症中均可促进EMT过程[13]。IL-8与肿瘤的生长、侵袭迁移密切相关,有报道乳腺癌患者血清IL-8水平与肿瘤进展和生存率降低呈正相关,然而机制尚不明确。本文以IL-8为切入点,研究Leptin对乳腺癌MCF-7细胞EMT过程的影响,以及探索其可能涉及的机制和信号通路。
本研究结果显示,MCF-7 细胞中有Leptin 受体Ob-R 的表达。Leptin 能促进 MCF-7 的 EMT 过程,形态观察发现细胞极性丧失、细胞间黏附性降低,细胞外基质重组,由典型多边形上皮细胞形态向梭形间充质细胞形态转变。同时上皮标志蛋白E-cadherin表达下降,间充质标志蛋白Vimentin表达升高。据文献报道,PI3K/AKT信号通路在Leptin的促肿瘤效应中发挥重要作用[7,18],本研究结果显示,和PBS组相比,Leptin显著上调MCF-7细胞p-Akt的表达,促进MCF-7细胞IL-8 的分泌。为进一步探讨IL-8 在Leptin 所介导的MCF-7细胞EMT过程中的作用,采用抗体封闭IL-8,结果发现MCF-7 细胞上皮标志蛋白E-cadherin 和间充质标志蛋白Vimentin表达逆转,即Leptin对MCF-7细胞的促EMT作用与IL-8介导密切相关。
根据以上实验结果,本研究初步断定Leptin 能促进乳腺癌MCF-7 细胞的EMT 过程,并推断其机制可能与Leptin激活PI3K/AKT信号通路上调IL-8的表达有关,为乳腺癌的生物治疗提供了靶点及实验依据。但是对于Leptin所诱导分泌的IL-8 对MCF-7 细胞的促EMT效应是通过何种途径实现的,其详细作用机制如何,还有待进一步研究。
