Ang1~7对婴幼儿血管瘤内皮细胞增殖及凋亡的影响
2021-03-25位印吴泽勇黄海华彭智
位印,吴泽勇,黄海华,彭智
1.天津市天津医院整形外科,天津 300211;2.广东医科大学附属医院整形外科,广东 湛江 524000
婴幼儿血管瘤(infantile hemangioma,IH)是儿童常见的肿瘤,多见于女孩、双胞胎、早产儿、低出生体质量以及白色人种婴儿[1]。IH 增殖期的持续时间为8~12个月[2],一般在5~10年内缓慢消退[3],在组织病理学检查中发现单个小动脉供血的多结节样结构[4],结节由增生性内皮细胞组成,随着血管瘤逐渐消退,纤维化变得愈发明显[5]。IH 的发病机理仍未阐明,普遍认为与新血管生成相关,血管内皮细胞生长因子(VEGF)、碱性成纤维细胞生长因子(bFGF)、基质金属蛋白酶-9等在增殖期婴幼儿血管瘤中高表达[6-7],而这些因子促进新血管生成。在缺氧时,促血管生成作用相较于抗血管生成作用更强,从而使肿瘤细胞和基质细胞表达VEGF、bFGF 等而促进血管生成[8-9]。ITINTEANG等[10]研究表明肾素血管紧张素系统经典轴中的血管紧张素转化酶(ACE)和血管紧张素Ⅱ受体2(ATⅡR2)在血管瘤中表达,经典轴中的血管紧张素Ⅱ可促使婴幼儿血管瘤内皮细胞(Hem ECs)的增殖[11]。肾素血管紧张素系统中的血管紧张素转化酶2(ACE2)-Ang1~7-Mas受体新轴被认为是经典轴的反调节轴[12-13]。肾素血管紧张素系统已被证实在多种肿瘤中存在[14],Ang1~7 可发挥抑制肝癌增殖、抑制血管生成及促进肿瘤凋亡作用,机制可能为下调AT ⅡR1 和上调 ATⅡR 2 以及 Mas 受体[15]。PEI 等[16]发现在鼻咽癌组织和细胞系中发现Mas 受体mRNA 和蛋白的表达水平显著上调,Ang1~7的增加可明显抑制细胞的增殖和迁移。在鼻咽癌的异种移植中,Ang1~7显著减小了鼻咽癌体积,而且显著降低血管密度。此外,研究发现Ang1~7 可抑制VEGF 和胎盘生长因子的表达。经典轴中ACE 和AT ⅡR2 已被学者证实在血管瘤中表达,ACE2-Ang1~7-Mas受体新轴是否也存在,是否反向调节血管紧张素Ⅱ(AngⅡ)对Hem ECs 的作用,为此本课题研究了Ang1~7对Hem ECs的影响。
1 材料与方法
1.1 实验材料及主要实验试剂 实验标本来自于2016—2017 年广东医科大学附属医院整形外科经手术切除的未经任何治疗的增殖期的婴幼儿血管瘤组织块3例,患儿家属知情同意,人脐静脉内皮细胞由广州莱德尔生物科技有限公司提供,Ang1~7 由MEC公司提供,Ang1~7 Mas 受体兔抗人多克隆抗体购于Alomone 公司,Annexin V-FITC 试剂盒由 Keygen 公司提供,SYBR Green qPCR SuperMix 由 Invitrogen 公司提供。
1.2 实验方法
1.2.1 Hem ECs 的培养及传代 超净台内磷酸盐缓冲(PBS)液冲洗新鲜婴幼儿血管瘤组织标本,将组织块剪成1 mm3大小,平铺在细胞培养瓶壁,缓缓翻转培养瓶,加入1.5 mL血管瘤内皮细胞培养液,4~6 h后翻转细胞培养瓶,48 h后更换细胞培养液,定期更换培养液。轻敲细胞培养瓶,使贴于瓶底的血管瘤组织块松脱,磷酸盐缓冲液(PBS)清洗,加入胰酶消化1 min后加入血管瘤内皮细胞培养液,1:3接种,用进入对数增长期的细胞进行后续实验。
1.2.2 Hem ECs 的鉴定培养 所得细胞经多聚甲醛固定0.5 h、山羊血清封闭0.5 h、一抗(1:200)第Ⅷ因子相关抗原兔抗人抗体4℃孵育过夜、滴加标记二抗(1:200)鼠抗兔第二抗体,室温避光孵育1 h 后加入C液室温孵育0.5 h,DAB显色,苏木素染色(空白对照组滴加PBS液),封片拍照。
1.2.3 Hem ECs 中 Mas 受体 mRNA 及蛋白质的表达 将Hem ECs 和Mas 受体阳性对照人脐静脉内皮细胞(HUVEC)分别进行RNA 抽提,检测RNA 纯度和完整性并进行逆转录和定量PCR,设计的Mas、18s rRNA引物序列见表1。准备Hem ECs、HUVEC、等离子水上机,95℃ 5 min,95℃ 15 s,65℃ 15 s,72℃ 32 s,40 个循环,每个样品重复3 次。ΔΔCt=血管瘤内皮细胞组(目标基因Ct-内参Ct)-HUVEC 组(目标基因Ct-内参 Ct),相对表达量=2-ΔΔCt值进行数据统计。进行Hem ECs 及阳性对照HUVEC 总蛋白抽提及BCA法蛋白溶液浓度测定。SDS-PAGE 电泳用80 V 至指示染料分离胶,继而用120 V 至染料刚出胶底部,转PVDF 膜,封闭后加入一抗稀释液(1:200)4℃冰箱过夜,滴加二抗稀释液(1:20 000)孵育1 h,涂抹化学发光液后曝光显影。
1.2.4 Ang1~7 对 Hem ECs 增 殖 及 Mas 受 体mRNA表达的影响 调整血管瘤内皮细胞悬液浓度为1×105个/mL,每孔接种细胞悬液100 μL,将不同浓度(0、0.01 μmol/L、0.10 μmol/L、5.00 μmol/L及10.00 μmol/L)Ang1~7 加入 Hem ECs 中,分别培养 24 h、48 h、72 h后收集各个时间点细胞加入检测试剂,酶标仪读数。qRT-PCR 检测Ang1~7(10 μmol/L)作用于血管瘤内皮细胞24 h、48 h的Mas受体mRNA的表达,△Ct=目的基因Ct-内参Ct,△△Ct=待测样品中目的基因△Ct-空白对照组中目的基因△Ct,所得相对表达量=2-ΔΔCt值进行数据统计。

基因Mas-F Mas-R 18s rRNA-F 18s rRNA-R引物序列5"~3′CTTCGCTATGCCCATGAGA AGCCCTGGTCAGAACAACTT CCTGGATACCGCAGCTAGGA GCGGCGCAATACGAATGCCCC
1.2.5 流式细胞仪检测Ang1~7 对Hem ECs凋亡的影响 实验分组为空白对照组和Ang1~7(10 μmol/L)组,将Hem ECs悬液调整细胞密度约1×106个细胞/mL,取0.5 mL置于离心管内,加入10 μmol/L Ang1~7,分别在0 h、24 h、48 h滴加1.25 μL Annexin V-FITC,室温避光反应15 min并离心,用0.5 mL预冷的结合缓冲液轻轻重悬,加入10 μL Propidium Iodide,用流式细胞仪检测分析Hem ECs的凋亡。
1.3 统计学方法 采用SPSS17.0 软件进行数据统计分析,所有实验进行三次重复实验,实验结果中计量资料符合正态分布,以均数±标准差()表示,组间比较采用Student"s t test检验,以P<0.05为差异有统计学意义。
2 结果
2.1 HemECs 的培养及鉴定 从血管瘤组织块中成功培养出HemECs,200倍倒置显微镜下细胞呈多角形或梭形,待细胞融合后呈“旋涡状”排列,第Ⅷ因子相关抗原呈阳性,见图1。
2.2 血管瘤内皮细胞Mas受体的表达 qRT-PCR结果表明血管瘤内皮细胞中有Mas 受体mRNA 的表达,与HUVEC 相比较差异有统计学意义(P<0.05)。Western blot 结果表明血管瘤内皮细胞中有Mas 受体蛋白质的表达,与HUVEC 相比较差异有显著统计学意义(P<0.01),见图2。

图1 体外培养的HemECs形态学观察结果及细胞鉴定(200×倒置显微镜下)

图2 Hem ECs中有Mas受体mRNA及蛋白的表达
2.3 Ang1~7 对血管瘤内皮细胞增殖及Mas 受体表达的影响 Ang1~7浓度大于1.00 μmol/L时可发挥抑制血管瘤内皮细胞增殖的作用,10 μmol/L抑制细胞增殖的作用最明显,差异有显著统计学意义(P<0.001),见图3。空白对照组、Ang1~7组24 h、48 h血管瘤内皮细胞的 Mas 受体 mRNA 的相对表达量=2-ΔΔCt值,见表2。实验数据表明Ang1~7与空白对照组24 h相比较时,血管瘤内皮细胞Mas受体mRNA的表达差异无统计学意义(P>0.05),Ang1~7 与空白对照组48 h相比较时,血管瘤内皮细胞Mas受体mRNA的表达差异有统计学意义(P<0.01),提示Ang1~7 可能上调Mas受体mRNA的表达,见表2。
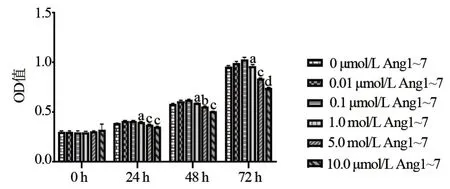
图3 不同浓度Ang1-7对Hem ECs增殖的影响
表2 Mas受体mRNA的相对表达量(2-ΔΔCt,)
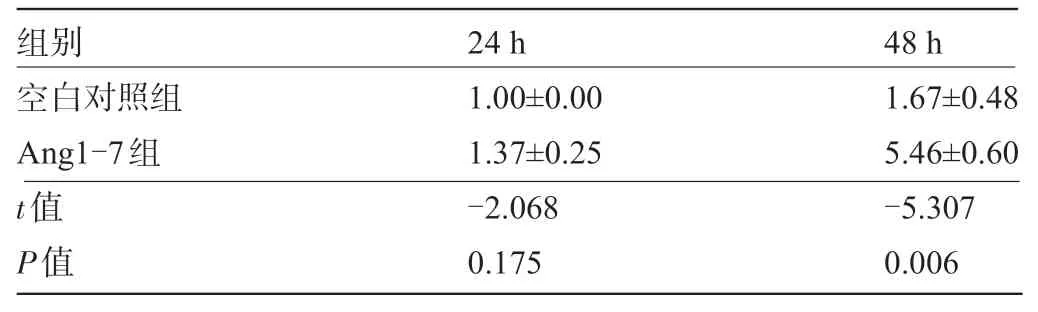
表2 Mas受体mRNA的相对表达量(2-ΔΔCt,)
组别24 h 48 h空白对照组Ang1-7组t值P值1.00±0.00 1.37±0.25-2.068 0.175 1.67±0.48 5.46±0.60-5.307 0.006
2.4 Ang1~7 对血管瘤内皮细胞凋亡的影响 Ang1~7 作用于Hem ECs后24 h细胞总凋亡率为(0.79±0.13)%;48 h 细胞总凋亡率为(1.48±0.18)%,与空白对照组相比,Ang1~7组在48 h细胞凋亡率显著增高,提示Ang1~7可能诱导Hem ECs的凋亡,差异有统计学意义(P<0.05),见图4。

图4 Ang1~7作用于Hem ECs 24 h、48 h细胞凋亡情况
3 讨论
近年来,ACE2-Ang1~7-Mas 受体新轴受到了研究者的广泛关注,RAS系统经典轴在婴幼儿血管瘤中可能发挥作用已有学者证实[10-11],为了解其发病机制提供了一个新思路。本实验研究RAS 系统新轴中Mas 受体在婴幼儿血管瘤内皮细胞中是否存在,以及重要肽Ang1~7 对其增殖及凋亡的影响,完善了RAS系统在婴幼儿血管瘤中可能发挥的作用。本实验研究表明婴幼儿血管瘤内皮细胞中存在Mas 受体mRNA 及蛋白质的表达,且Ang1~7 可抑制血管瘤内皮细胞增殖、促进其凋亡并上调Mas受体mRNA的表达,这表明Ang1~7 极有可能通过上调Mas 受体而发挥抑制细胞增殖及促进细胞凋亡作用,通过此实验也进一步证实RAS 系统新轴在婴幼儿血管瘤中可能发挥促进血管瘤消退的作用。
近年来,越来越多的学者认为肾素血管紧张素系统(RAS)在癌症中可能发挥作用,在头颈部鳞状细胞癌[17]、结肠腺癌肝转移[18]、转移性大脑黑色素瘤[19]、人胶质母细胞瘤[20]等多种类型的癌症中,肿瘤干细胞有RAS系统中ACE、血管紧张素Ⅱ受体等的表达。在人胶质母细胞瘤[20]中,ACE、血管紧张素Ⅱ受体等分布于微血管局部[21],这些研究表明,通过调节RAS系统可能为胶质母细胞瘤等多种癌症提供新的靶点[22]。Ang1~7也可显著抑制前列腺癌DU145癌细胞的增殖[23]。LUO等[24]发现乳腺浸润性导管癌相较于乳腺良性疾病Mas 水平显著降低,Mas 受体与表皮生长因子受体(EGFR)、EGFR-2 的表达以及细胞增殖均呈负相关。在表达Mas受体的乳腺癌细胞系4T1以及MDA-MB-468中,Ang1~7 可作用于Mas 受体而抑制乳腺癌细胞系的增长及侵袭等,而下调Mas受体可削弱这种作用。PAULA 等[25]以“ACE”、“Ang1~7”、“ACE2”、“Ang Ⅱ ”、“Mas 受体”、“儿科”和“肿瘤”等为关键字在Pubmed、Scopus和Scielo数据库中检索相关文献,说明Ang1~7可抑制肿瘤生长,减少局部炎症和血管生成。
ITINTEANG等[26]通过免疫组织化学、质谱分析及NanoString 技术等证实血管瘤中有组织蛋白酶B、D、G 的表达。组织蛋白酶B 促进肾素的产生,而D 则促进血管紧张素原向血管紧张素Ⅰ(AngⅠ)转化,组织蛋白酶G 促进AngⅠ向AngⅡ转化,组织蛋白酶B、D 和G可阻止AngⅡ的产生,AngⅡ可促血管瘤内皮细胞的增殖[11],组织蛋白酶B、D和G可能调节RAS系统而在婴幼儿血管瘤中发挥作用。婴幼儿血管瘤中RAS 系统研究的逐渐深入将为婴幼儿血管瘤的治疗提供更多可能有效的靶点。
