SC-ICP-MS法测定金属元素的方法研究
2021-03-25赵珍阳龚子珊王世功田中朝孙传强赵玉新
傅 霜,赵珍阳,龚子珊,王世功,田中朝,孙传强,赵玉新,张 勇,汪 曣*
(1.天津大学 精密仪器与光电子工程学院,天津 300027;2.山东东仪光电仪器有限公司,山东 烟台 264000)
金属组学[1]被定义为一门研究生物中金属及类金属的学科,旨在理解金属及类金属元素的生物功能、化学结构和生物用量,是对基因组学、蛋白质组学等学科的必要补充。目前,已有大量文献报道了使用电感耦合等离子体质谱法(ICP-MS)检测人体血清、尿液中金属元素含量[2]。近些年,单细胞内金属元素含量的检测逐渐成为研究热点[3]。针对细胞中目标元素含量少、基质复杂等特点,常采用酸消化细胞后再进行ICP-MS测定。单个细胞的元素含量显示为细胞群体的平均值[4],但该法无法体现细胞之间在元素含量上的固有差异,掩盖了可能由基因、蛋白质、代谢物等产生的细胞异质性[5]。随着ICP-MS在仪器技术和软件上的发展,探索测定单个细胞中的各元素含量逐渐成为可能,这种方法被称为单细胞电感耦合等离子体质谱(Single cell ICP-MS,SC-ICP-MS)法[6]。通常以直接雾化的方式将细胞悬液中的细胞引入电感耦合等离子体(ICP)[6-8],此后单个细胞被电离产生一团离子云,在优化后的时间分辨模式下被检测形成非连续信号,信号的强度与每个检测到的细胞中目标元素的含量相关,信号的数量与溶液中的细胞密度相关[7]。该法在单细胞内源性元素、细胞吸收或吸附金属元素和纳米粒子等分析研究中应用较多,对医学、药学和生物学等具有十分重要的意义。
超声波在液体中的空化作用可以将细胞击碎,Li等[9]使用超声波裂解细菌后检测到的U+信号强度增加30%,证明细胞破碎后可检出更多分析物,其操作相对消解细胞更简便快捷,且样品中避免了化学试剂的引入。由于缺少细胞标准物质,通常用酸消解细胞后进行ICP-MS检测得到的元素平均值验证SC-ICP-MS检测单细胞元素含量的准确性,验证方法单一且不完全准确。基于此,本文采用细胞悬液直接进样、经过超声波探头作用的破碎细胞溶液进样和消解细胞溶液进样,通过3种样品前处理方式对SC-ICP-MS定量结果的准确性进行验证。首先分析了动态反应池参数、进样速度、细胞密度和驻留时间对SC-ICP-MS准确检测的重要作用,然后在优化条件下,使用SC-ICP-MS方法测定HeLa细胞中5种金属元素,并对各元素的单细胞瞬时信号图和直方图分布进行详细分析。最后,从不同角度的总体细胞水平分析SC-ICP-MS方法测量结果的准确性,并证明了缺乏细胞标准物质时对此方法定量结果的多角度验证是必要的。
1 实验部分
1.1 仪器与试剂
Perkin Elmer NexION 300D电感耦合等离子体质谱仪(美国Perkin Elmer公司),配Asperon单细胞雾化室及Syngistix纳米颗粒应用模块,可提供对单细胞/单颗粒的分析;BPN-80CRH CO2培养箱(上海一恒科学仪器有限公司);Milli-Q超纯水系统(美国Millipore公司);倒置显微镜(德国蔡司公司);血球计数板(上海求精生化试剂仪器有限公司);台式低速离心机(上海托莫斯科学仪器有限公司);BSAI24S电子天平(德国Sedolis公司);HUP-100手持式超声波细胞破碎仪(天津恒奥科技发展有限公司)。
HeLa细胞系(中原公司);高糖DMEM细胞培养基、胰蛋白酶消化液(0.25% Trypsin-EDTA)和胎牛血清(FBS)(Gibco公司);1xPBS缓冲液(Genview公司);4%多聚甲醛细胞固定液(Thermo Fishier公司);65%浓硝酸(HNO3)(Merck公司);包含Be、Mg、In、Fe、Li、Pb、U和Ce的1.0 μg/L多元素调谐液(Perkin Elmer公司);10 mg/L多元素标准储备液(Agilent公司);NH3(纯度99.999%,天津威斯特气体公司)。
1.2 细胞培养与样品前处理
1.2.1 细胞培养与SC-ICP-MS检测样品的制备培养HeLa细胞的完全培养基由90%的高糖DMEM和10%(体积分数)的胎牛血清(FBS)配制,且细胞处于含5% CO2的37 ℃培养箱中生长。待细胞贴壁融合超过80%,用胰蛋白酶消化细胞,轻轻吹打使细胞离壁,收集细胞悬液,以1 000 r/min离心5 min后去掉上清液,用4%多聚甲醛固定细胞20 min,固定后离心去掉多聚甲醛溶液,再用PBS溶液重复清洗3次后重悬于超纯水中。对细胞悬液进行不同处理前在倒置显微镜下用血球计数板对待测溶液中的细胞进行计数,以制备所需细胞密度的样品。上机测试前,显微镜下观察到细胞悬液中细胞大小不一,近乎圆形且大都处于单一分散状态(图1)。
1.2.2 方法验证样品的制备3种细胞样品来自同一批细胞,制备相同细胞密度的细胞悬液。用于直接进样的细胞悬液称为完整细胞;将超声波细胞破碎仪的工作脉冲调整为最低档,将超声波探头间断作用于细胞悬液中5 min,制备破碎细胞;将细胞悬液离心去掉上清液后加入浓硝酸,静置过夜,待消解液变得澄清透明后用超纯水稀释,制备消解细胞。并同步制备样品空白溶液。
1.3 实验方法
仪器使用前用1 μg/L多元素调谐液校准通过。SC-ICP-MS方法采用细胞悬液直接进样,仪器工作模式选为纳米颗粒(Nano)模块中的DRC模式。方法验证中,在ICP-MS常规元素模块下相同条件的DRC模式中检测完整细胞、破碎细胞和消解细胞样品的目标元素,同时在内标管中通入20 μg/L的Rh元素标准溶液。使用逐级稀释法用超纯水配制0、0.1、0.5、1、5、10、50 μg/L的含Cr、Mn、Fe、Cu和Zn的多元素混合标准溶液,建立方法的标准曲线,在标准曲线线性系数(r2)大于0.999的条件下开展实验。实验时依次通入标准溶液、样品空白溶液和样品溶液进行检测。
1.4 数据处理
使用Origin 8.5和Excel 2016分析ICP-MS中Syngistix获得的原始数据。SC-ICP-MS法使用3倍标准偏差(3σ)的迭代算法[10]来区别单个细胞信号与背景噪声,首先计算整个数据集的平均信号值和标准偏差(σ),并收集高于平均信号值与3σ加和值的数据。然后重新计算剩余数据集的平均信号值和σ,并收集高于平均信号值与3σ加和值的数据点,直到没有数据点高于3σ和平均信号值的加和值。这些收集到的信号数据为单细胞信号,剩余被去掉的数据代表细胞背景。SC-ICP-MS法中各金属元素的检出限(LOD)为细胞背景的3σ。方法验证中各金属元素的LOD为检测样品空白溶液中分析物11次测量结果的3σ[11]。
2 结果与讨论
2.1 NH3流量与极杆抑制参数q(RPq)优化
细胞逐个进入ICP后,被电离产生大量Ar、C、N、H、O等轻质量数的原子,易形成多原子离子干扰,尤其对质量数在40~80的元素检测造成较大干扰。表1列出了各分析物对应的干扰离子[12]及最有效的反应气[13-14]。NH3可同时对细胞中待测的52Cr+、55Mn+、56Fe+、63Cu+和66Zn+有效去除多原子离子干扰。合理设置RPq值也可有效消除轻质量数原子的反应副产物,避免二次产生的干扰分子离子对目标检测元素的影响。在仪器配套的软件Syngistix的DRC Method Development(DRC MD)模块中按提示分别引入超纯水和1 μg/L的多元素标准溶液各测定一次,以0.1 mL/min的增量从0.5 mL/min至1.2 mL/min优化NH3流量,以0.05的增量从0.45至0.8优化RPq,评估各分析物优化结果的指标基于仪器获得较低的背景等效浓度(BEC)和较高的信噪比(SBR)。结果显示,NH3流量为0.7 mL/min,而52Cr+、63Cu+和66Zn+的RPq设置为0.6,55Mn+的RPq设置为0.5,56Fe+的RPq设置为0.45时,可使仪器达到最佳的检出限。
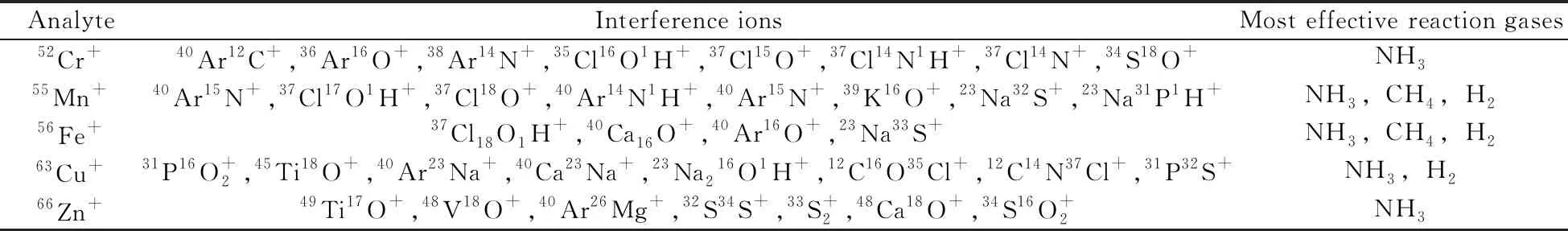
表1 各分析物的干扰离子及最有效的反应气
2.2 进样速度对单细胞元素检测的影响
实验考察了进样速度对细胞传输效率(TE)的影响,细胞传输效率为一段确定时间内检出的单细胞信号个数与溶液中含有的细胞个数比值。由于细胞中微量元素的丰度不同,因此选择合适的元素可较好地探究单细胞信号个数、单细胞信号的平均强度和溶液中分析物浓度的变化,本实验选用66Zn可取得较好的分析效果。设置驻留时间为0.1 ms并采用细胞密度为2.5×105/mL的细胞悬液,在检测时长为100 s的条件下,进样速度与所测单细胞信号个数几乎呈线性关系。进样速度在0.12~0.64 mL/min范围内,单细胞信号个数(y)与进样速度(x)的线性方程为y=1 961.2x+9.412 9(r2=0.990 1)。而TE基本不发生变化,在0.54%~0.62%之间波动。考虑到进样量太大会损失较多细胞,进样量过小又会使检测的细胞太少,因此最终选择0.2 mL/min的进样速度。
2.3 细胞密度对单细胞元素检测的影响
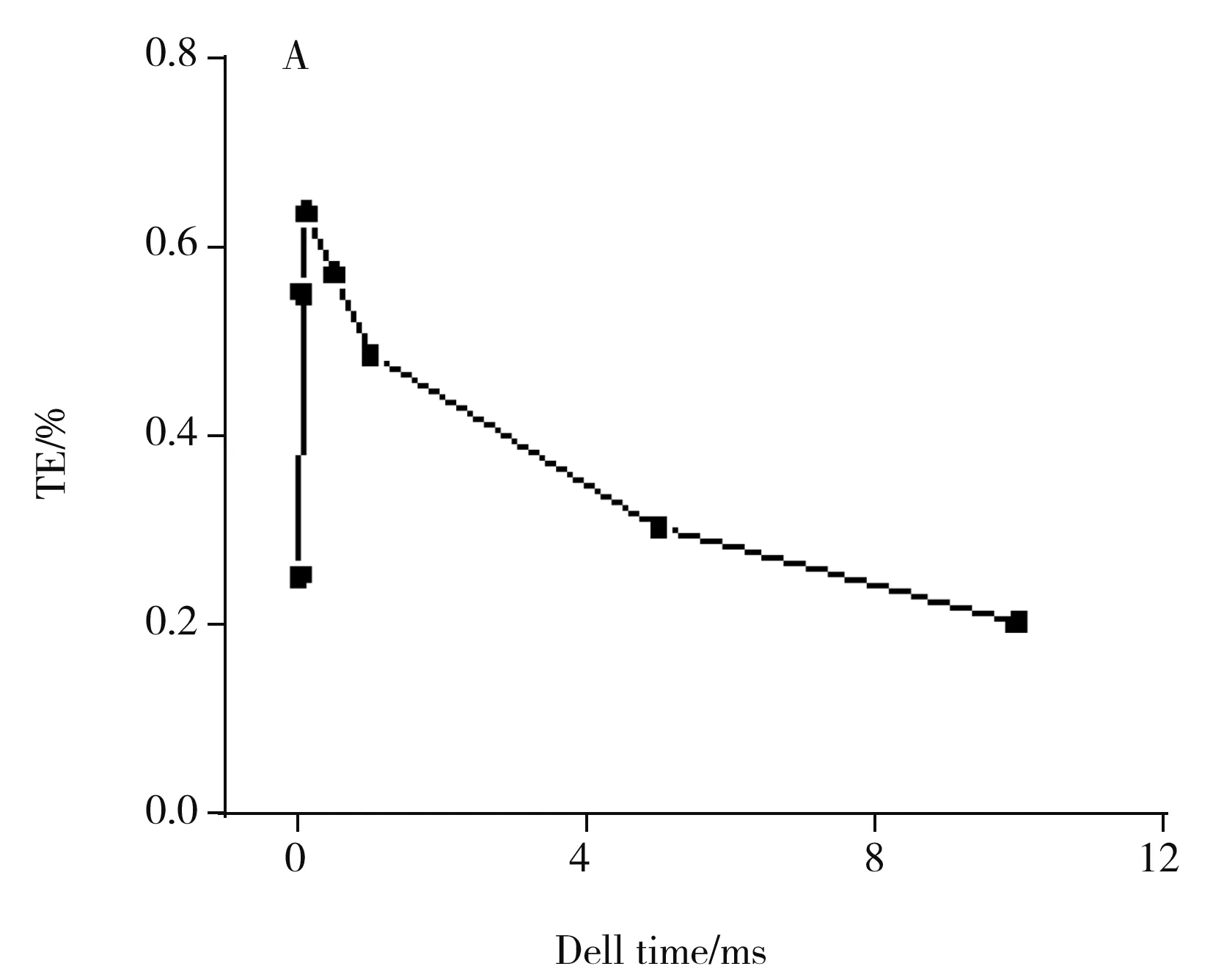
图2 驻留时间对单细胞检测的影响(细胞数量密度为2.5×105/mL)
为使SC-ICP-MS检测获得准确的单细胞信号,需选择合适的细胞密度以保证在任何给定的驻留时间下只有一个细胞被检测[15],研究表明检测单个细胞的驻留时间应设置在0.1~0.5 ms[8],因此本研究选择在0.1 ms的驻留时间下优化细胞密度。在0.2 mL/min的进样速度和100 s的检测时长下,随着细胞密度增大,细胞传输效率呈先增大后减小的趋势,即检测到的单细胞信号个数呈现出先增加后减小的变化趋势。当细胞密度大于2.5×105/mL时,检测到的单细胞信号个数显著降低,即确定最佳的细胞传输效率在细胞密度为2.5×105/mL处。此外,当细胞密度从104/mL增加到106/mL时,单细胞信号平均强度和溶液中分析物的浓度均呈现出上升趋势,但单细胞信号平均强度并未超过低细胞密度的两倍,而溶液中分析物浓度的强度趋近于低细胞密度时的单细胞信号平均强度。说明细胞密度增大会增加溶液中分析物的浓度,使得脉冲信号淹没在背景信号中,最终无法区分出单细胞信号。
2.4 驻留时间对单细胞元素检测的影响
在SC-ICP-MS方法中,由于ICP-MS检测器直接读取离子脉冲电流产生的数据点形成单细胞脉冲峰,驻留时间为每个数据点的采集时间,驻留时间需小于单细胞被电离形成的离子云的持续时间以获得可分辨的单细胞信号[6]。驻留时间越小,单细胞信号越不容易淹没在背景信号中。因此驻留时间影响着单细胞信号的检出限和信背比(SBR)[16],也是准确计算单细胞脉冲信号强度的重要影响参数。由图2A可见,当驻留时间在从0.01 ms增至10 ms时,检测到的单细胞信号个数呈先增加后减少的趋势,说明采用合适的驻留时间可检测到更多的单细胞信号。由图2B可见,溶液中分析物的信号强度和单细胞信号的平均强度均呈上升趋势且逐渐靠近,分析物的浓度与驻留时间呈线性关系,表明长的驻留时间极大地增加了背景干扰,降低了单细胞信号的分辨率和灵敏度[17]。而在极短的驻留时间下,分析物的信号也会随驻留时间的缩短而降低,检测到的单细胞个数较少且单细胞信号的平均强度较低,不利于进行单细胞分析。综合考虑,本研究选取0.1 ms的驻留时间作为实验条件,在此条件下可获得较多的单细胞信号,且信号的SBR较高。
2.5 SC-ICP-MS对单细胞内5种金属元素的定量分析
SC-ICP-MS测定单个细胞中Cr、Mn、Fe、Cu和Zn的LOD分别为0.4、0.1、2.4、0.2、0.14 fg。图3为HeLa细胞中52Cr+、55Mn+、56Fe+、63Cu+和66Zn+的SC-ICP-MS瞬时信号图,表明使用SC-ICP-MS能够很好地区分出单细胞信号,真实地反映出细胞之间各元素含量的固有差异。图4为细胞数量与各元素信号强度的统计直方图,图中红色线为高斯拟合线,将经过高斯拟合的直方图称为HeLa细胞的52Cr+、55Mn+、56Fe+、63Cu+和66Zn+的细胞数与信号强度的直方图分布,图中反映了不同信号强度上的细胞数量分布,且可获得最高细胞数量对应的单细胞信号强度值。单个细胞内各元素含量可根据公式[15]计算:m=vtdwη(ISC-Ib)/k;式中,m为单个细胞中目标元素的含量,v为样品进样速度,η为标准溶液的传输效率,tdw为驻留时间,ISC为单细胞信号强度,Ib为背景信号强度,k为标准曲线的斜率。

图3 Hela细胞中52Cr+、55Mn+、56Fe+、63Cu+和66Zn+的SC-ICP-MS瞬时信号图
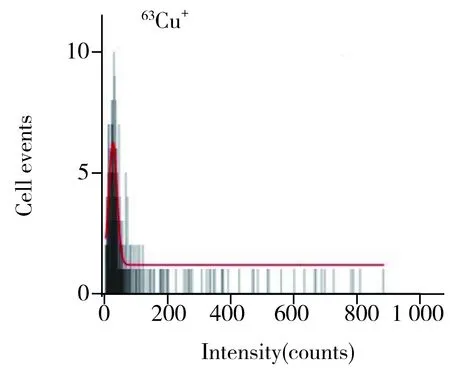
图4 HeLa细胞中的52Cr+、55Mn+、56Fe+、63Cu+和66Zn+的细胞数量与信号强度的直方图分布(红色线为高斯拟合线)
2.6 SC-ICP-MS方法的验证分析
ICP-MS对Cr、Mn、Fe、Cu和Zn的LOD分别为2.4、5.0、20.7、5.7、1.65 ng/L,满足定量所需,相对标准偏差(RSD,n=11)为1.3%~4.7%。方法验证中单个细胞的元素含量参考值为浓度值除以其对应的细胞密度,图4中红色线为高斯拟合的作用[8],取细胞数量最高的单细胞信号强度为ISC,计算SC-ICP-MS方法测定的单细胞中Cr、Mn、Fe、Cu和Zn的含量。SC-ICP-MS及方法验证的定量结果如表2所示,ICP-MS检测的3种样品溶液的精密度实验结果见表3。各元素的RSD均基本符合要求[11],但完整细胞样品和破碎细胞样品中多个元素的RSD大于消解细胞样品的RSD,可能是由于元素在这两种样品溶液中不同程度的非均匀性导致的。

表2 SC-ICP-MS及ICP-MS方法验证的单细胞内5种金属元素含量

表3 方法验证的精密度实验
方法验证中,ICP-MS检测细胞悬液中完整细胞所得单细胞Cr、Fe、Cu和Zn含量比SC-ICP-MS的测定结果低很多,不能反映单细胞内元素含量的真实值。而单细胞Mn含量略高于SC-ICP-MS的测定值,表明SC-ICP-MS测定的单细胞Mn含量偏小。ICP-MS检测消解细胞所得的单细胞Cr和Fe含量比破碎细胞多,说明细胞中Fe和Cr元素主要以有机结合态的形式存在,浓硝酸彻底分解有机物后Fe和Cr易溶于酸中而被检出,表明细胞消解后的测定参考值适用于验证SC-ICP-MS方法测定单细胞Cr和Fe含量的准确性。然而,ICP-MS检测破碎细胞所得的单细胞Cu和Zn含量比检测消解细胞的多,因为超声波释放了细胞内含Cu和Zn的物质并将这类物质裂解而获得更大的电离效率[9],所以表明选用超声波破碎细胞后测定的结果更能准确验证SC-ICP-MS对大多数单细胞Cu和Zn的定量分析,也说明使用SC-ICP-MS方法测定完整细胞的某些元素时存在基质效应,需对此方法的定量结果进行多角度验证。
3 结 论
本文使用DRC模式消除了多原子离子干扰并研究了进样速度、细胞密度、驻留时间等因素对SC-ICP-MS测定单细胞内微量元素的影响。在优化的仪器参数和实验条件下测定了单细胞的Cr、Mn、Fe、Cu和Zn元素,基于SC-ICP-MS分析细胞异质性的通用策略[5],可以在细胞内多元素监测、金属药物代谢动力学、金属相关疾病诊断、纳米毒理学研究等方面实现单细胞水平的精准分析。提出了对SC-ICP-MS方法的多角度验证方法,可采用超声波破碎细胞和消解细胞的方法评估SC-ICP-MS测定单细胞不同元素的准确性,这对缺少细胞标准物质且使用SC-ICP-MS方法检测单细胞内更多元素的研究具有借鉴意义。
