脊髓毛细胞型星形细胞瘤的诊断与治疗
2021-03-25于贝贝荆林凯王贵怀
于贝贝 荆林凯 王 劲 王贵怀
脊髓毛细胞型星形细胞瘤(pilocytic astrocytoma,PA)生长隐匿,临床表现缺乏特异性,术前误诊率较高。脊髓PA 为WHO 分级Ⅰ级,在保护脊髓神经功能的前提下全切除/近全切除肿瘤,大多预后良好,术后放化疗仍有争议[1]。本文回顾性分析12例脊髓原发性PA的临床资料,总结诊治经验。
1 资料与方法
1.1 一般资料2015年1月至2020年1月共收治原发性脊髓胶质瘤308例,PA 共12例,占3.9%,其中男8例,女4 例;年龄1~56 岁,平均(27.4±17.2)岁。以脊髓压迫症状为主,主要为疼痛、麻木、肢体无力、大小便障碍、呼吸困难;病程4~180 个月,平均(45.0±48.1)个月。4例曾在外院接受治疗,其中2例行肿瘤活检术,部分切除减压;1例行大部切除术及术后化疗;1例行γ刀治疗。12例具体情况见表1。
1.2 影像学资料 术前均行全脊柱MRI 平扫+增强检查,肿瘤主体主要位于颈胸段,受累脊髓节段2~11个(平均5.3个)。MRI可见脊髓增粗,肿瘤信号呈等或长T1、长T2信号;增强后10 例表现为不均匀强化,1例呈环形强化,1例无明显强化。5例肿瘤周围水肿明显,中央管扩张伴有脊髓空洞形成,其中1例合并有小脑扁桃体下疝畸形;2例肿瘤主体内有出血及含铁血黄素沉积。
1.3 治疗方法 全麻下行脊髓髓内肿瘤切除术。术中结合实时神经电生理监测记录体感诱发电位及运动诱发电位。术后常规给予激素减轻脊髓水肿、抗炎、神经营养等对症治疗。术后3、6、12个月定期复查MRI 评估肿瘤切除状态及有无复发、转移,1年后每年复查一次MRI,如有新发症状及时复查。
2 结果
2.1 手术及病理结果8例肿瘤全切除,4例大部分切除;除1例行椎板切除术外,其余11例均行椎板成形术。1例术后出现压疮、切口愈合不良,经抗感染、定期换药、控制血糖等治疗后好转出院,其余11 例无并发症。
病理检查显示,肿瘤大体观上呈红褐色或灰黄色,质地糟脆,部分可见囊变。显微镜下观察可见肿瘤细胞密度中等,细胞核小,圆形,间质粘液样,局部微囊变,散在嗜酸性颗粒小体,核分裂像罕见,血管增生、扩张充血并出血,局部可见微血管增生,致密区可见Rothental 纤维;免疫组化染色显示12 例GFAP均阳性,4例P53阳性,2例H3-K27M阳性,Ki-67增殖指数在0~7%。
2.2 随访结果 术后随访6~54个月,平均(29.3±16.1)个月。末次随访,5 例脊髓功能较术前改善,7 例无变化。随访观察期间未见肿瘤复发及播散。
3 讨论
3.1 流行病学及临床特征 脊髓PA主要见于儿童和青少年,约占小儿脊髓髓内肿瘤的60%[2,3]。在成人中,室管膜瘤是最常见的脊髓髓内肿瘤类型,PA 并不多见。本文12例脊髓PA约占同期原发性脊髓胶质瘤的3.8%;此外,病人平均年龄27.4岁,但多数病程较长,4例存在二次手术入院。
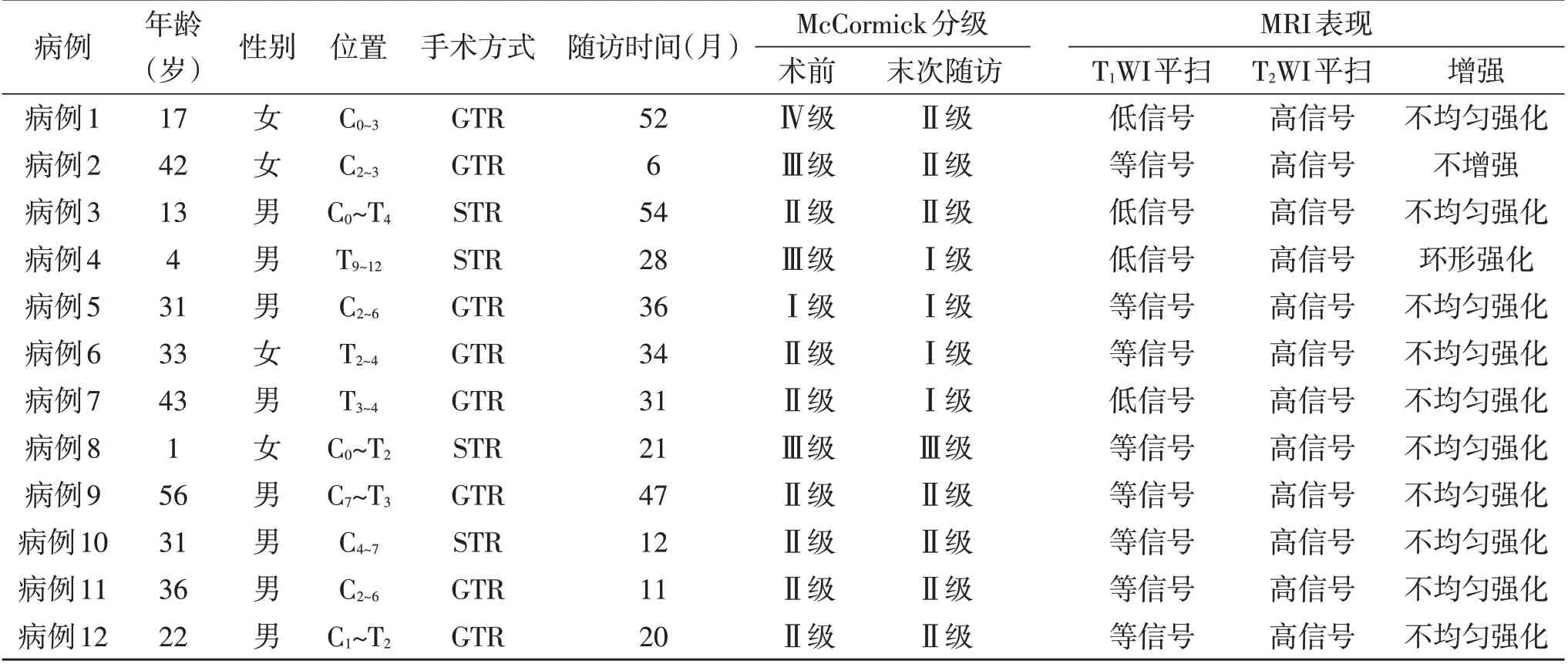
表1 本文12例脊髓毛细胞型星形细胞瘤具体情况
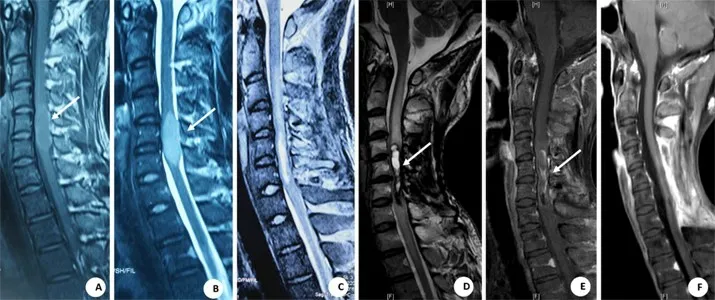
图1 颈4~6 脊髓毛细胞型星形细胞瘤手术前后影像表现
脊髓PA症状不典型且生长隐匿,可持续数月或数年才发生进展。脊髓PA占位的节段不同,神经功能缺损症状也差异较大,主要包括疼痛、运动能力下降、肢体僵硬、感觉障碍和棘突旁肌痉挛[1]。此外,处于青春期的PA 病人可出现进行性脊柱侧弯或步态障碍,在肿瘤发展晚期可出现括约肌功能障碍。本文12 例中,6 例累及高颈髓,多以颈痛为首发症状,其中2例出现呼吸困难。
3.2 影像学及病理学特征 脊髓PA的主要影像学检查方法为MRI,但由于其临床特征及影像学特征特异性较差,需要进一步与室管膜瘤、血管母细胞瘤、毛粘液样型星形细胞瘤等髓内占位相鉴别。PA 的MRI 表现多样,可伴有囊变、出血和脊髓空洞形成[4]。整体而言,脊髓PA 的MRI T1加权像为等信号或低信号,而T2加权像为高信号;增强MRI表现为均匀或不均匀强化,当肿瘤伴囊肿或坏死区域出血时,会出现异质性或环形强化。
脊髓PA确诊依赖病理学检查。PA具有典型的双相结构:密集区的梭形细胞含有Rosenthal 纤维,而疏松区的多极细胞则具有微囊和嗜酸性颗粒。在组织学上,脊髓PA 还需与毛粘液样型星形细胞瘤(pilomyxiod astrocytoma,PMA)鉴别。与PA 相比,PMA 拥有较多的黏液样背景,但缺乏典型的双相结构,通常没有Rosenthal 纤维和嗜酸性颗粒[5]。PMA的发病年龄通常较PA 年轻,预后相对较差,2007 年版WHO 分类为Ⅱ级,2016 年版WHO 分级未将其进行分级。本文1例初步病理诊断为反应性胶质细胞胶质增生,1例伴有局灶性PMA增生。
3.3 治疗方式及预后分析 对于低级别脊髓PA,手术切除为首选治疗方式,但肿瘤切除程度是否可以提高病人总体生存率尚无明确共识。对于脊髓髓内肿瘤,术前神经系统功能是术后功能预后的最佳评价指标,手术切除的目的也在于改善神经功能[6]。在神经电生理监测和术中荧光血管造影技术的保障下,本文12 例脊髓PA 中,8 例全切除,4 例大部分切除;此外,2例于外院行部分切除减压后症状加重,在我院完全切除肿瘤后,神经功能均较术前明显改善。因此,我们推荐在早期尽可能保留脊髓功能的前提下尽可能多地切除肿瘤。
脊髓PA 的辅助治疗目前存在争议。Aryan 等[7]报道2例PA转移的病例,应用替莫唑胺的化疗方案后2 年未发生进展。但本文1 例在外院大部分切除肿瘤后行3 个疗程替莫唑胺化疗,5 年后复发(图1)。由于针对脊髓PA化疗的病例有限,化疗有效性有待于进一步研究。本文12例肿瘤切除后,未进行放疗;1 例在外院曾行放疗,手术难度增大。因此,我们不建议术前进行放疗。此外,对于儿童,放疗的副作用也是值得考虑的一个因素。
随着分子检测技术的发展,免疫组化分子标志物也可反应病人预后情况。ATRX表达缺失,NF-1、H3-K27M 和IDH1 突变被认为是PA 的不良预后指标[8]。Reers 等[9]报道1 例伴有H3-K27M 突变的脊髓PA,尽管接受手术和放疗,11 个月后仍转移至小脑。本文2例存在H3-K27M突变,尽管在随访期间未发现复发、转移,但由于随访时间较短,仍需定期复查MRI。如果随访影像学检查发现肿瘤复发,且症状加重明显,则应考虑二次手术,以防肿瘤进展。如果无法进行手术切除,即使病变未进展,也应定期随访。
