渔业水质中15种头孢菌素固相萃取-超高效液相色谱串联质谱测定方法的建立
2021-03-25任娣朱晓华谭秀慧李艳平杨洪生
任娣,朱晓华,谭秀慧,李艳平,杨洪生*
(1.江苏省淡水水产研究所,江苏 南京210017;2.江苏省水产质量检测中心,江苏 南京210017;3.农业农村部渔业产品质量监督检验测试中心(南京),江苏 南京210017)
目前,抗生素因其能够预防和治疗鱼类疾病,同时可通过抑制环境中的抗生长因子而促进水产动物生长,被应用于水产养殖业[1]。研究表明,抗生素只能部分被鱼类吸收利用,大部分是通过原药或代谢物的形式随着粪便和尿液排出体外[2]。这些经各自途径进入环境的抗生素,易对水体、沉积物和土壤等造成污染,从而影响人类的健康[3]。各种抗生素药物的结构和性质差异显著,在环境中停留时间不等,远远大于其在生物体内的代谢周期[4]。抗生素滥用引发水环境问题,正成为一种新型的污染物被国内外密切关注[5]。
头孢菌素是一类半广谱抗生素,目前也被应用于水产养殖业,兼具高效和低毒等优点,发展和应用前景十分广阔。头孢菌素性质不稳定,但近几年,在地表水、饮用水、地下水和渔业用水等环境介质中均报道有头孢菌素药物残留现象。Gulkowska等[6]在香港等地污水处理厂的进水和出水中检出头孢氨苄、头孢噻肟、头孢唑啉;王朋华[7]在两家污水处理厂的进水、初沉水和出水中检出5种头孢类抗生素,浓度水平的数量级为ng/L~μg/L。余胜兵等[8]对采集自5个水厂的17份水样进行检测,结果在水源水中有检出头孢拉定和头孢氨苄。研究表明,在大连地区部分入海口、水库等23个监测点中头孢唑啉、头孢克洛、头孢噻呋、头孢噻肟均有检出,检出率分别为21.7%、21.7%、26.1%和13.0%,部分入海口附近有许多水产养殖区域,推测目标污染物的主要来源为水产养殖废水[9]。头孢菌素作为当今世界上研究最活跃、进展最迅速、应用最广泛的抗生素类药物,研究其在养殖环境中残留问题具有重要的意义。目前关于渔业水质抗生素残留测定的研究大多针对磺胺类、喹诺酮类、四环素类及孔雀石绿等抗生素[10-13],对头孢菌素定量检测的研究相对较少,且渔业水质具有杂质多、基质效应大及头孢菌素含量较低等特点,检测方法存在局限性,因此有必要建立快速、准确的渔业水质中头孢菌素残留检测方法。
高效液相色谱法[14]、高效液相色谱-质谱法和串联质谱[15-17]等方法是水环境样品中抗生素较常用的测定方法。超高效液相色谱串联质谱法是一种具有较高分离度和灵敏度的快速分离的方法,适用于痕量测定。且内标法相对于外标法可以有效地减少样品前处理过程中目标物的损失和测定过程中的基质效应等因素对分析准确度的影响,因此本研究采用内标法,建立固相萃取-超高效液相色谱串联质谱法测定渔业水质中15种头孢菌素的含量。
1 材料与方法
1.1 仪器与试剂
Triple Quad 5500超高效液相色谱-四极杆飞行时间质谱联用仪(美国SCIEX公司);Allegra 64R高速冷冻离心机(美国Beckman公司);Turbo Vap®LV全自动氮吹浓缩仪(瑞典Biotage公司);DMT-2500涡旋混合器(常州金坛良友仪器有限公司);Milli-Q纯水仪(德国Merck公司);固相萃取装置(美国Supelco公司)。
15种头孢菌素标准品(见表2,纯度均大于96%,天津阿尔塔科技有限公司);7种头孢菌素同位素内标(见表2,纯度均大于95%,天津阿尔塔科技有限公司);甲醇、乙腈(色谱纯,德国Merck公司);甲酸(色谱纯,美国Tedia公司);乙二胺四乙酸二钠(分析纯,国药集团化学试剂有限公司);磷酸(色谱纯,德国Merck公司);磷酸二氢钠(分析纯,南京化学试剂一厂);氨水(分析纯,南京化学试剂有限公司)。
固相萃取柱:Oasis HLB固相萃取小柱(500 mg/6 mL,美国Waters公司);Oasis MAX固相萃取小柱(500 mg/6 mL,美国Waters公司);Oasis MCX固相萃取小柱(500 mg/6 mL,美国Waters公司)。
单标储备液:分别称取适量的15种头孢菌素标准品和7种同位素内标物质,用乙腈水(50∶50,v/v)溶解并定容至50 mL,其中15种头孢菌素单标储备液质量浓度为100 mg/L、7种同位素内标单标储备液质量浓度为50 mg/L的标准储备液,分别于4 ℃避光保存。
混合标准工作液:分别移取适量单标储备液,用乙腈水(1∶1,v/v)定容至10 mL,其中15种头孢菌素混合标准工作液质量浓度均为1 mg/L,7种同位素内标混合工作液的质量浓度为100 μg/L,于-18 ℃保存,临用时稀释成所需浓度。
1.2 色谱条件
Agilent Infinity Lab Poroshell 120 SB-C18色谱柱(100 mm×2.1 mm,2.2 μm);柱温35 ℃;流速0.4 mL/min;进样量2.0 μL。流动相A为0.1%甲酸水溶液,B为乙腈。梯度洗脱程序见表1。
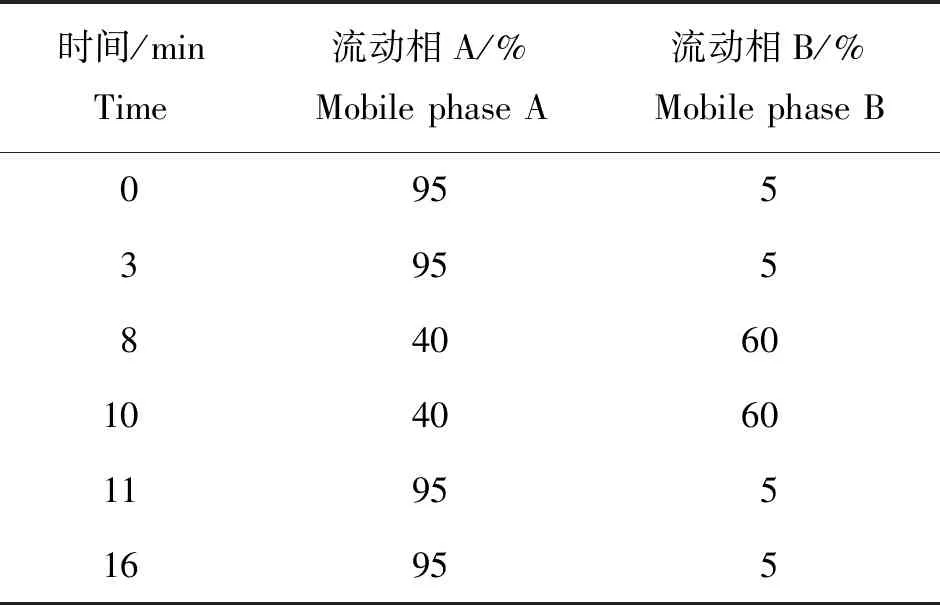
表1 梯度洗脱程序Tab.1 Gradient elution program of the mobile phase
1.3 质谱条件
电喷雾电离(ESI)源,正离子扫描;扫描方式:多反应监测模式(MRM);喷雾电压:5 500 V;离子源温度(Temperature,TEM):350 ℃;气帘气(Curtain Gas,CUR)压力:55 psi;离子源气1(Ion Source Gas 1,GS1)压力:55 psi;离子源气2(GS2)压力:55 psi;射入电压(Entrance Potential,EP):10 V;碰撞室射出电压(Collision Cell Exit Potential,CXP):9 V;其他质谱采集参数见表2。

表2 15种头孢及7种同位素内标的质谱参数Tab.2 MS parameters for the 15 cephalosporins and 7 isotope internal standards
1.4 样品前处理
水样的采集按照《水质 采样技术指导》(HJ 494—2009)[18]和《水质采样 样品的保存和管理技术规定》(HJ 493—2009)[19]进行。量取500 mL水样,经0.45 μm醋酸纤维滤膜过滤,加入5 mL 100 g/L乙二胺四乙酸二钠溶液,用50%(v/v)磷酸水溶液调节pH至3.0,加入100 μg/L同位素内标混合标准中间溶液200 μL,然后以4 mL/min的流速经Oasis HLB固相萃取柱净化。固相萃取柱预先用6 mL甲醇、3 mL超纯水和6 mL 100 g/L磷酸二氢钠溶液活化平衡。上样后用6 mL超纯水淋洗,弃去淋洗液,负压抽干30 min以上,依次用6 mL甲醇、6 mL 2%(v/v)氨水甲醇溶液洗脱,收集洗脱液,于40 ℃氮气吹至近干,用1 mL 0.1%(v/v)甲酸乙腈溶解,旋涡1 min后,过0.22 μm滤膜后待测。
2 结果与讨论
2.1 色谱条件的优化
头孢菌素属于β-内酰胺类抗生素,是β-内酰胺类抗生素中的7-氨基头孢烷酸的衍生物,常用C18色谱柱处理[20]。本实验比较了Agilent InfinityLab Poroshell 120 SB-C18色谱柱(2.1×100 mm,2.7 μm)、Waters Acquity UPLC®HSS T3色谱柱(2.1×100 mm,1.8 μm)和Thermo Hypersil GoldTMC18色谱柱(2.1×100 mm,2.1 μm)处理结果,结果显示Agilent InfinityLab Poroshell 120 SB-C18色谱柱对目标化合物能够实现较好的分离,色谱峰的峰形更尖锐。
本实验考察了常用的几种流动相对15种头孢菌素色谱分离的影响。结果显示:乙腈比甲醇的洗脱能力更强,以水-甲醇或水-乙腈为流动相时,多数头孢菌素响应低,不能实现较好的分离,且有拖尾现象。在正离子模式下,通常在流动相中加入适量的甲酸或乙酸铵等物质,可以提高目标化合物的离子化效率,同时可以改善峰形。因此本实验继续比较了0.1%甲酸水—乙腈、5 mmol/L乙酸铵溶液—乙腈流动相体系对15种头孢菌素分离效果的影响。结果显示,与5 mmol/L乙酸铵溶液—乙腈流动相体系相比,0.1%甲酸水—乙腈流动相体系响应值较高,目标物化合物的分离效果更好。
2.2 质谱条件的优化
本实验采用流动注射方式单标进样,将20 μg/L头孢菌素标准溶液在正离子模式下进行全扫描,并进行质谱参数的优化。得到每种化合物的分子离子峰[M+H]+,以分子离子为母离子,对其进行二级质谱扫描,选择干扰小、信噪比大的离子作为定量定性离子对,优化碰撞能量(CE)、去簇电压(DP)。优化后的质谱条件见表2。15种头孢菌素的标准溶液总离子流图见图1。

图1 15种头孢菌素的总离子流图1.头孢克洛;2.头孢吡啉;3.头孢匹罗;4.头孢羟氨苄;5.头孢喹肟;6.头孢氨苄;7.头孢洛宁;8.头孢拉定;9.头孢噻肟;10.头孢克肟;11.头孢唑啉;12.头孢哌酮;13.头孢孟多;14.头孢噻呋;15.头孢他美Fig.1Total ionic chromatogram of 15 kinds of cephalosporins1.Cefaclor;2.Cefapirin;3.Cefpirome;4.Cefadroxil;5.Cefquinome;6.Cefalexin;7Cefalonium.;8.Cefradine;9.Cefotaxime;10.Cefixime;11.Cefazolin;12.Cefoperazone;13.Cefamandole;14.Ceftiofur;15.Cefetamet
2.3 固相萃取条件的选择与优化
2.3.1 固相萃取柱的选择
抗生素类药物大多为中等极性或弱极性化合物,从水环境介质中分离富集头孢类抗生素,可供选择的固相萃取小柱类型很多。本研究考察了Oasis HLB、Oasis MAX和Oasis MCX柱对水样富集净化,对比其回收率效果,选择出合适的固相萃取柱。测试3种萃取柱对15种头孢菌素的回收率(加标量为20.0 μg/L,n=6),结果见图2。结果表明,Oasis MAX和Oasis MCX萃取柱对头孢匹罗、头孢他美、头孢洛宁和头孢喹肟等多种抗生素的回收率偏低,但是相比之下,Oasis HLB萃取柱对所选15种目标分析物均表现出良好性能。HLB柱亲水亲脂平衡填料由特殊的共聚合技术制备而成,含有特定比例的亲水基和疏水基,对不同极性化合物均有较好的吸附能力,重现性好,且具有更稳定的回收率[20]。所以,本试验选择Oasis HLB 萃取柱对水样进行SPE萃取。
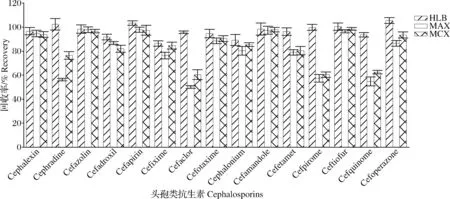
图2 固相萃取柱对15种头孢类抗生素的回收率的影响(n=6)Fig.2The effect of solid phase extraction column on the recoveries of 15 cephalosporins(n=6)
2.3.2 水样过柱前 pH 的选择
头孢菌素在萃取柱上的吸附强度取决于其存在形式。当pH 条件不同时,头孢菌素呈现离子存在形态也不同[21]。本实验分别在pH=2、pH=3、pH=5和pH=7条件下采用空白水样加标(20.0 μg/L,n=6)进行萃取试验,从而选取合适的pH值。由图3可以看出,pH=2时,头孢拉定、头孢匹罗的回收率下降明显;当pH=7时,头孢克肟、头孢他美的回收率不理想;当pH≥5时,头孢氨苄出现假阳性的现象。当pH=3时,15种头孢类抗生素的回收率在83.34%~107.64%,多种抗生素的回收率较为理想且没有显著性差异,其他pH条件下的回收率均不理想。因此,本试验水样在过柱前调至pH=3。

图3 pH对15种头孢类抗生素回收率的影响(n=6)Fig.3The effect of pH on the recoveries of 15 cephalosporins(n=6)
2.3.3 洗脱液的选择
分别用12 mL甲醇、12 mL 2%氨水甲醇、6 mL甲醇和6 mL 2%氨水甲醇洗脱萃取柱,氮气吹干定容至1 mL后分别进样测定。结果表明,相对于仅使用甲醇和仅使用2%氨水甲醇为洗脱液,甲醇和2%氨水甲醇组合模式对本研究所检测的 15 种头孢菌素的回收率较好,具体见图4。

图4 洗脱溶剂对15种头孢类抗生素回收率的影响(n=6)Fig.4The effect of eluent solvent on the recoveries of 15 cephalosporins(n=6)
2.4 线性关系、检出限与定量限
逐级稀释15种头孢菌素混合标准工作液(1 mg/L)配制标准曲线,并加入200 μL的7种同位素内标混合工作液(100 μg/L),其质量浓度分别为1.0、2.0、5.0、10.0、20.0和50.0 μg/L标准溶液,其中内标质量浓度为20 μg/L,按照2.2节及2.3节的条件进行测定。以头孢菌素的质量浓度为横坐标,以各组分定量离子响应值与相应内标离子响应值的比值为纵坐标,进行线性回归分析。结果表明,在1.0~50.0 μg/L范围内15种头孢菌素的线性关系良好。
采用标准溶液加入法,在空白水样中添加一定浓度的标准溶液进行测定,以定量离子信噪比S/N=3对应的浓度为样品的检出限(LOD),S/N=10为标准确定定量限(LOQ),得到15种头孢菌素的LOD为0.03~0.30 μg/L,LOQ为0.1~0.9 μg/L。

表3 15种头孢菌素的线性方程、线性范围、相关系数、检出限、定量限Tab.3 Linear equations,linear ranges,correlation coefficients (r),limits of detections (LODs)and limits of quantifications (LOQs)of 15 cephalosporins
2.5 回收率和精确度
准确量取500 mL空白水样,分别加入100 μg/L 15种头孢菌素混合标准工作液50、100 和200 μL,即加标水平为5.0、10.0和20.0 μg/L,每个加标水平进行6次平行测定。结果表明,15种头孢菌素的加标回收率在82.6%~116.3%,RSD在1.51%~8.94%。

表4 15种头孢菌素的回收率和精密度Tab.4 Recoveries and precisions of 15 cephalosporins n=6
2.6 实际样品测定
应用建立的分析方法,对采集的20份水产池塘养殖水、水源水及排放水进行了检测。结果显示在20个水样中,15种头孢菌素均未检出。
3 结论
水环境中的头孢菌素过HLB 固相萃取柱净化富集后,采用内标法,通过优化固相萃取条件,液相色谱—串联质谱进样分析,样品前处理简单,准确度和精密度良好,检出限符合检测要求,方法可靠快速,可为渔业水质中多种头孢菌素含量的同时测定提供依据。
