FMRP/mTOR信号级联失调与脑损伤早产儿远期神经发育的关系
2021-03-25李慧玲闵双武司媛王丽阳衣兰云戚家峰
李慧玲 闵双武 司媛 王丽阳 衣兰云 戚家峰

【摘要】 目的:探究FMRP/mTOR信號级联失调与脑损伤早产儿远期神经发育的关系。方法:选取2019年1月-2021年6月在省妇幼保健院出生的60例缺血缺氧性脑损伤早产儿为脑损伤组,选取同时期在医院生产的无缺血缺氧性脑损伤早产儿60例为对照组。新生儿出生24 h后抽取血液样本用于蛋白印迹分析FMRP/mTOR的表达。通过马伦早期学习量表(MSEL)、皮博迪发育运动量表(PDMS)和Vineland适应性行为量表(VABS)评估新生儿的神经发育。结果:脑损伤组FMRP和磷酸化FMRP蛋白表达均低于对照组,p70S6K和磷酸化p70S6K蛋白表达均高于对照组(P<0.05)。脑损伤组MSEL、PDMS和VABS评分均低于对照组(P<0.05)。结论:FMRP/mTOR通路的失调可能在脑损伤早产儿的发病机制中起作用,会影响幸存者的神经发育功能,因此,FMRP/mTOR信号通路可能是治疗脑损伤早产儿及其神经认知缺陷的一个可能的新分子靶点。
【关键词】 FMRP/mTOR 脑损伤 早产儿 远期神经发育 认知行为功能
Relationship between Long-term Neurodevelopment in Preterm Infants with Brain Injury and FMRP/mTOR Signal Cascade Maladjustment/LI Huiling, MIN Shuangwu, SI Yuan, WANG Liyang, YI Lanyun, QI Jiafeng. //Medical Innovation of China, 2021, 18(34): -130
[Abstract] Objective: To explore the relationship between long-term neurodevelopment of preterm infants with brain injury and FMRP/mTOR signal cascade maladjustment. Method: A total of 60 premature infants with hypoxic-ischemic brain injury born in the Provincial Maternal and Child Health Hospital from January 2019 to June 2021 were selected as the brain injury group, and 60 preterm infants without hypoxic-ischemic brain injury born in the hospital during the same period were selected as the control group. Blood samples were taken at 24 h of birth for Western blot analysis of FMRP/mTOR expression. The neurodevelopment of newborns was evaluated by Marlen scale of early learning (MSEL), Peabody developmental movement scale (PDMS) and Vineland adaptive behavior scale (VABS). Result: The expressions of FMRP and phosphorylated FMRP protein in the brain injury group were lower than those in the control group, and the expressions of p70S6K and phosphorylated p70S6K protein were higher than those in the control group (P<0.05). The scores of MSEL, PDMS and VABS in the brain injury group were lower than those in the control group (P<0.05). Conclusion: The imbalance of FMRP/mTOR pathway may play a role in the pathogenesis of preterm infants with brain injury and affect the neurodevelopmental function of survivors. Therefore, FMRP/mTOR signaling pathway may be a possible new molecular target for the treatment of preterm infants with brain injury and their neurocognitive defects.
[Key words] FMRP/mTOR Brain damage Premature infant Long-term neurodevelopment Cognitive behavioral function
First-author’s address: Harbin Children’s Hospital, Harbin 150010, China
doi:10.3969/j.issn.1674-4985.2021.34.030
近年来,早产儿脑损伤是一个日益受到关注的问题。神经影像学的创新提高了对活婴儿小脑损伤的诊断敏感性[1],这些病变的信号特征表明有明显的出血成分。尽管人们越来越认识到这个问题,但目前关于早产儿脑损伤长期神经发育后果的数据非常有限。迄今为止,结果研究仅限于病例报告或随访时年龄分布广泛的小病例系列,结果通常基于医学图表审查或非正式神经发育评估。早产是导致包括脑瘫在内的长期运动缺陷的一个公认原因[2]。此外,最近关于早产幸存儿长期的研究报告强调了神经发育的问题,包括认知功能障碍、学习和行为障碍[3]。传统上,小脑被认为是运动系统的核心组成部分,几乎没有任何非运动功能[4]。然而,最近对成人和儿童的研究表明小脑在非运动功能(包括认知、学习和行为)中发挥重要作用[5]。迄今为止,关于早产相关小脑损伤在认知、语言障碍及行为障碍的数据非常有限。鉴于早产儿脑病和自闭症谱系障碍之间的表型重叠,假设围生期缺氧缺血性脑损伤可能影响包含与脆性X综合征有关的FMRP基因的控制通路[6]。脆性X综合征是智力障碍最常见的遗传原因,在30%的病例中伴有自闭症谱系障碍,占所有自闭症诊断病例的6%。它通常是由FMR基因的三核苷酸重复扩增引起的,导致其转录减少或缺失,从而导致FMR蛋白的翻译减少[7-8]。哺乳动物雷帕霉素靶标(mTOR)信号级联是FMRP下游效应器之一,特别被认为是翻译的中央调节器,在发育神经元以建立高级脑功能的突触基础上至关重要[9]。值得注意的是,mTOR底物p70S6K可以调节FMRP的mRNA结合活性,而Fmr1KO小鼠表现出增强的mTOR通路激活并表现出与自闭症谱系障碍患者相似的行为表型[10]。尽管如此,虽然氧化应激和mGluRs已被证明在早产儿脑病和其他脑部疾病的发病机制中起主要作用,但缺氧缺血性损伤后围生期FMRP表达的作用仍未确定。为了填补这项初步研究中的这一空白,笔者评估了脑损伤早产儿FMRP和mTOR的发育表达,并探讨与远期神经发育的关系。现报道如下。
1 资料与方法
1.1 一般资料 选取2019年1月-2021年6月在省妇幼保健院出生的60例缺血缺氧性脑损伤早产儿作为脑损伤组,纳入的脑损伤新生儿全部成活,未出现死亡病例。选取同时期无缺血缺氧性脑损伤早产儿60例作为对照组。纳入标准:性别不限,胎龄28~37 d;研究组新生儿颅脑超声报告确诊为缺血缺氧性脑损伤,对照组为无缺血缺氧性脑损伤早产儿;参与后期神经發育功能检查;全程参与随访研究。排除标准:疑似脑畸形、畸形特征、先天性异常;代谢紊乱或中枢神经系统感染。本研究已经医院伦理学委员会批准,患儿家属均知情同意并签署知情同意书。
1.2 方法
1.2.1 抗体 以下抗体用于蛋白印迹程序:(1)抗磷酸S6核糖体蛋白(Ser235/236)兔多克隆抗体(货号2211,1∶200,Cell Signaling,波士顿,马萨诸塞州);(2)抗FMRP兔多克隆抗体(Ab17722,1∶5 000,Abcam,Cambridge,MA);(3)抗GFAP小鼠单克隆抗体(M0761,预稀释,Dako,安捷伦科技有限公司,加利福尼亚州卡宾蒂亚);(4)抗OLIG2小鼠单克隆抗体(MABN50,1∶100,马萨诸塞州比利里卡);(5)抗mGluR5小鼠单克隆抗体(MABN540,1∶100,马萨诸塞州比利里卡)。
1.2.2 蛋白质印迹分析 新生儿出生24 h后抽取血液样本用于蛋白印迹分析。mTOR下游靶标的蛋白质印迹分析p70S6K(货号2708,1∶200,Cell Signaling,波士顿,马萨诸塞州)和磷酸化p70S6K(Thr389)(货号9205,1︰250,Cell Signaling,波士顿。MA)和FMRP(货号:Ab17722,1∶1 000,马萨诸塞州剑桥市)和磷酸化FMRP(Ser499)(货号:Ab48127,1︰500,马萨诸塞州剑桥市);抗β-肌动蛋白小鼠单克隆抗体(货号:A5411,1︰2 000,西格玛·奥尔德里奇,密苏里州圣路易斯)根据常规方法进行。
1.2.3 神经发育评估 由儿科神经科医生对两组早产儿进行正式的神经系统检查,其中包括评估颅骨大小、颅神经、特殊感觉和运动功能(即深腱反射、肌张力、肌肉力量、协调性和步态),这些领域中发现一项异常都被归类为异常。小头畸形的定义是头围低于矫正年龄的第二个百分位数。马伦早期学习量表(MSEL)是针对0~69个月大儿童的标准化发育评估,由5个分量表组成,即粗大运动、精细运动、视觉接收、接受语言和表达语言。还导出了所有认知表现(早期学习综合)的一般认知功能的汇总测量,并表示为标准分数[11]。可以分别计算五个等级的百分位等级和年龄当量,分数越高认知功能越好。皮博迪发育运动量表(PDMS)使用标准化程序客观地评估儿童的粗大运动和精细运动能力,推导出每个运动域的发育运动商数。包括视觉追踪、抓握能力、上肢移动能力、手眼协调能力、操作能力,量表各维度按3级评分制:0分为不能尝试或没有尝试做某项动作;1分为在项目中的表现与标准相似,但没有完全符合标准;2分为在项目中的表现已经达到掌握标准[12]。90分以下判定为该项发育迟缓,评分越低发育迟缓越严重。Vineland适应性行为量表(VABS)是衡量0~18岁儿童在交流、日常生活、社交和运动技能方面的功能状态的判别性规范参考量度。量表各维度按3级评分制,分值范围0~100分,平均分值≥90分为优,75~89分为良,61~74分为可,≤60分为差,分数越高,适应性行为越强[13]。
1.3 统计学处理 采用SPSS 22.0软件对所得数据进行统计分析,符合正态分布的计量资料用(x±s)表示,组间比较采用独立样本t检验;计数资料以率(%)表示,比较采用字2检验。以P<0.05为差异有统计学意义。
2 结果
2.1 两组一般资料比较 脑损伤组,男婴28例,女婴32例;孕周28~36周,平均(32.46±3.52)周;出生体重1.6~3.1 kg,平均(2.25±0.41) kg。对照组,男婴33例,女婴27例;孕周27~36周,平均(31.84±3.45)周;出生体重1.7~3.3 kg,平均(2.35±0.43)kg。两组性别、孕周、出生体重比较,差异均无统计学意义(P>0.05),具有可比性。
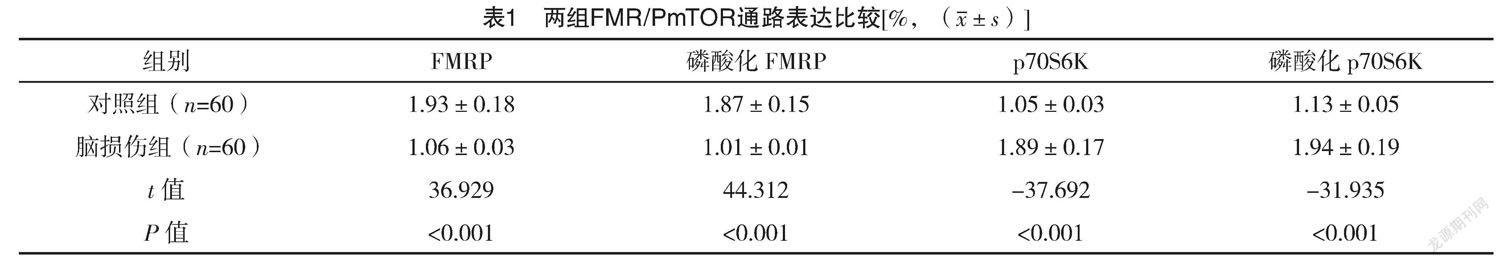
2.2 两组FMR/PmTOR通路表达比较 脑损伤组FMRP和磷酸化FMRP蛋白表达均低于对照组,差异均有统计学意义(P<0.05);脑损伤组p70S6K和磷酸化p70S6K蛋白表达均高于对照组,差异均有统计学意义(P<0.05),见表1。
2.3 两组神经行为发育评分比较 脑损伤组MSEL、PDMS和VABS评分均低于对照组,差异均有统计学意义(P<0.05),见表2。
3 讨论
新生儿-围生期医学的技术进步导致早产儿存活率稳步上升。虽然早产儿的存活率得到了显著的提高,但早产儿的脑损伤和长期神经发育缺陷风险仍然很高,尤其是脑损伤早产儿。
大量幸存早产儿患有严重的神经认知缺陷和脑瘫,因此早产儿缺氧缺血引起的脑损伤对公共健康具有重要意义。本研究发现FMRP在对照组中过度表达,表明FMRP在该特定时期影响突触可塑性基因的翻译调节中具有生理作用。相比之下,脑损伤早产儿在这个关键的发育时期表现出FMRP的下调和伴随的mTOR下游靶点的过度表达。在脑损伤组观察到mTOR信号通路的激活增强,伴随着FMRP和磷酸化FMRP的下调,这与先前在Fmr1KO小鼠中报道的分子表达非常相似[14]。活性依赖的树突状mRNA翻译通常由FMRP调节,FMRP通常与多种其他信号蛋白一起作用,抑制影响突触可塑性的各种基因的翻译。FMRP水平与临床后果的水平相关,包括结构、功能和认知大脑受累[15]。已知mTOR信号级联的激活通过促进发育过程中的分化、轴突伸长和分支以及突触形成来促进正常神经元生长。然而,正常生理过程的任何中断都可能对大脑发育产生影响。mTOR信号的过度激活会导致神经元和神经胶质的异常发育,从而导致脑畸形[16]。在本研究中,这些新的观察表明,过早缺氧缺血性脑损伤可能导致其长期后遗症的机制之一是通过信号通路失调,与遗传性智力障碍和自闭症综合征有关。早产儿脑病包括各种神经元/轴突缺陷、多动症和自闭症谱系障碍在内的认知缺陷是其主要的神经发育后遗症。
在对远期神经发育的研究中,本研究发现与对照组相比,脑损伤早产儿的后续神经发育障碍的风险显著增加,表明脑损伤早产儿神经行为与患儿的预后相关。众所周知,小脑在协调运动中起着核心作用,尤其是在妊娠晚期,小脑的生长发育迅速增加,這种加速生长的特征是颗粒前体细胞从小脑皮质的外部颗粒层增殖和迁移到内部颗粒层。这个过程对小脑的结构和功能完整性至关重要。在这个发育阶段,小脑特别容易受到缺氧缺血造成发育损伤。对胎羊的实验研究表明,围生期窒息会增加神经元死亡和氧化应激,并减少早产小脑中的小脑层和星形胶质细胞[17]。这些最近的研究结果表明,小脑损伤可能导致与“早产儿脑病”相关的发病率,并强调了保护小脑免受围生损伤以防止长期神经发育障碍的重要性。最近对成人和年龄较大儿童的研究表明,小脑在语言、认知和社会功能的发展中发挥着重要作用,因此需要对小脑病理学的功能后果进行更广泛的调查。现有报告描述了一个选定的早产儿亚组,具有广泛和对称形式的小脑损伤,这些损伤总是与脑桥发育不全和幕上实质损伤相关[18]。这些婴儿表现出严重的神经功能障碍,包括小头畸形、痉挛性四肢瘫痪、肌张力障碍、共济失调和癫痫发作。然而,这些研究受到使用小样本、测试时年龄范围广泛以及缺乏标准化评估的限制。
综上所述,FMRP/mTOR通路的失调可能在脑损伤早产儿的发病机制中起作用,会影响幸存者的神经发育功能,因此,FMRP/mTOR信号通路可能是治疗脑损伤早产儿及其神经认知缺陷的一个可能的新分子靶点。
参考文献
[1] Ramos S G,Rattis B,Ottaviani G,et al.ACE2 Down-Regulation May Act as a Transient Molecular Disease Causing RAAS Dysregulation and Tissue Damage in the Microcirculatory Environment Among COVID-19 Patients[J].Am J Pathol,2021,191(7):1154-1164.
[2]李超芹.脑性瘫痪患儿围产期高危因素调查研究[D].广州:南方医科大学,2019.
[3] Taylor G,O’Shea T M.Changes in Self-reported Quality of Life as Survivors of Extremely Preterm Birth Enter Adulthood[J].Journal of Pediatrics,2021,237:11-13.
[4] Malvestio R B,Medeiros P,Negrini-Ferrari S E,et al.Cannabidiol in the prelimbic cortex modulates the comorbid condition between the chronic neuropathic pain and depression-like behaviour in rats:The role of medial prefrontal cortex 5-HT(1A) and CB(1) receptors[J].Brain Res Bull,2021,174:323-338.
[5] Medeiros P,de Freitas R L,Boccella S,et al.Characterization of the sensory,affective,cognitive,biochemical,and neuronal alterations in a modified chronic constriction injury model of neuropathic pain in mice[J].J Neurosci Res,2020,98:338-352.
[6] Dong J,Lei J,Elsayed N A,et al.The effect of intrauterine inflammation on mTOR signaling in mouse fetal brain[J].Dev Neurobiol,2020,80:149-159.
[7] TIAN J,YANG L,WANG P,et al.Exogenous CGRP Regulates Apoptosis and Autophagy to Alleviate Traumatic Brain Injury Through Akt/mTOR Signalling Pathway[J].Neurochem Res,2020,45:2926-2938.
[8]羅诗坤,何文斌,廖怡,等.不明原因智力障碍患者的FMR1基因分析及产前诊断[J].中华医学遗传学杂志,2021,38(5):439-445.
[9]刘杰,李景东.哺乳动物雷帕霉素靶蛋白信号通路在心脏发育和重构中作用的研究进展[J].心血管病学进展,2018,39(6):43-47.
[10] WANG Y,ZHAO M,SHANG L,et al.Homer1a protects against neuronal injury via PI3K/AKT/mTOR signaling pathway[J].Int J Neurosci,2020,130(6):621-630.
[11] Kim A,Poe M,Escolar M.Mullen Scales of Early Learning(MSEL) and Bayley Scales of Infant and Toddler Development(BSID):Utility in assessing cognitive endpoints in MPS clinical trials[J].Molecular Genetics and Metabolism,2021,132(2):S55.
[12] Tavasoli A,Azimi P,Montazari A.Reliability and Validity of the Peabody Developmental Motor Scales-Second Edition for Assessing Motor Development of Low Birth Weight Preterm Infants[J].Pediatric Neurology,2014,51(4):522-526.
[13] Farmer C,Adedipe D, Bal V H,et al.Concordance of the Vineland Adaptive Behavior Scales,second and third editions[J].J Intellect Disabil Res,2020,64(1):18-26.
[14] Modgil A,Vien T N,Ackley M A,et al.Neurosteroids reverse tonic inhibitory deficits in Fragile X syndrome mouse model[J/OL].Front Mol Neurosci,2019,12:e15.
[15] ZHANG Z,HOU H,YU S,et al.Inflammation-induced mammalian target of rapamycin signaling is essential for retina regeneration[J].Glia,2020,68:111-127.
[16] LI Y,WU P,DAI J,et al.Inhibition of mTOR Alleviates Early Brain Injury After Subarachnoid Hemorrhage Via Relieving Excessive Mitochondrial Fission[J].Cell Mol Neurobiol,2020,40:629-642.
[17] Arabian M,Aboutaleb N,Ajami M,et al.Interaction of mTOR and iNOS pathways in protection against Ischemia/Reperfusion injury[J].Iran J Pharm Res,2019,18:785-792.
[18] Zhao X F,Liao Y,Alam M M,et al.Microglial mTOR is Neuronal Protective and Antiepileptogenic in the Pilocarpine Model of Temporal Lobe Epilepsy[J].J Neurosci,2020,40:7593-7608.
(收稿日期:2021-09-14)
基金项目:黑龙江省卫生健康委科研项目(2019-235)
①哈尔滨市儿童医院 黑龙江 哈尔滨 150010
通信作者:戚家峰
