微生态制剂防治腹腔镜辅助巨结肠Soave根治术患儿围术期小肠结肠炎的临床效果
2021-03-25李伟坚李志雄陈锐源陈江谊冯燕琼陆金荣
李伟坚 李志雄 陈锐源 陈江谊 冯燕琼 陆金荣


【摘要】 目的:探究微生態制剂防治腹腔镜辅助巨结肠Soave根治术围术期患儿小肠结肠炎的临床效果。方法:选取2017年1月-2019年12月在本院行腹腔镜辅助巨结肠Soave根治术的先天性巨结肠患儿84例,采用随机数表法将其分为A、B组,各42例。A组患儿术前准备按照传统方法(即术前口服肠道抗菌药),B组患儿于术前5 d开始口服肠道微生物制剂(枯草杆菌二联活菌颗粒)替代术前抗菌药,术后24 h起继续口服枯草杆菌二联活菌颗粒至术后第7天。对比两组患儿入院时、术后第7天肠道菌群数量、炎症反应指标以及营养指标,并统计两组术后小肠结肠炎的发生情况。结果:术后7 d,两组患儿的细菌、球菌及杆菌总数均明显高于入院时(P<0.05),且B组上述指标均明显高于A组(P<0.05);B组杆球菌比值与入院时比较,差异无统计学意义(P>0.05)。术后7 d,B组的血清C反应蛋白(CRP)、肿瘤坏死因子-α(TNF-α)以及白细胞介素-6(IL-6)均明显低于A组(P<0.05)。A组术后7 d各营养指标水平均明显低于入院时(P<0.05);B组术后7 d各营养指标水平与入院时相比,差异均无统计学意义(P>0.05),且B组术后7 d各指标水平均显著高于A组(P<0.05)。B组的小肠结肠炎发生率为7.14%,低于A组的23.81%(P<0.05)。结论:将微生态制剂应用于腹腔镜辅助巨结肠Soave根治术围术期患儿中,可有效纠正其肠道菌群失调现象,减少炎症反应并改善营养状况,降低小肠结肠炎的发生率。
【关键词】 微生态制剂 先天性巨结肠 Soave根治术 围术期 小肠结肠炎
Clinical Effect of Probiotics on Preventing Perioperative Enterocolitis in Children Undergoing Laparoscopic-assisted Soave Radical Resection of Megacolon/LI Weijian, LI Zhixiong, CHEN Ruiyuan, CHEN Jiangyi, FENG Yanqiong, LU Jinrong. //Medical Innovation of China, 2021, 18(23): 0-022
[Abstract] Objective: To explore the clinical effect of probiotics on preventing perioperative enterocolitis in children undergoing laparoscopic-assisted Soave radical resection of megacolon. Method: A total of 84 children with congenital megacolon who underwent laparoscopic-assisted Soave radical resection in the hospital from January 2017 to December 2019 were enrolled. They were divided into group A and B by random number table method, 42 cases in each group. The group A was treated with traditional method (oral intestinal antibacterial before surgery), while group B was treated with intestinal probiotics (Combined Bacillus Subtilis and Enterococcus Faecium Granules with Multivitamines, Live) at 5 d before surgery in place of preoperative antibacterial, and then treated with oral Combined Bacillus Subtilis and Enterococcus Faecium Granules with Multivitamines, Live at 24 h after surgery till the 7th day after surgery. The differences in number of intestinal floras, inflammatory response indexes and nutritional indexes at admission and 7 d after surgery were compared and analyzed between the two groups, the incidence of postoperative enterocolitis in both groups was statistically analyzed. Result: 7 d after surgery, the total number of bacteria, cocci and bacilli in the two groups were significantly higher than those at admission (P<0.05); and the above indicators in group B were significantly higher than those in group A (P<0.05); the ratio of bacillus in group B did not change significantly compared with that at admission (P>0.05). 7 d after surgery, concentrations of serum C-reactive protein (CRP), tumor necrosis factor-α (TNF-α) and interleukin-6 (IL-6) in group B were significantly lower than those in group A (P<0.05); 7 d after surgery, the levels of all nutrition indexes in group A were significantly lower than those at admission (P<0.05); 7 d after surgery, there was no statistical significance in the level of nutritional indexes in group B compared with at admission (P>0.05); 7 d after surgery, the levels of all nutrition indexes in group B were significantly higher than those in group A (P<0.05). The incidence of enterocolitis in group B was 7.14%, lower than 23.81% in group A (P<0.05). Conclusion: The application of probiotics in perioperative children undergoing laparoscopic-assisted Soave radical resection of megacolon can effectively correct intestinal flora imbalance, reduce inflammation response, improve nutritional status, and reduce the incidence of enterocolitis.
[Key words] Probiotics Congenital megacolon Soave radical resection Perioperative period Enterocolitis
First-author’s address: Jiangmen Central Hospital, Jiangmen 529000, China
doi:10.3969/j.issn.1674-4985.2021.23.005
先天性巨结肠是小儿临床中较为常见的消化道畸形疾病,其主要机制为肠神经节细胞减少或缺如,引起肠壁神经功能紊乱,当肠管痉挛和收缩时,近端肠管内容物无法继续向前推进,结肠扩张加剧,导致患儿出现或轻或重的腹胀[1]。Soave根治术是临床治疗先天性巨结肠的有效手段,可有效改善患儿症状,降低该病死亡率,但术后患儿可能会出现发热、腹泻以及腹胀等表现,引发相关性小肠结肠炎[2]。数据显示,18%~50%的先天性巨结肠术后患儿伴发小肠结肠炎[3],且部分患儿存在肠穿孔的风险。因此,如何有效降低先天性巨结肠患儿Soave根治术后小肠结肠炎的发生率,是临床亟待解决的一个问题[4]。本研究拟通过在腹腔镜辅助巨结肠Soave根治术围术期应用微生物制剂替代术前肠道抗菌药物的使用,探讨由此对患儿术后小肠结肠炎的防治效果。现报道如下。
1 资料与方法
1.1 一般资料 选取2017年1月-2019年12月在本院治疗的先天性巨结肠患儿84例。(1)纳入标准:①经肛门直肠测压、钡剂灌肠以及病理学检查确诊;②行腹腔镜辅助巨结肠Soave根治术。(2)排除标准:①患有先天性心脏病;②生命体征不稳定;③家属配合度较低。采用随机数表法将患儿分为A、B组,各42例。患儿监护人知情同意,本研究已经医院伦理批准。
1.2 方法 所有患儿术前采用等渗的0.9%氯化钠注射液(生产厂家:四川科伦药业股份有限公司,批准文号:国药准字H51021158,規格:4.5 g︰500 mL),100 mL/kg,灌肠,配合腹部按摩,1次/d,
连续14 d。A组于术前3 d给予头孢克洛干混悬剂(生产厂家:礼来苏州制药有限公司,批准文号:国药准字H10983028,规格:0.125 g/袋),20 mg/(kg·d),分3次口服,进行肠道杀菌,连续治疗3 d。术前1 d晚上及手术当日早晨须彻底清洁灌肠。术后给予注射用头孢硫脒(生产厂家:广州白云山制药股份有限公司广州白云山制药总厂,批准文号:国药准字H44024253,规格:1.0 g/瓶),50~100 mg/(kg·d),静脉滴注,分2次给药,连续治疗3 d。B组患儿于术前5 d口服枯草杆菌二联活菌颗粒(生产厂家:北京韩美药品有限公司,批准文号:国药准字S20020037,规格:0.1 g/袋),年龄≤2岁的患儿1袋/次,>2岁的患儿2袋/次,温水冲服,1次/d,并于术后继续加服枯草杆菌二联活菌颗粒,持续至术后第7天,其余围术期的处理同A组。
1.3 观察指标 (1)肠道菌群数量:于患儿入院时、术后7 d采集新鲜大便0.5 g,稀释后接种于选择性培养基平板上进行细菌培养并检测菌群数量。(2)炎症反应指标:于入院时和术后7 d,采集患儿空腹静脉血4 mL,检测血清C反应蛋白(CRP)、肿瘤坏死因子-α(TNF-α)以及白细胞介素-6(IL-6)水平。(3)营养指标:于入院时和术后7 d,采集空腹静脉血,检测外周血血清白蛋白(ALB)、前白蛋白(PA)、转铁蛋白(TF)以及血淋巴细胞计数(TLC)等营养指标。(4)小肠结肠炎发病率:借助电话随访或者门诊复查,对患儿进行为期6个月的随访。依据临床症状进行分级,轻度为体温不超过38 ℃,腹泻不超过5次/d,腹胀程度为轻、中度;中度为体温在38~40 ℃,腹泻6~8次/d,腹胀程度为中度,脱水程度为轻、中度;重度为体温超过40 ℃,腹泻超过10次/d,腹胀与脱水程度均为重度,精神萎靡,甚至休克[5]。
1.4 统计学处理 采用SPSS 20.0软件对所得数据进行统计分析,计量资料用(x±s)表示,组间比较采用独立样本t检验,组内比较采用配对t检验;计数资料以率(%)表示,比较采用χ检验。以P<0.05为差异有统计学意义。
2 结果
2.1 两组一般资料比较 A组男26例,女16例,年龄1~12岁,平均(5.69±1.28)岁;B组男28例,女14例,年龄2~12岁,平均(5.82±1.14)岁。两组一般资料比较,差异均无统计学意义(P>0.05),具有可比性。
2.2 两组肠道菌群数量比较 入院时,两组的肠道菌群数量比较,差异均无统计学意义(P>0.05)。术后7 d,两组患者的细菌、球菌及杆菌总数均明显高于入院时(P<0.05),且B组杆球菌比值较入院时无明显变化(P>0.05);B组术后7 d的细菌、球菌及杆菌总数均明显高于A组(P<0.05)。见表1。
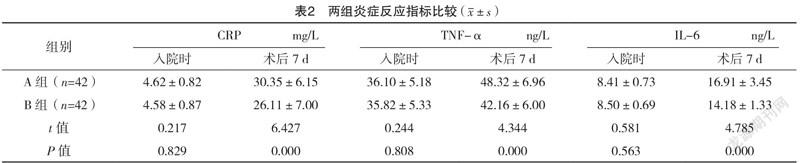
2.3 两组炎症反应指标比较 入院时,两组各炎症反应指标比较,差异均无统计学意义(P>0.05);术后7 d,B组的CRP、TNF-α以及IL-6均明显低于A组,差异均有统计学意义(P<0.05)。见表2。
2.4 两组营养指标比较 入院时,两组营养指标比较,差异均无统计学意义(P>0.05);A组术后7 d各营养指标水平均明显低于入院时(P<0.05);B组术后7 d各营养指标水平与入院时相比,差异均无统计学意义(P>0.05),且B组术后7 d各营养指标水平均显著高于A组,差异均有统计学意义(P<0.05)。见表3。
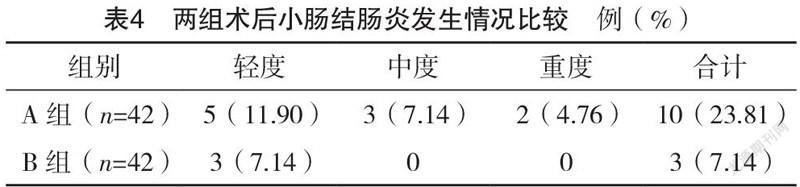
2.5 两组小肠结肠炎发生情况比较 B组术后小肠结肠炎的发生率显著低于A组,差异有统计学意义(P<0.05),见表4。
表4 两组术后小肠结肠炎发生情况比较 例(%)
组别 轻度 中度 重度 合计
A组(n=42) 5(11.90) 3(7.14) 2(4.76) 10(23.81)
B组(n=42) 3(7.14) 0 0 3(7.14)
3 讨论
小肠结肠炎是造成先天性巨结肠患儿死亡的主要原因之一[6-7],目前临床对于小肠结肠炎的发病机制普遍认知为肠神经发育缺陷(即肠肌间神经丛中神经节细胞缺如)[8]。其中肠内菌群失衡、肠黏膜免疫屏障受损、出口梗阻、拖出结肠移行段等均会诱发小肠结肠炎[9]。同时,幼儿肠管发育尚未完善,肠黏膜免疫屏障失衡,一旦出现肠管损伤,其修复、愈合的过程相对较为漫长,故而先天性巨结肠患儿在Soave根治术后并发小肠结肠炎的概率较高,为临床中的高危群体[10-11]。现今众多医师对于先天性巨结肠患儿的治疗,主张通过提高根治术疗效、改善肠道菌群失调等途径来预防术后小肠结肠炎的发生,保障患儿生命安全[12]。
微生态制剂作为一种新兴的治疗方式,对潜在病原菌繁殖进行竞争性抑制,从而减少其侵入肠黏膜并释放致病毒素,同时增强肠黏膜免疫屏障,促进肠道上皮组织修复[13-14]。本研究结果显示,B组患儿采用微生态制剂后其小肠结肠炎的发生率为7.14%,明显低于A组的23.81%(P<0.05),且B组患儿的病情分级均集中于轻度,提示微生態制剂的使用,能够减轻患儿的腹胀,缓解病情的严重程度,有效降低小肠结肠炎的发生率,比口服肠道抗菌药物的效果更为突出[15]。
肠道菌群是构成肠道内环境的重要因素,各种菌群不论性质,其在肠道中的数量、作用以及定位都是特有的,只有当肠道出现异常时,菌群才会紊乱,出现失调的现象并对机体产生不利影响,譬如可增加小儿小肠结肠炎的发生率[16]。枯草杆菌二联活菌颗粒是含有枯草杆菌和肠球菌的肠道微生物制剂,服药后可抑制有害菌及腐败菌在患儿肠道内繁殖,并减少毒素在肠道吸收,从而调节肠道功能,促进其恢复[17-18]。本研究中B组术后7 d的细菌、球菌及杆菌总数均明显高于A组(P<0.05),且B组杆球菌比值较入院时无明显变化(P>0.05),提示服用微生物制剂后能够帮助患儿稳定肠道菌群,帮助患儿快速建立肠道菌群,有利于肠道构成定值抗力,改善肠道的免疫功能,加强肠道间的连接,预防细菌移位现象。此外,本研究显示,术后7 d,B组的CRP、TNF-α以及IL-6均明显低于A组(P<0.05),表明围术期应用微生物制剂可有效补充有益的杆球菌,有助于患儿术后肠道正常菌群的重建,扭转肠道菌群失调状况[19-20]。同时,B组术后7 d各指标水平均显著高于A组(P<0.05),说明微生物制剂对于患儿的营养指标具有积极的调节作用。
综上所述,微生态制剂可有效降低腹腔镜辅助巨结肠Soave根治术围术期患儿小肠结肠炎的发生率,调节患儿肠道菌群,改善炎症反应水平和营养状况,具有极高的普及价值。
参考文献
[1]刘强,罗意革,陈嘉波,等.先天性巨结肠再手术60例临床分析[J].腹部外科,2018,31(1):56-59.
[2]王保烈,陈磊,姜会强.腹腔镜辅助行先天性巨结肠根治术的远期随访[J].现代仪器与医疗,2016,22(3):115-117.
[3]刘如意,侯广军,张飞,等.微生态制剂预防先天性巨结肠术后小肠结肠炎疗效观察[J].安徽医药,2019,23(11):2293-2295.
[4]王卫国,蔡灯塔.76例坏死性小肠结肠炎早产儿病因及微生态制剂预防作用观察[J].北方药学,2017,14(12):38-39.
[5]马春淼,侯广军,张现伟,等.微生态制剂预防先天性巨结肠手术患儿并发小肠结肠炎的效果观察[J].山西职工医学院学报,2019,29(1):3-5.
[6] Heuckeroth R O.Hirschsprung disease-integrating basic science and clinical medicine to improve outcomes[J].Nat Rev Gastroenterol Hepatol,2018,15(3):152-167.
[7] Porokuokka L L,Virtanen H T,Lindén J,et al.Gfra1 Underexpression Causes Hirschsprung’s Disease and Associated Enterocolitis in Mice[J].Cell Mol Gastroenterol Hepatol. 2019,7(3):655-678.
[8] Langer J C,Rollins M D,Levitt M,et al.Guidelines for the management of postoperative obstructive symptoms in children with Hirschsprung disease[J].Pediatr Surg Int,2017,33(5):523-526.
[9] Palleri E,Kaiser S,Wester T,et al.Complex Fluid Collection on Abdominal Ultrasound Indicates Need for Surgery in Neonates with Necrotizing Enterocolitis[J].Eur J Pediatr Surg,2017,27(2):161-165.
[10] Li B,Lee C,Cadete M,et al.Neonatal intestinal organoids as an ex vivo approach to study early intestinal epithelial disorders[J].Pediatr Surg Int,2019,35(1):3-7.
[11]张闪,郑松柏.微生态制剂防治消化系统疾病的临床研究进展[J].胃肠病学,2019,24(11):691-694.
[12]曾甜,李新宁,莫丹,等.微生态制剂预防先天性巨结肠相关性小肠结肠炎的效果[J].广西医学,2016,38(8):1066-1067,1100.
[13]马雅琼,李芝兰,夏冰.早期肠内营养联合微生态制剂治疗肝性脑病患者肠道菌群的改变[J].实用肝脏病杂志,2019,22(6):892-895.
[14]夏艳丽,陈宏伟,王友春,等.微生态调节剂对急性感染性腹泻患者血清炎性因子、肠黏膜屏障功能、肠道菌群的影响研究[J].中华医院感染学杂志,2016,26(21):4844-4846.
[15]姚爱敏,陈楠,孙学江,等.微生态制剂在早产儿坏死性小肠结肠炎中的防治效果[J].川北医学院学报,2018,33(1):26-28.
[16]杜喜峰,冯晋兴,于爱真,等.深度测序分析早产儿坏死性小肠结肠炎肠道菌群多样性变化[J].中国妇幼保健,2017,32(19):4700-4702.
[17]王绍强,王启荣.益生菌预防新生儿坏死性小肠结肠炎的临床效果[J].世界华人消化杂志,2016,24(15):2406-2409.
[18]张琼.早产儿早期使用枯草杆菌二联活菌散降低感染率及NEC发病率[J].当代医学,2019,25(4):78-80.
[19]朱达坚,陈小伍,伍锦浩,等.结直肠癌围手术期替代应用肠道微生态制剂对术后炎症反应及感染性并发症的影响[J].广东医学,2012,33(14):2121-2123.
[20]周翠萍,刘佳琪,高岱佺,等.微生态制剂干预对重症脑梗死患者肠道微生态免疫功能及炎性指标的影响[J].中华老年医学杂志,2019,38(11):1247-1250.
(收稿日期:2020-10-14) (本文编辑:张爽)
