IGF-2、IGFBP-3在胎儿生长受限患者胎盘组织中的表达及其临床意义
2021-03-24殷欣欣崔照领马丽静莫世娇杨永红莫中福
殷欣欣,崔照领,马丽静,莫世娇,杨永红,莫中福
(石家庄市妇幼保健院1.产科;2.功能科;3.妇产急诊ICU;4.产前诊断中心;5.妇产科,石家庄 050000)
胎儿生长受限(fetal growth restriction,FGR)属于临床上妊娠疾病,指胎儿无法在子宫内充分发挥其生长潜能,导致足月妊娠胎儿出生体重<2 500 g或胎儿体重低于同孕龄平均体重的两个标准差或第10百分位数,其发病率高达5%~10%,是围生儿发病及畸形的主要病因之一,严重者可威胁生命[1-3]。目前FGR临床诊断困难,疗效甚微,其病因多及机制复杂,迄今仍未完全明了,因此寻求分子生物学诊断指标深入探寻其发病机制并监测、评估胎儿生长状况对临床及早采取相应措施改善预后具有重要意义。胎盘是胎儿生长发育、维持血运充足及营养物质摄取的重要保障,若其发生功能障碍则会对胎儿自身发育造成严重影响[4-5]。胰岛素样生长因子-2(insulin-like growth factor-2,IGF-2)是胰岛素样生长因子(IGFs)系统成员之一,血液中主要来自于肝脏,对人体细胞、器官的正常生长、分化、发育有重要作用,可以通过自分泌或旁分泌方式结合相应受体,进一步调节细胞生长、增殖、分化等[6]。蔡满红等[7]研究发现,妊娠期糖尿病巨大儿患者胎盘组织中IGF-2水平显著高于正常对照组,且提示IGF-2高表达水平与妊娠期糖尿病巨大儿发生关系密切。胰岛素样生长因子结合蛋白3(insulin-like growth factor binding protein-3,IGFBP-3)是一种细胞外分泌蛋白,能与IGFs结合并调节游离IGFs活性参与胎儿生长发育[8]。陶丽静等[9]研究发现,妊娠期糖尿病巨大儿患者脐血中IGFBP-3水平显著高于正常妊娠组,提示IGFBP-3水平与胎儿宫内发育密切相关。目前关于IGF-2、IGFBP-3在产妇外周血及新生儿脐血中表达水平与胎儿生长发育关系研究较多,而在FGR患者胎盘组织中的表达情况及意义少有报道,因此本研究同时分析二者在FGR患者胎盘组织中表达及意义,以期为深入研究FGR发病机制提供参考。
资料与方法
一、研究对象
回顾性分析2017年12月至2019年12月于本院经超声确诊FGR并住院分娩的孕妇110例为FGR组,年龄22~36岁。纳入标准:(1)符合乐杰主编的《妇产科学》第9版教材[10]中有关FGR诊断标准;(2)一般资料完整;(3)单胎无合并症孕妇。排除标准:(1)心脏、肝脏、肾脏功能异常者;(2)原发性高血压患者;(3)患有妊娠合并症如前置胎盘患者;(4)妊娠合并症者;(5)胎儿染色体异常者。另选择在本院同期分娩的正常单胎足月孕妇110例为对照组,年龄20~35岁。所有受试者均为单胎、初产妇,月经周期规律、末次月经明确。本研究经本院医学伦理委员会审批并通过。
二、主要试剂及仪器
TRIzol试剂(MN562J2)、逆转录试剂盒(J6547M)、实时荧光定量PCR(qRT-PCR)试剂盒(N5643MJ)购自美国Sigma公司;TakaRa PrimeScript RT试剂盒(ND6527J)、SYBR Premix ExTaq试剂盒(GH8935K)均购自苏州泓迅生物科技股份有限公司;IGF-2、IGFBP-3及内参GAPDH引物由上海生工生物工程有限公司合成;鼠抗人IGF-2多克隆抗体(ND4672-8)、鼠抗人IGFBP-3多克隆抗体(M9382-9),购自北京中衫金桥生物技术有限公司;内源性过氧化酶阻断剂(627925)、正常山羊封闭血清(M78320J)、生物素标记的IgG(O6721D)、DAB显色试剂盒(67869NJ),均购自福州迈新生物技术有限公司。荧光定量PCR分析仪(YFGB1022,Olympus,日本)。
三、研究方法
1.标本采集及处理:两组受试者均于剖宫产胎盘娩出后,于脐带连接于母体面中央处(避开坏死及钙化区)立即切取胎盘组织(大小约1 cm×1 cm×1 cm)两块。其中一块置于-80℃保存备用。另一块经生理盐水洗净后于10%甲醛溶液中固定,24 h后石蜡包埋,连续切片,制成3张切片(4 μm厚),65℃烤箱过夜,保存于37℃温箱,用于免疫组化测定。
2.qRT-PCR:从-80℃取出胎盘组织样本,按照RNA试剂盒说明书提取总RNA后,按照反转录试剂盒说明操作将RNA反转录为cDNA。严格按照qRT-PCR试剂盒说明进行qRT-PCR反应,所用引物序列见表1。反应体系为20 μl:SYBR Premix 10 μl,cDNA 1 μl,H2O 8 μl,上下游引物各0.5 μl。反应程序:95℃ 20 s;95℃ 10 s,60℃ 20 s,72℃ 10 s,共40个循环。以GAPDH作为内参基因,采用2-ΔΔCt法计算胎盘组织中IGF-2、IGFBP-3 mRNA相对表达水平。

表1 引物序列
3.免疫组织化学实验及结果判定:取FGR组及对照组胎盘组织切片,经脱蜡复水,PBS冲洗3次,每次3 min;滴加0.3%过氧化氢甲醇液以阻断内源性过氧化酶活性,室温孵育10 min,PBS冲洗3次,每次3 min;滴加5%正常山羊血清进行封闭,室温孵育10 min;滴加鼠抗人IGF-2(1∶500)、IGFBP-3(1∶500)抗体作为一抗,室温孵育30 min,PBS冲洗3次,每次3 min;滴加生物素标记二抗(1∶1 000),室温孵育30 min,PBS冲洗3次(3 min/次);滴加链霉素抗生物素蛋白-过氧化物酶(SP)溶液,室温孵育30 min,PBS冲洗3次(3 min/次);滴加新鲜配置的DAB显色液(0.04 DAB+0.03% H2O2)显色,显微镜下控制,充分水洗;苏木素复染2 min,梯度酒精脱水,二甲苯透明,中性树胶封片,应用NIS Elements F 3.0图像采集软件和NIS Elements BR 3.0图像分析软件(日本Nikon公司)进行图像采集。
结果判定:IGF-2、IGFBP-3蛋白表达均以胞浆和/或胞膜呈棕黄(褐)色颗粒为阳性;从每个切片中随机选取5个高倍视野的500个细胞,对细胞染色强度、阳性细胞百分比进行评分。(1)按细胞染色强度计分:无色为0分,淡黄色为1分,棕黄色为2分,棕褐色为3分;(2)按阳性细胞所占的百分比计分:小于5%为0分,5%~25%为1分,26%~50%为2分,51%~75%为3分,大于75%为4分。取上述两项结果的乘积:≤3分为蛋白在组织中阴性(-)表达,>3分为蛋白在组织中阳性(+)表达。蛋白的阳性表达率(%)=各组蛋白阳性表达人数/各组总人数×100%。
4.分析指标:包括年龄、孕前体质量指数(BMI)、终止孕周、胎儿体重、孕早期相关血浆蛋白A(Pregnancy-related plasma protein A,PAPP-A)及游离人绒毛膜促性腺激素(HCG)水平。
四、统计学方法
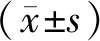
结 果
一、一般资料比较
两组间年龄、孕前BMI、终止孕周、HCG水平比较无显著性差异(P>0.05);FGR组的胎儿体重、PAPP-A水平显著低于对照组(P<0.05)(表2)。

表2 两组一般资料比较(-±s)
二、两组胎盘组织IGF-2及IGFBP-3的mRNA表达水平
与对照组比较,FGR组患者胎盘组织中IGF-2 mRNA表达水平显著降低(P<0.05),IGFBP-3 mRNA表达水平显著升高(P<0.05)(表3)。

表3 两组胎盘组织IGF-2、IGFBP-3 mRNA相对表达量比较(-±s)
三、两组胎盘组织IGF-2、IGFBP-3蛋白表达情况
两组胎盘组织中IGF-2、IGFBP-3蛋白均有不同程度表达,IGF-2阳性染色呈橘黄色颗粒,位于胞浆;IGFBP-3阳性染色呈棕黄色/褐色颗粒,位于胞浆及胞膜(图1)。
蛋白阳性表达率统计结果显示,与对照组比较,FGR组患者胎盘组织中IGF-2蛋白阳性表达率显著降低(P<0.05),IGFBP-3蛋白阳性表达率显著升高(P<0.05)(表4)。
四、FGR组患者胎盘组织中IGF-2、IGFBP-3蛋白表达的相关性分析
Spearman相关性分析结果显示,FGR患者胎盘组织中IGF-2和IGFBP-3的蛋白表达成显著负相关(r=-0.537,P=0.008)(表5)。
五、FGR影响因素的Logistic回归分析
以是否发生FGR为因变量,排除年龄等混杂因素后,以孕早期血清PAPP-A水平、胎盘组织中IGF-2、IGFBP-3 mRNA水平为自变量,进行二元Logistic回归分析。结果显示,孕早期血清PAPP-A水平及胎盘组织中IGF-2 mRNA异常低表达、IGFBP-3 mRNA异常高表达与FGR发生显著相关(P<0.05)(表6)。

注:白色箭头指胞浆和/或胞膜呈棕黄(褐)色颗粒处,即IGF-2、IGFBP-3蛋白的阳性表达。图1 胎盘组织中IGF-2、IGFBP-3的蛋白表达定位(SP染色法,×200)

表4 两组胎盘组织IGF-2、IGFBP-3蛋白阳性率比较[n(%)]

表5 FGR患者胎盘组织中IGF-2、IGFBP-3蛋白表达相关性分析
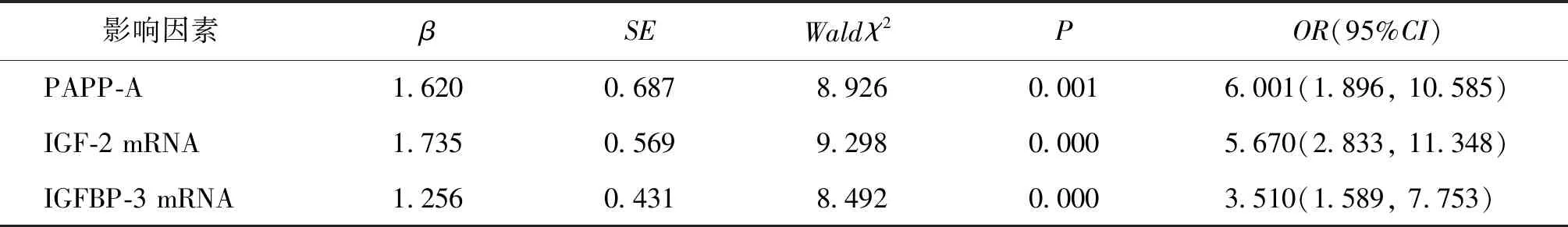
表6 FGR的影响因素的Logistic分析
讨 论
FGR指由于受到各种不利因素的影响,胎儿的生长未能达到潜在应有的遗传速率,是围生期主要并发症之一,给围产儿、新生儿生命健康带来严重威胁[11]。FGR病因复杂,发病机制尚未完全阐明,临床上缺乏对FGR的早期监测指标及有效诊断手段,治疗措施更是较为单一。因此,寻求可靠的生物学指标及早合理监测、准确评估胎儿生长发育情况并选择合适分娩方式,适时终止妊娠对于改善FGR预后有重要意义。
胎盘是妊娠期特有器官,作为胎儿与母体进行营养交换的重要场所,其正常结构、功能发生改变则会对胎儿发育造成直接影响[12]。IGF-2是一种肽类生长因子,其编码基因位于11号染色体短臂,由67个氨基酸组成,属于一种强有丝分裂源,能够与相应受体结合促进细胞有丝分裂及发挥抗凋亡作用,能够调节细胞生长、增殖、分化等生物学行为;人体许多器官组织如胎盘、肝脏均能合成IGF-2。研究表明,IGF-2可以刺激葡萄糖在胎盘的合成及转运,对胎盘功能、胎儿生长发育有重要作用[13]。柴涵婧等[14]研究发现,单绒毛膜双羊膜囊双胎选择性宫内生长受限患者胎盘组织中IGF-2基因表达降低,提示胎盘组织中IGF-2基因异常低表达可能与FGR有关。本研究结果显示,FGR组患者胎盘组织中IGF-2 mRNA表达水平显著低于对照组(P<0.05),两组胎盘组织中IGF-2蛋白均主要存在于组织细胞胞浆中,呈橘黄(褐)色;FGR组患者胎盘组织中IGF-2蛋白阳性表达率显著低于对照组(P<0.05),与以往研究结果趋势一致,提示胎盘组织中IGF-2 mRNA及蛋白异常低表达可能与FGR发生发展关系密切。原因可能是IGF-2基因低表达使胎盘营养转运功能发生障碍,进一步干扰胎儿正常生长,导致胎儿发生宫内生长受限。
IGFBP-3是含有264个氨基酸的多肽类物质,位于7号染色体上,主要由肝脏合成,人子宫内膜、胎盘及胎儿肝脏均可以表达IGFBP-3 mRNA,是IGFs的主要载体调节蛋白,能够与IGFs受体竞争结合IGFs,从而减弱IGFs的生物学作用,如抑制细胞有丝分裂、促进细胞凋亡等,进一步抑制细胞生长、增殖、分化等[15]。谢伟姣[16]研究发现,与正常对照组比较,分娩巨大儿的妊娠期糖尿病产妇胎盘组织中IGFBP-3 mRNA水平明显降低、IGF-2 mRNA水平明显升高,提示二者可能与妊娠期糖尿病巨大儿发生有关。本研究结果显示,FGR组患者胎盘组织中IGFBP-3 mRNA表达水平显著高于对照组(P<0.05),两组胎盘组织中IGFBP-3蛋白主要存在于胎盘组织细胞胞膜及胞浆中,呈棕黄(褐)色;且与对照组比较,FGR组患者胎盘组织中IGFBP-3蛋白阳性表达率显著升高(P<0.05)。与谢伟姣研究结果趋势一致,提示胎盘组织中IGFBP-3 mRNA及蛋白异常高表达可能与FGR发生发展关系密切。原因可能是IGFBP-3蛋白与IGF-2受体竞争性结合IGF-2,从而减弱IGF-2的生物学作用,进一步抑制细胞生长、增殖、分化等,促进FGR发生。进一步相关性研究显示,FGR患者胎盘组织中IGF-2、IGFBP-3蛋白表达成负相关。提示二者可能相互作用并参与FGR的发生发展。
PAPP-A是一种从孕妇血清分离而得的来源于胎盘组织的锌结合金属蛋白酶,是孕妇血清学产前筛查的重要生化指标,由合体滋养层细胞合成分泌,对早期配子发育、维持早期胎盘滋养层细胞浸润分化及胎儿在胎盘生长有关键作用[17]。本研究二元Logistic回归分析显示,孕早期血清PAPP-A水平及胎盘组织中IGF-2 mRNA异常低表达、IGFBP-3 mRNA异常高表达可能与FGR发生显著相关,提示孕早期血清PAPP-A水平及胎盘组织中IGF-2、IGFBP-3 mRNA异常表达可能是FGR发生的重要影响因素,但是否是FGR发生的危险因素有待进一步探究。
综上所述,胎盘组织中IGF-2、IGFBP-3 mRNA异常表达可能在FGR发生发展过程中发挥作用,但具体作用机制及意义有待于后期深入探讨。
