长链非编码RNA SNHG16靶向微小RNA-7-5p对喉癌细胞增殖、迁移、侵袭的影响
2021-03-24何小汶,谭韵
喉癌是临床常见恶性肿瘤之一,随着现代生活节奏的加快,喉癌发病率逐年升高,严重威胁人类生命安全,目前临床采用手术切除联合放化疗等方法治疗喉癌,但缺乏针对喉癌晚期病人的有效治疗方法。因而寻找潜在靶点成为喉癌治疗领域的重点研究问题。近年来,微小RNA(microRNA,miRNA)作为内源性非编码RNA分子,可通过调控下游靶基因表达而参与喉癌等多种肿瘤发生及发展过程,与miRNA相似,长链非编码RNA(Long non-coding RNA,LncRNA)可通过调控基因转录及翻译而参与细胞增殖、凋亡等过程。研究表明LncRNA SNHG16在结肠癌、乳腺癌、口腔鳞癌等多种肿瘤细胞中呈高表达,沉默SNHG16可抑制乳腺癌、口腔癌等肿瘤细胞迁移及侵袭。研究表明miR-7在喉癌中呈低表达,过表达miR-7可通过调控磷脂酰肌醇-3-激酶(phosphoinositide 3-kinase,PI3K)/蛋白激酶B(protein kinase B,AKT)信号通路而抑制肿瘤细胞迁移及侵袭。通过STARBASE软件预测显示miR-7-5p可能是SNHG16的靶基因,因此,本研究主要探讨SNHG16与miR-7-5p的靶向调控关系及其对喉癌细胞增殖、迁移及侵袭的影响,为喉癌基因治疗奠定理论基础。
1 材料与方法
1.1 病例资料与实验细胞
选取2016年1月至2016年12月重庆医科大学附属第三医院收治的25例喉癌病人为研究对象,所有病人均经病理证实为喉鳞状细胞癌,其中男15例,女10例,年龄(67.32±5.62)岁,范围为50~72岁。所有病人术前均未接受放疗或化疗等治疗。所有病人均进行随访(随访截止日期为2019年6月),并统计总体生存期(OS),根据SNHG16、miR-7-5p表达水平分为SNHG16高表达组(18例)、低表达组(7例)与miR-7-5p高表达组(5例)、低表达组(20例),SNHG16高表达组病人生存率(33.33%)显著低于低表达组(71.43%)(P
<0.05);miR-7-5p高表达组病人生存率(60.00%)显著高于低表达组(35.00%)(P
<0.05)。本研究符合《世界医学协会赫尔辛基宣言》相关要求,所有病人知情且签署同意书。所有病人均接受手术治疗,于术中切取喉癌组织及其相应癌旁组织,放入液氮中保存,术后将组织标本转移至-80℃超低温冰箱内保存。喉癌Hep-2细胞购自上海通派生物科技有限公司,Hep-2细胞培养于含有10%胎牛血清及青霉素-链霉素混合溶液的DMEM完全培养基,置于37℃、5%二氧化碳培养箱内培养,待细胞生长密度达到60%~70%时进行传代培养。1.2 材料
转染试剂Lipofectamine2000购自美国Thermo Fisher公司;SNHG16小干扰RNA(si-SNHG16)、miR-7-5p抑制剂(anti-miR-7-5p)及其各自阴性对照均购自上海吉玛;双荧光素酶活性检测试剂盒购自上海翊圣生物;荧光素酶报告基因载体购自美国Promega;3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(MTT)购自美国Sigma;Transwell小室与Mgteigel基质胶购自美国BD;Trizol、反转录及实时荧光定量PCR(qRT-PCR)试剂盒均购自大连宝生物工程有限公司;细胞周期蛋白D1(cyclin D1)、P21、基质金属蛋白酶-2(MMP-2)、上皮钙黏素(E-cadherin)抗体购自美国CST;二抗购自北京中杉金桥生物。1.3 方法
1.3.1
细胞转染及实验分组 收集对数生长期喉癌Hep-2细胞,0.25%胰蛋白酶消化,制备细胞悬浮液,以每孔3×10/mL的密度接种至6孔板,放入37℃、5%二氧化碳培养箱培养,待细胞生长汇合达到50%时进行转染,转染前更换为Opti-MEM减血清培养基,喉癌Hep-2细胞按照随机数字表法分为四组:si-NC组(转染无意义干扰序列si-NC)、si-SNHG16组(转染si-SNHG16)、si-SNHG16+anti-miR-NC组(共转染si-SNHG16与anti-miR-NC)、si-SNHG16+anti-miR-7-5p组(共转染si-SNHG16与anti-miR-7-5p),转染6 h,更换为含有10%胎牛血清的DMEM完全培养液,继续培养48 h,收集转染成功的细胞进行功能验证。1.3.2
qRT-PCR检测细胞中SNHG16、miR-7-5p表达水平 取冻存喉癌及癌旁组织,液氮中研磨,同时收集各组喉癌Hep-2细胞,加入细胞裂解液裂解细胞,分别加入Trizol试剂,依次分别加入200µL氯仿、500µL异丙醇,4℃,12 000 r/min转速离心15 min,提取组织或细胞总RNA,参照反转录试剂盒将总RNA反转录合成互补DNA(cDNA),以cDNA为模板进行qRT-PCR反应,用2法计算SNHG16、miR-7-5p相对表达量。1.3.3
四甲基偶氮唑盐微量酶反应比色法(MTT法)检测细胞增殖 收集对数生长期喉癌Hep-2细胞按照100微升/孔接种于96孔板,分别在培养24 h、48 h、72 h时加入MTT溶液(20微升/孔),继续培养4 h,每孔分别加入150µL二甲基亚砜(DMSO),振荡混匀后应用酶标仪检测490 nm波长处各孔吸光度。每组设置3个复孔,实验设置3次重复。1.3.4
Transwell实验检测细胞迁移及侵袭 细胞侵袭:取100µLMatrigel基质胶稀释液铺于内室,Hep-2细胞(2×10/mL)200µL细胞悬液接种于上室,取500µL含胎牛血清的DMEM培养液加入下室,24 h后多聚甲醛固定15 min,结晶紫溶液染色5 min,显微镜下随机选取10个视野观察侵袭细胞数。细胞迁移:无须加入Matrigel基质胶稀释液,后续实验步骤同侵袭实验。1.3.5
荧光素酶报告基因检测SNHG16、miR-7-5p靶向关系 STARBASE软件预测SNHG16可能结合靶基因,预测结果显示miR-7-5p与SNHG16的3"非翻译区(UTR)存在结合位点,构建SNHG16-3"UTR野生型及其突变型荧光素酶报告载体(WT-SNHG16、MUT-SNHG16),WT-SNHG16、MUT-SNHG16分别与miR-7-5p mimics、miR-NC共转染至喉癌Hep-2细胞,参照荧光素酶活性检测试剂盒测定细胞相对荧光素酶活性。1.3.6
蛋白质印迹法(Western blotting)检测cyclin D1、P21、MMP-2、E-cadherin蛋白表达 提取喉癌Hep-2细胞总蛋白,BCA法测定蛋白浓度,蛋白变性,取30µg蛋白上样,经SDS-PAGE电泳分离蛋白,转膜,封闭1 h,加入蛋白一抗(1∶1 000),4℃孵育过夜,TBAT洗涤,加入二抗(1∶2 000),TBST洗涤,ECL显色,曝光,应用Quantityone软件检测条带灰度值。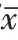
2 结果
2.1 SNHG16、miR
-7
-5p在喉癌组织及癌旁组织中的表达
qRT-PCR检测结果显示,相对于癌旁组织,喉癌组织中SNHG16的表达水平升高,miR-7-5p的表达水平降低(P
<0.05),见表1。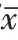
表1 长链非编码RNA SNHG16、miR-7-5p在喉癌组织及癌旁组织中表达/±s
2.2 抑制SNHG16对喉癌细胞Hep
-2增殖的影响
喉癌Hep-2细胞中抑制SNHG16表达后,相对于si-NC组,细胞中SNHG16表达水平降低(P
<0.05),提示转染成功。与si-NC组相比,si-SNHG16组细胞增殖能力降低,cyclin D1蛋白表达水平降低,而P21蛋白表达水平升高(P
<0.05)。见图1、表2。
图1 抑制SNHG16对喉癌细胞Hep-2增殖蛋白表达的影响
2.3 抑制SNHG16对喉癌细胞Hep
-2迁移、侵袭的影响
相对于si-NC组,si-SNHG16组喉癌Hep-2细胞迁移及侵袭细胞数减少(P
<0.05);与si-NC组相比,si-SNHG16组喉癌Hep-2细胞中MMP-2蛋白表达水平降低,而E-cadherin蛋白表达水平升高(P
<0.05),见图2、表3。
图2 抑制长链非编码RNA SNHG16对喉癌细胞Hep-2迁移、侵袭蛋白表达的影响
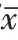
表3 抑制长链非编码RNA SNHG16对喉癌细胞Hep-2迁移、侵袭的影响/±s
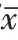
表2 抑制长链非编码RNA SNHG16对喉癌细胞Hep-2增殖的影响/±s
2.4 SNHG16靶向、调控miR
-7
-5p的表达
STARBASE软件预测SNHG16可能调控的miRNA,预测结果显示miR-7-5p可能是SNHG16的靶基因,见图3。双荧光素酶报告实验结果显示,相对于WT-SNHG16、miR-NC共转染组,WT-SNHG16、miR-7-5p mimics共转染组细胞荧光素酶活性降低(P
<0.05);与MUT-SNHG16、miR-NC共转染组相比,MUT-SNHG16、miR-7-5p mimics共转染组细胞荧光素酶活性差异无统计学意义(P
>0.05),见表4。qRT-PCR检测结果显示,与pcDNA3.1组相比,pcDNA3.1-SNHG16组细胞中miR-7-5p表达水平降低[(0.18±0.02)比(0.04±0.01)](P
<0.05);与si-NC组相比,si-SNHG16组细胞中miR-7-5p表达水平升高[(0.19±0.02)比(0.53±0.05)](P
<0.05)(F
=306.118,P
<0.001)。
图3 STARBASE软件预测长链非编码RNA SNHG16可能结合的靶基因——miR-7-5p
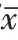
表4 双荧光素酶报告实验检测长链非编码RNA SNHG16与miR-7-5p靶向关系/±s
2.5 抑制miR
-7
-5p表达能逆转抑制SNHG16对喉癌细胞Hep
-2增殖、迁移、侵袭的影响
为探究SNHG16是否可通过调控miR-7-5p而参与喉癌Hep-2细胞增殖、迁移及侵袭过程,结果显示,与si-SNHG16+anti-miR-NC组相比,si-SNHG16+anti-miR-7-5p组喉癌Hep-2细胞中miR-7-5p表达水平降低(P
<0.05),进一步研究显示,喉癌Hep-2细胞中共转染si-SNHG16与anti-miR-7-5p后,相较于si-SNHG16+anti-miR-NC组,细胞增殖能力显著升高,迁移及侵袭细胞数增加(P
<0.05),cyclin D1、MMP-2蛋白表达水平升高,而P21、E-cadherin蛋白表达水平降低(P
<0.05),见图4、表5,表6。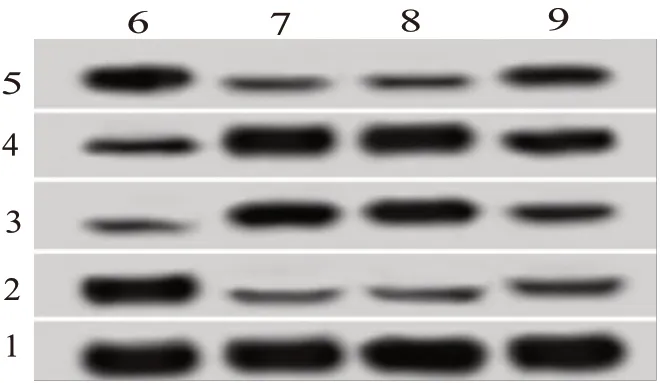
图4 抑制miR-7-5p表达能逆转抑制长链非编码RNA SNHG16对喉癌细胞Hep-2增殖、迁移、侵袭蛋白表达的影响
3 讨论
部分LncRNA可作为喉癌早期诊断及评估病人预后的分子标志物,LncRNA还可能作为肿瘤治疗新靶点。研究表明LncRNA、miRNA异常表达与喉癌细胞增殖、凋亡、迁移及侵袭等生物学行为密切相关。因此本研究通过RNA干扰技术靶向抑制喉癌细胞中SNHG16的表达,检测细胞增殖、迁移及侵袭能力的改变,为揭示SNHG16在喉癌发生及发展中的作用机制提供理论基础。
SNHG16在胃癌组织中呈高表达,其高表达量与病人临床病理特征及预后不良密切相关,进一步研究发现敲低SNHG16表达后,喉癌细胞周期阻滞于G1期,抑制细胞生长。研究表明SNHG16可作为致癌基因,通过竞争性吸附miR-216-5p而调节miR-216-5p/ZEB1信号轴进而促进宫颈癌进展。与上述研究结果相似,本研究结果表明SNHG16在喉癌组织中的表达水平明显升高,喉癌细胞中抑制SNHG16表达后,细胞增殖、迁移及侵袭能力明显降低,说明抑制SNHG16表达可减缓喉癌发展进程。提示SNHG16表达水平升高可能与病人生存期及不良预后密切相关。研究表明细胞过度增殖与细胞周期失控密切相关,细胞周期时间顺序为G1期、S期、G2期、M期,细胞周期相关蛋白可调控细胞周期进程,cyclin D1属于原癌基因,可与周期蛋白依赖性激酶(CDK4)结合形成复合物而促使细胞周期从G0/G1期进入S期,P21可抑制cyclin D1与CDK4结合从而抑制细胞周期进程。本研究结果显示抑制SNHG16表达后,喉癌细胞中cyclin D1表达量降低,P21表达量升高,提示抑制SNHG16表达可通过下调cyclin D1表达及上调P21表达进而抑制喉癌细胞增殖。上皮-间质转化(EMT)可促进肿瘤细胞迁移及侵袭,E-cadherin是细胞上皮标志物,E-cadherin表达下调表明细胞发生EMT进而增强其迁移及侵袭能力,同时MMP-2等基质金属蛋白酶与细胞迁移及侵袭密切相关。本研究结果显示,抑制SNHG16表达后,喉癌细胞中MMP-2表达水平降低,Ecadherin表达水平升高,说明抑制SNHG16可通过下调MMP-2表达及上调E-cadherin表达而抑制喉癌细胞迁移及侵袭。提示SNHG16可能作为喉癌基因治疗的潜在靶点。
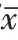
表5 抑制miR-7-5p表达能逆转抑制长链非编码RNA SNHG16对喉癌细胞Hep-2增殖的影响/±s
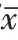
表6 抑制miR-7-5p表达能逆转抑制长链非编码RNA SNHG16对喉癌细胞Hep-2迁移、侵袭的影响/±s
miR-7-5p在乳腺癌细胞中呈低表达,miR-7-5p过表达可通过靶向EGFR而抑制乳腺癌细胞增殖及侵袭能力。miR-7-5p还可抑制膀胱癌发生及发展进程。LncRNA ZFAS1通过靶向miR-7-5p而调控结直肠癌细胞增殖、迁移、侵袭及凋亡过程。本研究结果表明miR-7-5p在喉癌组织中呈低表达,说明miR-7-5p表达降低可能促进喉癌发生。提示miR-7-5p表达水平降低可能与病人生存期及不良预后密切相关。为进一步揭示SNHG16在喉癌中的潜在作用机制,双荧光素酶报告实验与qRT-PCR实验证实SNHG16可负向调控下游靶基因miR-7-5p的表达,同时本研究结果表明抑制miR-7-5p表达可逆转抑制SNHG16对喉癌细胞增殖、迁移、侵袭的抑制作用。提示抑制SNHG16表达可通过上调miR-7-5p表达而降低喉癌细胞增殖、迁移及侵袭能力。
综上所述,喉癌组织中SNHG16呈高表达,而miR-7-5p呈低表达,抑制SNHG16可促进miR-7-5p表达,抑制喉癌细胞增殖、迁移及侵袭,为SNHG16与miR-7-5p确定相互作用位点奠定理论基础,可为喉癌基因治疗提供潜在靶点。但SNHG16在喉癌中的作用是由多种因素共同作用引起的,本研究仅通过体外细胞实验进行初步分析,而体内作用及其相关作用机制仍需深入研究。
