类比推理试误功能在化学教学中的应用
2021-03-24齐蓓蓓吴晓红
齐蓓蓓 吴晓红
摘 要 类比推理作为一种教学手段和学习方法,不仅为科学家提供了发现和发明的灵感,对学生的成长与发展也有一定的促进作用。围绕类比推理的试误功能展开研究,将其与具体的高中化学内容相结合并设计相应的教学案例,激发学生的学习兴趣和内在动力,提高教学效率与学习效率,培养学生化学学科核心素养,促进学生全面发展。
关键词 类比推理;试误功能;化学教学;核心素养;过氧化钠
中图分类号:G632.4 文献标识码:B
文章编号:1671-489X(2021)17-0067-03
0 引言
在化学史中,化学家利用类比推理发现和证实了许多现象和规律。《普通高中化学课程标准(2017年版)》也提到对学生类比思维和能力的培养[1]。除此之外,新高考也开始重视对学生类比推理能力的考查,推测未知物的结构、陌生化学方程式的书写等题型比例逐年增高。
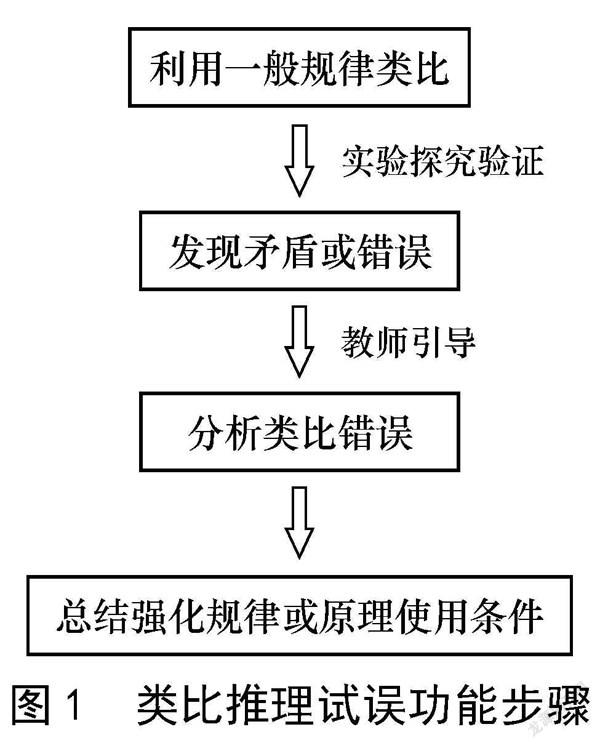
类比推理是指两个或两个以上对象之间虽然存在差异,但在某种程度上,它们之间有着相同的性质或关系,以此为依据,由已知对象的性质或关系来获取未知对象的性质或关系[2]。类比推理功能是指将类比推理的科学方法运用于实际教学中,在教学过程中体现出来的功能与效果。类比推理的试误功能是指将类比推理融入化学教学的试误技能中。试误技能是指教师在教学中修正学生的错误,推动尝试的一类行为。其构成要素有四点:教师推动学生尝试;设置知识陷阱;教师适时纠正学生错误;教师确切评价学习过程。类比推理与试误技能的结合点在于教师引导学生进行错误类比,学生在探究环节发现矛盾、纠正错误,加深对化学概念或反应原理等内容的理解。这种教学方法更加符合新教学理念的要求,能有效提高教师的教学效率和学生的学习效率,促进学生全面发展,但也对教师的专业素养和学生的学习能力提出更高层次的要求。
1 类比推理试误功能的内涵
通过类比推理了解未知对象与类比对象的共性,很容易忽视未知对象的特性,错误地理解或判断未知对象的性质[3]。所以教师在教学中不事先规避强调,而是引导学生误入知识陷阱,继而鼓励他们通过探究发现矛盾,找到错误所在,最后加以改正,从而加深对知识的理解。将类比推理的科学方法融入试误技能,实质是在试误技能的层面更加强调科学的学习方法。以正确的方法作指引,才能凸显试误技能的教学效果。试误功能实则是证伪。教师先设置陷阱和误区,引导学生错误假设,再去亲身验证,在验证的过程中发现错误,反思错误点及出现错误的原因,深刻认识类比对象之间的联系,强化知识的掌握和能力提升,深化对证据推理意识的培养。类比推理试误功能具体步骤见图1。
以Fe和CuSO4溶液反应为例,Fe比Cu活泼,前者可以将后者从它的水溶液中置换出来,即Fe+CuSO4==Cu+FeSO4。教师引导学生依据金属活动性顺序表中排在前面的金属可以将排在后面的金属从它的盐溶液中置换出来的规律类比推理,Na的金属性也强于Cu,类比推理的结论应该是Na 能把Cu从它的水溶液中置换出来。然而实验验证发现,此推理结果并不正确。若Cu能被Na从CuSO4溶液中置换出来,反应现象应该是溶液中有红色固体析出,而不是先有气泡产生,后有蓝色沉淀析出。金属K、Ca、Na投入到可溶性盐溶液中,先是与水发生置换反应生成NaOH,上一步的产物再和盐溶液继续发生复分解反应。因此,要在理解的基础上牢记金属跟盐溶液发生置换反应的三个条件。最后让学生思考:足量的Na投入Al2(SO4)3 溶液中可能发生的离子反应是什么?这样的自主探究过程能够让学生主动发现错误的根源,及时纠正,深层次理解化学反应原理,从而牢固掌握知识。
2 类比推理试误功能的应用
2.1 教学目标分析
2.1.1 核心知识 掌握Na2O2和CO2的反应现象、原理、方程式的书写等;类比掌握SO2和Na2O2的反应现象、原理、方程式的书写等。
2.1.2 核心能力 将试误技能与类比推理相结合,先引导学生错误类比,在自主探究过程中发现错误纠正错误,理解并掌握实质,提高学生灵活运用知识的能力。
2.1.3 核心品质 通过类比书写SO2与Na2O2的化学反应方程式来体验类比推理的思想和方法,并通过错误类比警示学生在化学学习中需要具体问题具体分析。
2.2 教学设计思路
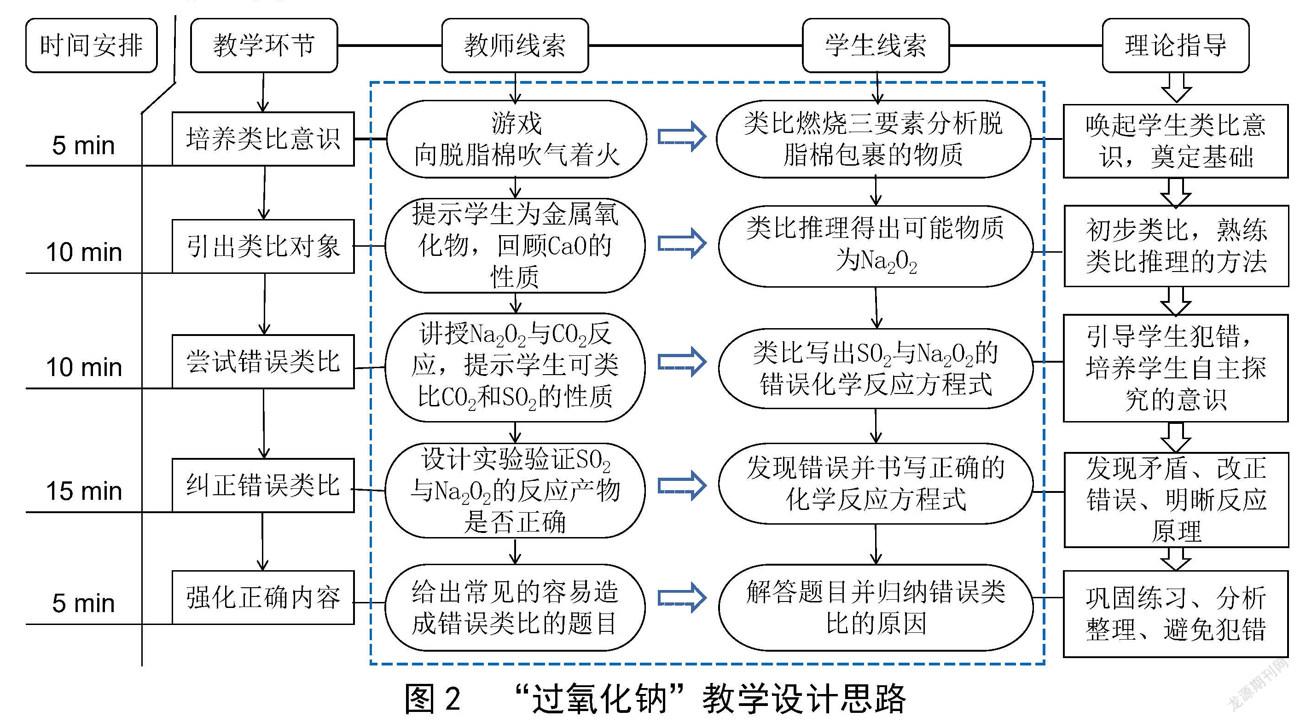
本节内容选自人教版高中《化学(必修1)》第三章第二节第1课时,学生为高一年级学生。以游戏的方式导入课堂,可以激发学生兴趣,通过分析可燃物初步培养学生的类比意识。在教师引导下,学生回顾CaO的性质,类比推理学习Na2O和Na2O2的化学性质。为了将试误技能与类比推理结合教学,教师引导学生类比CO2和Na2O2的化学反应方程式,推理书写SO2和Na2O2的化学反应方程式。学生惯性思维犯错,教师鼓励学生通过实验探究验证SO2和Na2O2的反应产物是否与预测产物一致。學生在自主探究过程中发现错误、纠正错误,有利于加深对反应原理的理解和掌握,并培养自主探究的意识和能力。教师再用考试中常见的类似试题做检测,引导学生运用类比推理的方法解决、总结、归纳,避免犯错。
以上环节可帮助学生理解知识内涵,而非停留在知识表面,教师教学的重点应该集中在培养学生自主探究意识和能力。具体教学思路见图2。
2.3 教学活动过程
环节一:培养类比意识
【游戏导入】取两份完全一样的脱脂棉,第一份不作任何处理,第二份包裹一种不知名的物质。将两份脱脂棉分别置于石棉网上,用一根塑料管缓慢连续地分别向脱脂棉吹气,第一份脱脂棉无现象,第二份脱脂棉剧烈燃烧。
教师提问:“此现象能说明什么问题?”
学生回答:“第二份脱脂棉中有可燃物,达到了着火点且有助燃剂。”
教师追问:“请同学们思考可燃物是什么?助燃剂是什么?达到着火点又说明了什么呢?”
【引导分析】人体呼出的气体主要成分是CO2,说明第二份脱脂棉中的未知物能与CO2发生反应,该反应放热,而且能够生成O2。教师提示:这种未知物是一种金属氧化物。
环节二:引出类比对象
继续追问:“请同学们回忆学过的哪种金属氧化物能与CO2发生反应呢?”
【旧知回顾】CaO+CO2==CaCO3。
教师分析:“CaO是一种常见的金属氧化物,初中就学习过,它能与CO2发生反应放出热量。但细心的同学会发现,此反应并未生成O2。显然,这种未知物并不是CaO。”
【启发类比】在物质分类课中学过,物质组成相似则性质相似。钙是常见的金属单质,除钙以外,钠也是常见金属。那未知物会不会是Na2O呢?
学生类比:“Na2O+CO2==Na2CO3。”
【实验演示】此反应能够发生,但并不生成O2。
自然过渡:“老师给大家介绍一种特殊的氧化物——过氧化钠,它的化学式是Na2O2。细心的同学可以发现它与Na2O的不同之处在于它比Na2O多了一个氧原子。我们通过实验来验证Na2O2是不是未知物。”
【实验演示】在脱脂棉中包裹适量的Na2O2粉末,置于石棉网上,用一根塑料管缓慢连续地向脱脂棉吹气,脱脂棉剧烈燃烧了。
【探究总结】2Na2O2+2CO2==2Na2CO3+O2。
环节三:尝试错误类比
自然过渡:“我们类比了Na2O和CaO的性质,其实化学中像这样的类比很多,如初中我们学习了CO2,知道它是一种酸性气体;高中我们又接触到了SO2。通过观察可以发现SO2和CO2在组成上很相似,且都属于酸性氧化物,满足酸性氧化物的通性。”
引导犯错:“CO2能和Na2O2发生以上反应,通过类比,我们推测SO2应该也可以发生类似反应。请同学们尝试写出SO2与Na2O2的化学反应方程式。”
学生作答:“2Na2O2+2SO2==2Na2SO3+O2。”
教师分析:“下面我们通过实验来验证一下SO2和Na2O2
的反应是否和我们推测的一致。”
【实验验证】将SO2气体通入盛有Na2O2的试管中,用带火星的小木条在试管口检验是否有O2产生,观察实验现象。
【分析现象】通过实验发现SO2和Na2O2反应并没有生成O2。那另一种产物是不是也不相同呢?
【检验产物】用HNO3酸化过的AgNO3溶液检验产物。
【结果分析】有白色且不溶于硝酸的沉淀生成,说明产物中并不是亚硫酸根,而是硫酸根。
教师提问:“难道是类比过程出问题了?”
教师启发:“SO2中的硫显+4价,硫酸根中的硫显示+6价,显然,反应前后硫元素的化合价升高,被氧化,Na2O2做氧化剂,具有强氧化性。
环节四:纠正错误类比
学生纠误:“具有还原性的SO2与具有强氧化性的Na2O2 会发生氧化还原反应,故反应产物是Na2SO4,而不是推测的Na2SO3,即SO2+Na2O2==Na2SO4。”
教师总结:“并不是结构相似、性质相似的物质就能够类比,类比过程中还应该注意反应物中是否有强氧化性或强还原性物质,这类物质易发生氧化还原反应,影响类比推理的结果。”
环节五:练习强化正确内容
总结归纳:“习题中经常碰到这种书写方程式的陷阱,请同学们课下查阅归纳整理:哪些反应容易从氧化还原的角度在类比过程中设置障碍?我们下节课一起来查漏补缺、整理成册,避免以后犯错。”
2.4 教学反思
类比推理的试误功能符合新的教育理念,即培养学生自主探究的思维与能力。通过实践发现,类比推理的试误功能可以帮助学生克服惯性思维,有效避免考卷中所设的陷阱。并且在教师引导学生犯错又改错的过程中,学生的探究精神和本能也被激发,这不论是对于学生以后的学习还是素养的培养,都具有重要的意义。
3 結语
本文通过对类比推理试误功能的分析说明类比推理在化学教学实践中发挥着重要作用。利用类比推理在新旧知识间建立联系,能够化抽象为形象、化枯燥为生动、化陌生为熟悉,促进学生正确建构科学概念,提高教学效率[4]。而将类比推理这种科学方法巧妙地与试误功能相结合,是一种很新颖的教学策略。首先,它能够有效激发学生的学习兴趣和热情;其次,学生在教师引导下进行错误类比,并通过自主探究验证,此过程可以培养自主探究的意识与能力;最后,学生在教师的讲授中纠正错误,获取新知识,进一步理解化学概念或反应原理。
参考文献
[1]中华人民共和国教育部.普通高中化学课程标准(2017年版)[S].北京:人民教育出版社,2018:2,89.
[2]刘宗寅,吕志清著.化学发现的艺术:化学探索中的智慧聚合[M].山东:中国海洋大学出版社,2002,449-488.
[3]许建华,吴文中.探究镁、铝与氯化铜溶液反应差异性[J].中学化学教学参考,2020(19):39-42.
[4]周建秋.点化策略:一种促进学生有效学习的方法[J].现代中小学教育,2016,32(1):57-59.
