微生物降解污染地下水中三氯乙烯的微宇宙试验研究
2021-03-23孙仲平吴乃瑾杨苏才魏文侠宋云
孙仲平,吴乃瑾,杨苏才,魏文侠,宋云
轻工业环境保护研究所,工业场地污染与修复北京市重点实验室
三氯乙烯(TCE)作为工业溶剂、脱脂剂和电子零件清洁剂,在生产和生活过程中得到了广泛应用。由于不合理的处理或处置,导致TCE进入土壤和地下水,其毒性和难降解性对人体健康和生态环境造成持续的风险[1],我国在2018年实行的GBT 14848—2017《地下水质量标准》中新增了多种挥发性氯代烃污染限值,Ⅲ类水质TCE限值为70 μgL。针对环境健康风险和污染现状,亟需开展对TCE污染地下水的治理研究。
目前,TCE的修复包括物理、化学和生物等技术,其中,原位生物修复技术最为经济有效,且应用最广,在适宜的环境中能将TCE彻底矿化为CO2和环境可接受的水溶性物质,因此该技术已成为研究热点[2-3]。国外研究证明[4-5],在含水层的缺氧、厌氧条件下,TCE可作为电子受体通过微生物介导发生脱氯降解,并分离出多种能降解氯代烃的功能微生物,如Desulfitobacteriumsp.、Sulfurospirillumsp.、Dehalobactersp.、Dehalococcoides等多种菌属[6-10]。Dehalococcoides是目前报道的重要脱氯菌,属于绿弯菌门,科研工作者陆续分离得到对不同结构氯代乙烯有降解能力的脱卤拟球菌属的菌株[4,11-12]。
大量研究表明,氢解和二氯消除是TCE降解的主导过程[13-14],而TCE在地下水缺氧环境中的生物降解则主要通过氢解作用逐步脱氯,依次生成二氯乙烯(DCE)、氯乙烯(VC)和乙烯(ETH)等产物[15-16]。从应用现状来看,微生物和电子供体条件是制约原位生物修复技术实施的重要因素。实际修复工程中常采用添加菌种进行生物强化或添加电子供体进行生物刺激来缩短生物降解的周期,前者在实际应用中成本较高,且一般发现氯代烃污染的场地成分比较复杂,菌种投放在污染场地后很可能由于不能适应多变的环境而被土著微生物竞争取代[17-18]。笔者从北京市某氯代烃实际污染场地采集含水层沉积物及地下水,利用微宇宙试验体系,在厌氧条件下分别研究添加不同浓度的醋酸钠、乳酸钠、乳酸对地下水中TCE去除效果的影响,结合各厌氧体系内中间产物的分析和微生物多样性的变化对反应机理进行阐述,以期为国内TCE污染地下水原位生物修复提供技术支撑。
1 材料与方法
1.1 试验材料
试验所用醋酸钠、乳酸钠、乳酸均为分析纯,TCE为色谱纯(国药集团化学试剂有限公司)。试验所用地下水和沉积物取自北京市某化工厂的氯代烃污染场地(取样深度约为-15 m),利用哈希Hydrolab多参数水质分析仪测定地下水溶解氧浓度、pH、氧化还原电位(ORP)、电导率,污染地下水初始pH为7.18,电导率为1 608 Scm,ORP为163.2 mV,溶解氧浓度为4.97 mgL。
1.2 试验设计
采用微宇宙试验体系模拟研究地下水环境中TCE的生物降解规律[20],从北京市某化工厂的氯代烃污染区采集地下水和含水层沉积物,在100 mL血清瓶中盛装6 g过2 mm筛的沉积物和60 mL地下水,随后置于手套箱中,开启真空泵至压力表稳定在-0.1 MPa 保持1 h左右(抽真空完成),然后填充氮气至箱内使气压稍高于外界气压,反复3次,分别配置成含有10 mgL TCE的污染物体系,并用含聚四氟乙烯垫片的盖子密封后混匀。TCE厌氧微宇宙试验周期为30 d,将含不同组分(表1)样品瓶放入恒温振荡摇床〔60 rmin,(25.0±0.5)℃〕数日,取上清液测定目标污染物残留浓度,定期取1 mL培养瓶顶空相气体检测乙烷、乙烯、氯乙烷、氯乙烯的浓度,并在试验进行过程中同时监测各反应体系的pH和ORP。每组设置2个平行。
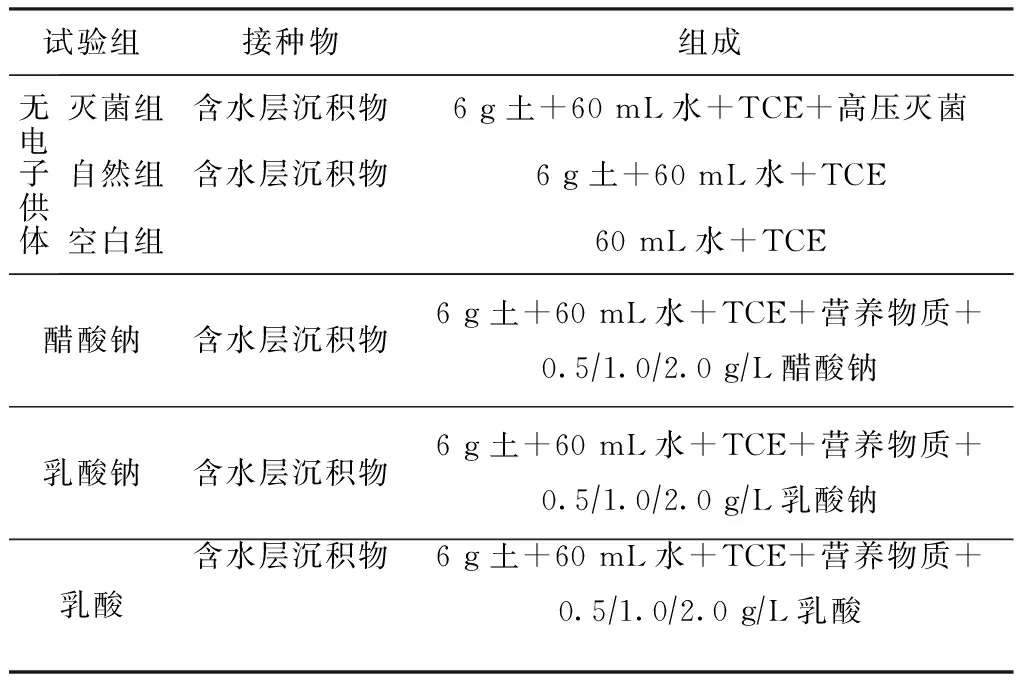
表1 厌氧微宇宙试验组成
1.3 分析方法
采用吹扫捕集-气相色谱-质谱(Agilent,GC7890B、MSD5977A,美国)测定水中TCE浓度,色谱柱参数为DB-624 column (Agilent,60 m×250 μm×1.4 μm,-20~260 ℃)。柱箱温度为40 ℃,检测器温度为260 ℃,保留时间为19 min,分流比为20∶1。
利用气相色谱(Agilent GC7890B,美国)分析微宇宙体系中的气体成分。色谱柱参数为HP-PLOT/Q column (Agilent,30 m×320 μm×20 μm,-60~270 ℃),前进样口温度为220 ℃,隔垫吹扫流量为3 mL/min,分流比为20∶1,柱箱温度为40 ℃,FID检测器温度为200 ℃,保留时间为15 min,尾气吹扫流量为30 mL/min。
微生物多样性是基于Illumina HiSeq测序平台,利用双末端测序的方法,构建小片段文库进行测序。通过对Reads拼接过滤,OTUs(operational taxonomic units)聚类,并进行物种注释及丰度分析,可以揭示样品的物种构成。同时利用实时荧光定量分析对总细菌和功能基因数量进行测定。
TCE降解率(η)的计算公式如下:
η=[(C0-C)/C0]×100%
(1)
式中:C为TCE在反应过程中的浓度,mg/L;C0为TCE的初始浓度,即10 mg/L。
对TCE降解进行反应动力学分析,公式如下:
ln(C/C0)=-kt
(2)
式中:k为反应速率常数,d-1;t为反应时间,d。
2 结果与讨论
2.1 不同电子供体刺激下TCE的降解效果
2.1.1无电子供体
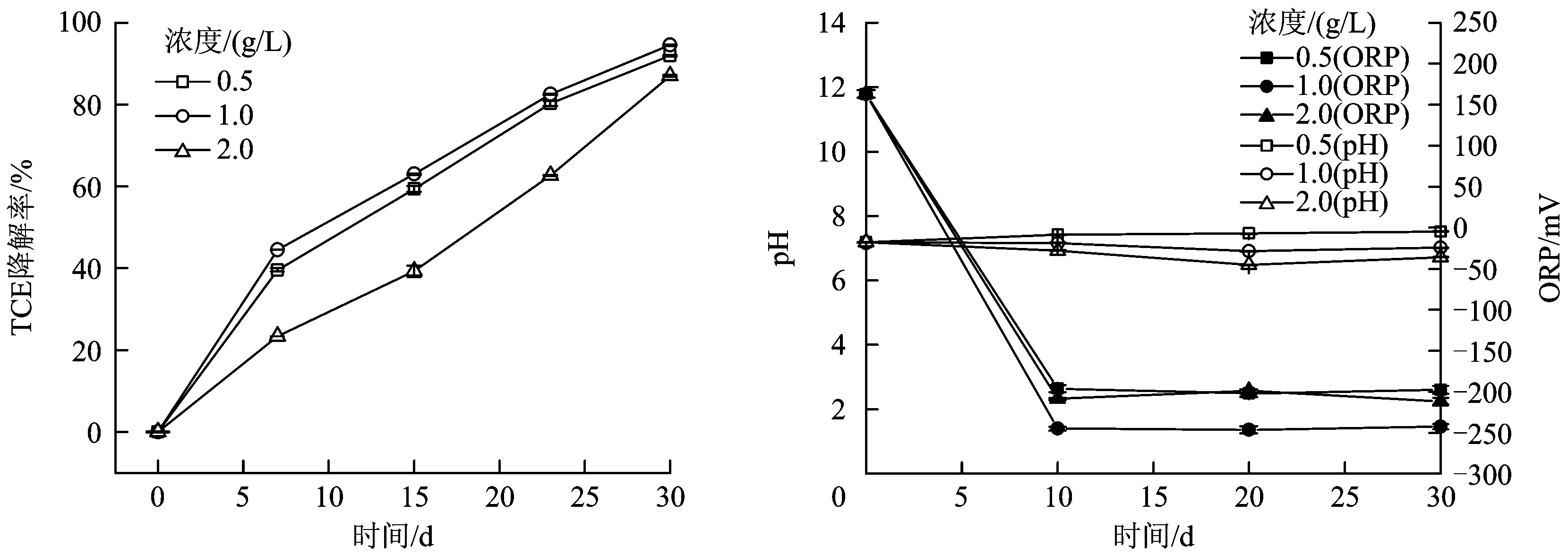
图3 投加不同浓度醋酸钠后TCE降解率、pH和ORP的变化Fig.3 Effects of sodium acetate concentration on the degradation rate of TCE,pH and ORP
为考察未添加电子供体时TCE的降解状况,设置了空白组、自然组、灭菌组,反应体系内TCE相对浓度随时间变化如图1所示。由图1可见,在自然组、灭菌组和空白组中,TCE浓度变化不大,因此,在后续的试验中,因挥发或吸附等因素造成的损失可以忽略。
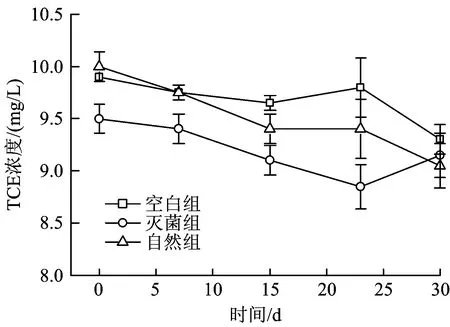
图1 厌氧条件下TCE浓度变化Fig.1 Variation of TCE concentration under anaerobic conditions
地下水理化参数是影响微生物活性的重要因素。研究表明,厌氧条件下氯代烃发生还原脱氯最适pH为6.8~7.5,且微生物降解氯代烃会在一定的ORP下有次序地进行[13,21],并以甲烷产生和硫酸盐还原过程(-300~-100 mV)占优势,在较强还原环境时还会发生β-消除反应。TCE降解过程中反应体系的pH和ORP的监测值如图2所示。从图2可以看出,整个试验过程中各组pH一直保持在6~8,而ORP为100~300 mV,未实现理想的还原环境,从而导致目标污染物未发生显著降解。

图2 TCE降解过程中pH和ORP监测值Fig.2 pH and ORP monitoring values during degradation of TCE
2.1.2醋酸钠为电子供体
以0.5、1.0、2.0 g/L醋酸钠为电子供体时TCE的降解情况和各组pH、ORP监测值如图3所示。
由图3(a)可见,3组微宇宙试验体系中TCE均发生明显降解,结合未添加电子供体组(空白组、自然组、灭菌组)的情况可以判断,TCE降解的主要过程为微生物降解,这是由于加入了营养物质和电子供体,有效刺激了微生物生长。
从图3(b)可以看出,整个试验过程中各组pH始终保持在6.5~7.2,ORP均值为-300~-100 mV,均达到厌氧环境,有利于厌氧微生物的生存和代谢,从而导致TCT产生降解。该组试验中随醋酸钠浓度升高,TCE降解率先增大后减小,在反应30 d后,1.0 g/L醋酸钠下TCE降解率最高,可达到94.5%;0.5 g/L醋酸钠下TCE降解率为91.9%;2.0 g/L醋酸钠下TCE降解率最低,为87.0%。这可能是因为随着醋酸钠浓度升高,参与脱氯降解的微生物代谢活动逐渐增强,但醋酸钠浓度过高反而抑制了微生物活性,故本组试验中1.0 g/L为醋酸钠最适宜投加量。
2.1.3乳酸钠为电子供体
以0.5、1.0、2.0 g/L乳酸钠为电子供体时TCE的降解情况和各组pH、ORP监测值如图4所示。由图4可见,3组微宇宙试验体系中TCE均发生明显降解,整个试验过程中各组pH始终保持在6.5~7.2,ORP均值为-300~-100 mV,均达到厌氧环境,有利于厌氧微生物的生存和代谢,从而导致TCE产生降解。随着乳酸钠浓度升高,TCE降解率先增大后减小,其中,在反应30 d后,1.0 g/L乳酸钠下TCE降解率最高,可达到91.4%;0.5 g/L乳酸钠下TCE降解率次之,为87.1%;2.0 g/L乳酸钠下TCE降解率最低为83.1%。这可能是因为随着乳酸钠浓度升高,参与脱氯降解的微生物代谢活动逐渐增强,但乳酸钠浓度过高反而抑制了微生物活性,故本组试验中1.0 g/L为乳酸钠最适宜投加量。
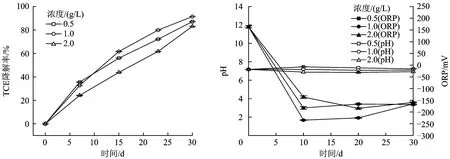
图4 投加不同浓度乳酸钠后TCE降解率、pH和ORP变化Fig.4 Effects of sodium lactate concentration on the degradation rate of TCE,pH and ORP
2.1.4乳酸为电子供体
以0.5、1.0、2.0 g/L乳酸为电子供体时TCE的降解情况和各组pH、ORP监测值如图5所示。由图5可见,3组微宇宙试验体系中TCE均发生明显降解,整个试验过程中0.5、1.0 g/L试验组pH始终保持在6.5~7.2,2.0 g/L试验组pH最终降至6.1,一定程度上不利于厌氧微生物生长代谢;各组ORP均值为-200~-100 mV,均达到厌氧环境,有利于厌氧微生物的生存和代谢。
随着乳酸浓度的升高,TCE降解率先增大后减小,在反应30 d后,1.0 g/L乳酸下TCE降解率最高,达74.0%;0.5 g/L乳酸下其降解率次之,为67.4%;2.0 g/L乳酸下TCE降解率最低,为62.2%。这可能是因为随着乳酸浓度升高,参与脱氯降解的微生物代谢活动逐渐增强,但乳酸浓度过高反而抑制了微生物活性,故本组试验中1.0 g/L为乳酸最适宜投加量。
对比以上结果,该试验条件下,各组电子供体的适宜添加量为1.0 g/L,此时TCE的降解率从高到低依次为醋酸钠>乳酸钠>乳酸,因此选用1.0 g/L醋酸钠为最适电子供体。
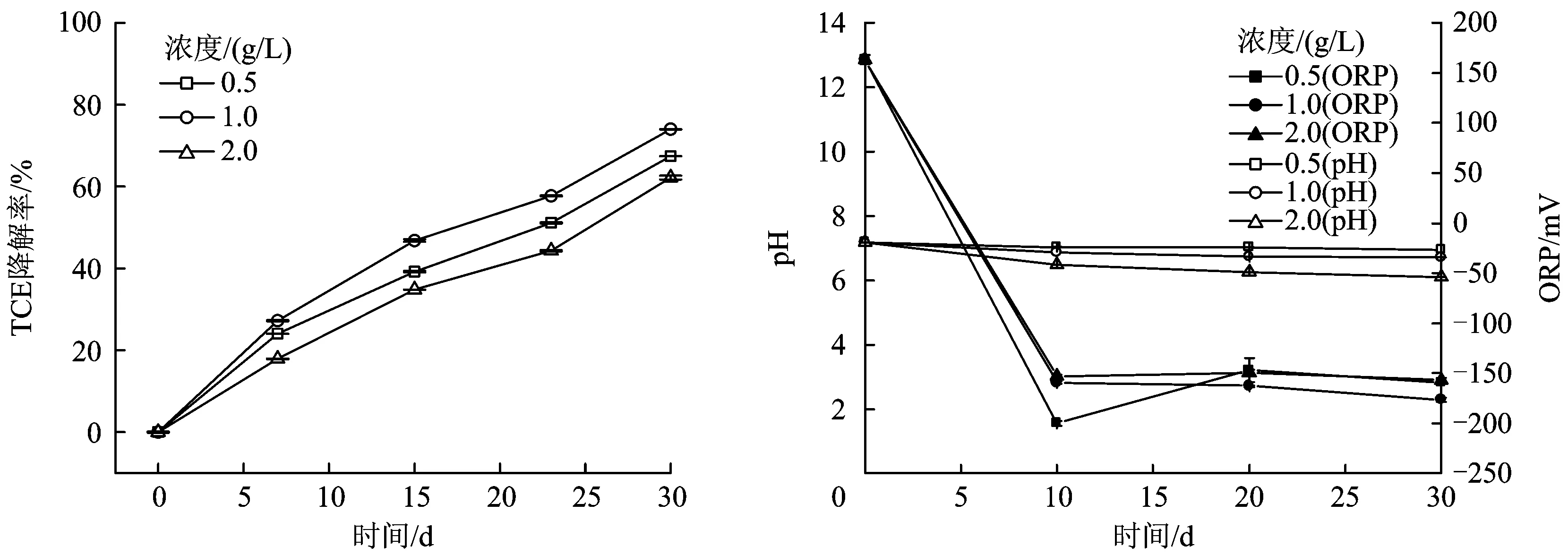
图5 投加不同浓度乳酸后TCE降解率、pH和ORP变化Fig.5 Effects of lactic acid concentration on the degradation rate of TCE,pH and ORP
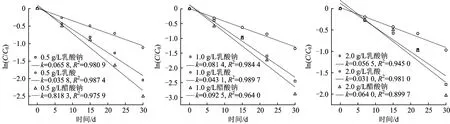
图6 投加不同电子供体后TCE降解的拟合曲线Fig.6 Fitting curve of TCE degradation of adding different electron donors
2.2 动力学分析
图6为醋酸钠、乳酸钠、乳酸3种电子供体在3种浓度投加情况下TCE降解的ln(C/C0)-t拟合曲线。由图6可知,不同种类电子供体对TCE降解反应的ln(C/C0)与t均呈现较好的线性关系,1.0 g/L醋酸钠试验组中TCE脱氯降解反应速率常数最高,为0.092 5 d-1,这3种电子供体刺激下TCE的反应速率常数的大小依次为1.0 g/L醋酸钠>0.5 g/L醋酸钠>1.0 g/L乳酸钠>0.5 g/L乳酸钠>2.0 g/L醋酸钠>2.0 g/L乳酸钠>1.0 g/L乳酸>0.5 g/L乳酸>2.0 g/L乳酸,进一步表明在这3种电子供体中,1.0 g/L醋酸钠是最适电子供体。
2.3 降解产物分析
厌氧条件下,TCE的降解主要通过还原作用完成,包括氢解作用和二氯消除作用,但大部分研究指出,TCE在地下水缺氧环境中主要发生氢解作用即还原脱氯[15,23],依次生成DCE、VC和ETH等产物,降解路径见图7。

图7 TCE的厌氧还原脱氯过程示意Fig.7 Pathways of anaerobic reductive dechlorination of chlorinated ethylene
在对厌氧反应降解中间产物的气相取样分析中,并未检测到VC和乙烯的产生,在液相取样分析中分别取样检测了反应体系可能产生的反式-1,2-二氯乙烯 (trans-1,2-DCE)、顺式1,2-二氯乙烯(cis-1,2-DCE)、1,1-二氯乙烯(1,1-DCE)的产生情况,待分析中间产物只在反应第30天检测到了cis-1,2-DCE的产生,其浓度如图8所示。结合文献和试验结果可以判断,该试验中TCE微生物厌氧脱氯反应产生了cis-1,2-DCE,说明TCE降解发生了氢解反应。在这个还原脱卤过程中,理论上讲DCE的3种同分异构体都可能产生,然而Bouwer等[24]的研究表明,生物降解过程中cis-1,2-DCE作为中间产物要比trans-1,2-DCE常见,1,1-DCE是3种异构体中出现概率最低的子产物,这与本试验未检测到trans-1,2-DCE和1,1-DCE的现象相符。
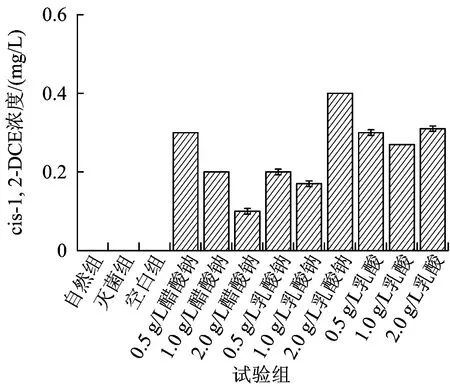
图8 第30天微宇宙试验体系降解产物分析Fig.8 Analysis of degradation products in microcosms on the 30st day
试验第30天未检测到ETH和VC,虽然已有研究表明,在地下水厌氧环境中,TCE能彻底还原脱氯成ETH或乙烷[17,25],但是氯代烃的厌氧还原脱卤过程是按照一定顺序发生的,其中TCE转化为DEC过程较快,cis-DCE转化为VC最终至ETH或乙烷的生成速率较慢。Pant等[16]发现厌氧条件下氯代乙烯能还原脱氯成无毒ETH,其中VC转化为ETH耗时最长,这可能是本组试验未检测到VC和ETH的原因。也有研究表明[26-27],TCE脱氯不完全主要因为能将TCE彻底还原脱氯的Dehalococcoides菌种并非普遍存在,即使存在,其种类、数量及其他菌种的影响等都可能造成该菌种无法充分发挥作用。
2.4 微生物多样性及定量分析
为进一步分析不同处理条件下微宇宙体系内微生物多样性的变化规律,分别在反应前中后期分析监测了1.0 g/L醋酸钠样品中微生物多样性,第0天、第15天和第30天样品分别记为UNt0、TCE15、TCE30。
2.4.1微生物门水平相对丰度变化
3组样品门水平物种相对丰度见图9。从图9可以看到,第0天未处理样本中优势菌门为Proteobacteria(变形菌门,84.9%)、Bacteroidetes(拟杆菌门,8.7%)、Actinobacteria(酸杆菌门,2.5%)等,TCE15样本中优势菌门为Proteobacteria(66.1%)、Firmicutes(厚壁菌门,22.1%)、Bacteroidetes(11.1%),TCE30样本中优势菌门为Proteobacteria(49.8%)、Firmicutes(47.9%)、Bacteroidetes(0.6%)。大量研究表明,变形菌门和厚壁菌门为潜在高效脱氯微生物[28-30]。
由图9可见,厚壁菌门相对丰度随时间推移而增大,变形菌门相对丰度随时间推移减小,但最终相对丰度仍高于20%。厚壁菌门和拟杆菌门多为严格的厌氧和兼性细菌,即厌氧菌的相对丰度随时间推移增大,这说明随着反应的进行,微宇宙体系内潜在高效降解菌均为优势菌门,且厌氧微生物生长状况良好,表明TCE的降解与优势菌群的生长有着密切的联系。微生物门水平数据显示,有少量的绿弯菌门微生物生长(未列出),而该类细菌也是潜在高效脱氯微生物Dehalococcoides所属菌门[4,31],该类微生物也有可能与污染物的降解有密切关系。
2.4.2微生物属水平相对丰度变化
对高效潜在氯代烃降解细菌进行更细致的分类,样品在属水平上的物种相对丰度见图10。由图10可知,在样品中均发现了Desulfitobacterium,研究发现Desulfitobacterium属于厚壁菌门,其中的Desulfitobacteriumdehalogenans、Desulfitobacteriumstrain PCE1和Desulfitobacteriumstrain PCE-S具有转化含氯烯烃的能力[28],这与在TCE降解微宇宙试验中污染物的降解现象相符,反应过程中Desulfitobacterium属相对丰度有显著增加,说明本试验中微宇宙体系的条件有效刺激了该菌属的生长。此外还检测到了可能与脱氯过程相关的微生物,包括地杆菌属(Geobacter),有研究表明其可负责PCE或TCE降解至cis-1,2-DCE,Geobacterlovleyisp. nov. strain SZ是一种在醋酸盐存在情况下,一种能够以TCE作为电子受体进行还原脱氯的菌,其还原终产物为cis-1,2-DCE,此外该类菌还可起到铁还原的作用[29,32]。
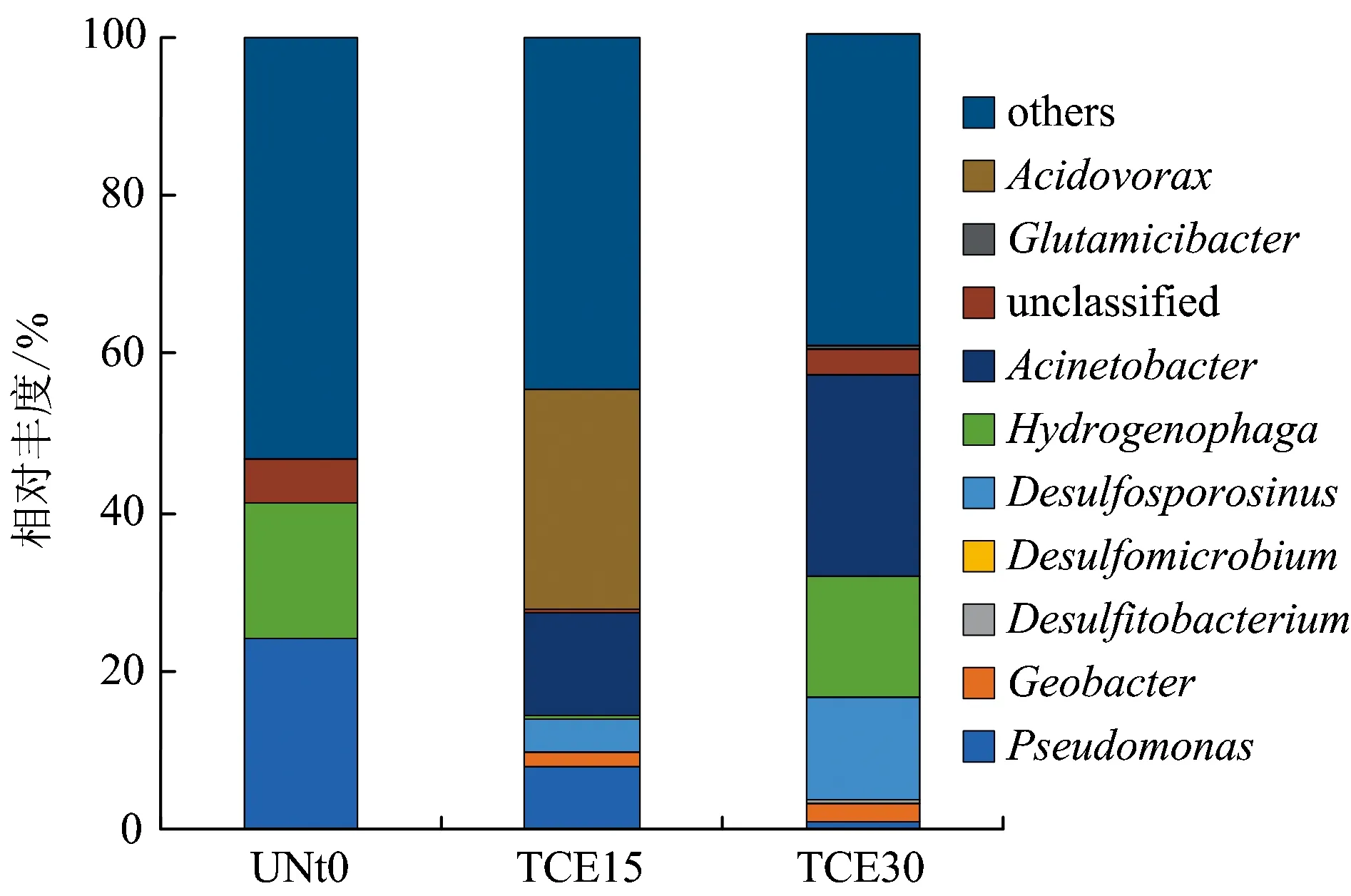
图10 土壤样品中不同细菌类群(属水平)的相对丰度Fig.10 Relative abundances of bacterial groups (genus) in the soil samples
2.4.3基因定量分析
脱卤拟球菌已在大量研究中被证实可实现氯代烃的脱氯降解[5,12,33-35],且有包括pceA、tceA、vcrA和bvcA等功能基因的定量分析,这些基因相应的脱卤酶催化不同的Dehalococcoides对氯代烃的降解。本研究各样本中均检测到了较高的tceA含量。总细菌和tceA检测结果如表2所示。

表2 样品中总细菌和tceA定量结果
从表2可以看出,随着反应的进行,各组样品的总细菌拷贝数显著增加,相较于第0天未处理样品的2.08×105mL-1,总细菌拷贝数增长4个数量级,这是由于各试验组中添加了充足的电子供体及营养物质,促使微生物大量生长繁殖。样品TCE15总细菌拷贝数最高,为6.90×109mL-1,TCE30降至1.76×109mL-1,可能是因为反应前期为微生物快速增长期,随着电子供体以及营养物质的消耗,微生物数目会出现先增多后减少的情况。
从表2可以看到,在本试验反应周期内,各组样品均保持较高的tceA,功能基因水平(水样中拷贝数可达106~107L-1),这也表明各组样本中均有Dehalococcoides的生长繁殖。研究表明[30,36-37],tceA所编码的还原脱氯酶主要催化TCE逐步脱氯直至VC的降解过程,表明本试验中TCE的微生物降解可能是在功能基因tceA的作用下进行的。但对TCE降解产物的分析中并未检测到VC。有研究表明[38],DCE脱氯到VC的降解过程是比较缓慢的,这可能是该周期内VC未检出的主要原因。
3 结论
(1)厌氧条件下,对于同种电子供体而言,3组投加量(0.5、1.0、2.0 g/L)时TCE的降解率均先增大后减小,第30 天时,添加1.0 g/L醋酸钠的反应体系中TCE的去除率最高,可达94.5%;添加1.0 g/L的乳酸钠和乳酸的反应体系次之,分别为91.4%和74.0%。此外,添加醋酸钠的试验体系可长时间维持中性pH及较低的氧化还原电位。
(2)反应中间产物仅检测到cis-1,2-DCE,推测该试验条件下TCE生物降解的主要机制为氢解反应。
(3)微宇宙体系内,各样品门水平上优势菌门均含有Proteobacteria、Firmicutes,为TCE的潜在高效降解菌。基因定量分析显示,各反应体系中细菌总量大大增长,且各样本均检测到较高水平的功能基因tceA(水样中拷贝数可达106~107L-1),推测TCE的降解可能是在功能基因tceA的作用下进行的。
