发物对接触性皮炎模型大鼠的影响
2021-03-23汪一晗邢凤玲傅宏阳岑璐莎杨晓红曹毅
汪一晗 邢凤玲 傅宏阳 岑璐莎 杨晓红 曹毅
1.浙江中医药大学第一临床医学院 杭州 310053 2.浙江省中医院
接触性皮炎(contact dermatitis,CD)是一种常见的炎症性皮肤疾病,通常由接触致敏物或刺激物引起[1]。近年来饮食对于皮肤疾病的影响越来越受到重视,但仍少有文献报道饮食对CD的影响。此病因接触物不同而有不同的中医病名,如接触油漆者为漆疮、接触膏药者为膏药风等。在中医理论中,此病多由过食肥甘,脾胃积湿生热,湿热内搏,凑于皮肤;又受风邪,不得宣通而出现[2]。牛羊肉是常见的“发物”,味甘性温,被认为忌用于胃肠湿热证患者,且会加重疮疡肿物[3]。本研究通过观察牛羊肉对胃肠湿热证CD模型大鼠皮损及血清中相关炎症因子的影响,探究发物对CD的影响,从而为临床上指导患者饮食宜忌提供实验依据。
1 材料和方法
1.1 实验动物 无特定病原体(specific pathogen free,SPF)级雄性SD大鼠25只,体质量180~220g,由浙江中医药大学动物实验中心提供,饲养和实验均在浙江中医药大学动物实验中心进行[实验动物使用许可证号码:SYXK(浙)2018-0012]。饲养室温21~23℃,湿度30%~40%,光照12h明暗交替,大鼠自由进食饮水,每日更换无菌干燥垫料。所有实验均严格按照动物实验伦理委员会制定的动物福利和伦理标准操作。
1.2 主要试剂 玛贝拉脱毛膏购于广州诺菲化妆品有限公司(规格:50g/支,国妆特字:G20100663);3%戊巴比妥溶液购于美国Sigma-aldrich公司(批号:P3761);苏木精(hematoxylin,H)购于上海展云化工有限公司(批号:0712059);伊红(eosin,E)购于国药集团化学试剂有限公司(批号:20140818);大鼠白细胞介素-35(interleukin-35,IL-35)酶联免疫吸附检测(enzyme linked immunosorbent assay,ELISA) 试 剂盒、大鼠肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)ELISA试剂盒均购于酶免公司(批号:MM-0856R2、MM-0180R2);Notch1抗体购于Cell Signaling Technology(CST)公司(批号:3608S)。
肥甘饲料:由普通饲料60%、10%植物油、10%鸡蛋、10%黄油、7%奶粉、3%白糖组成,另加200g·L-1蜂蜜(冠生园集团有限公司产品)、红星二锅头(体积百分比:50%vol,北京红星股份有限公司产品)。牛肉/羊肉饲料:在肥甘饲料基础上加15%的牛肉或羊肉。
1.3 主要仪器 HEINE mini 3000R型皮肤镜购于德国HEINE医疗器械公司;BX50型电子显微镜为日本Olympus公司产品。
1.4 方法
1.4.1 制备胃肠湿热模型 所有大鼠以标准饲料饲养1周后,随机分为牛肉组、羊肉组、胃肠湿热组、模型对照组、空白组,每组各5只。参照吕冠华等[4]的方法用饮食干预制备胃肠湿热模型,除空白组和模型对照组大鼠予常规饲料喂养外,其余3组大鼠均予肥甘饲料饲喂,饲喂次数等同于大鼠正常进食次数。食物干预21d后,参照任玺等[5]的方法,对大鼠一般情况、饮食、二便及肛温进行评估,判断胃肠湿热模型是否建立成功。当大鼠出现精神萎靡、大便溏稀、肛门黏膜潮红、肛温升高时,表明建模成功。CD造模前1d,牛肉组和羊肉组分别开始投放含牛肉或羊肉的肥甘饲料,饲喂次数及时间与大鼠正常进食相同。
1.4.2 CD模型制备 胃肠湿热模型构建成功后,所有大鼠用电推剪剪去背部毛发,在背部以脊柱为中线选择4cm×4cm大小皮肤作为实验区域,空白组参照脱毛膏使用方法进行脱毛后,涂抹0.9%氯化钠注射液,停留8min后擦净;其余组于相同部位涂抹5mm长度脱毛膏,停留8min后以湿巾擦净,24h后再次涂抹等量脱毛膏,停留8min后擦去,构建CD模型。在造模完成当日及48h后分别观察大鼠皮损变化。
1.4.3 标本采集 CD造模第3天,禁食不禁水8h,各组大鼠以100mg·kg-1戊巴比妥腹腔注射麻醉后,腹主动脉采血,离心后分离血清,-80℃冻存。采血后剪取皮损明显处皮肤和胃体组织、空肠、回肠、结肠组织,置于10%甲醛溶液中固定;另取皮损处皮肤和胃体组织,空肠、回肠、结肠组织各约1.0cm长,-80℃冷冻保存。
1.4.4 组织病理观察 将固定于甲醛溶液中的组织脱水,用石蜡包埋并切片。HE染色后,中性树胶封片,光镜下观察组织病理变化。
1.4.5 免疫组化检测Notch1蛋白表达水平 用免疫组化法检测大鼠皮损及消化道组织中Notch1的表达。将组织包埋、切片,室温脱蜡并水化,封闭后滴入一抗4℃过夜;磷酸盐缓冲液(phosphate buffered saline,PBS)洗涤后滴加二抗孵育,清洗后以3,3-二氨基联苯胺(diaminobezidin,DAB)染色,复染、脱水后二甲苯透明,中性树胶封片,镜下观察。免疫组化阳性物质为棕黄色、黄色、淡黄色,呈颗粒状、丝状。根据视野中阳性细胞占比及染色程度综合评价结果。阳性细胞占比评分:0%计0分,1%~25%计1分,26%~50%计2分,51%~75%计3分,76%~100%计4分; 染色程度评分:无色计0分,淡黄色计1分,棕黄色计2分,棕色计3分。将两者分数相加,综合评定:0分为阴性,1~3分为弱阳性,4~5分为阳性,6~7分为强阳性。
1.4.6 血清炎症因子检测 以ELISA法检测大鼠血清中TNF-α、IL-35的表达,操作严格按照试剂盒说明书进行。
1.5 统计学分析 采用SPSS 20.0统计软件进行统计学分析,计量资料以±s表示,满足正态分布时,组间比较采用单因素方差分析。总体均数满足方差齐性者,进一步两组间比较采用最小显著差异(least significant difference,LSD)-t检验; 方差不齐采用Dunnet'T3法。以P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠一般情况、大便性状及肛温变化比较 食物干预造模21d后,空白组及模型对照组大鼠精神状态较好,反应迅速,大便成形,质地颜色正常,肛门直肠黏膜颜色正常,肛温无明显改变;胃肠湿热组、牛肉组、羊肉组大鼠精神倦怠,反应迟缓,饮食减少,大便稀溏,有臭秽气味,肛门直肠黏膜潮红,肛温较造模前升高,差异有统计学意义(P<0.05)。见表1。
表1 各组大鼠胃肠湿热证造模前后肛温比较(±s,℃)Tab.1 Comparison of anal temperature before and after modeling of gastrointestinal dampness-heat syndrome in each group(±s,℃)
表1 各组大鼠胃肠湿热证造模前后肛温比较(±s,℃)Tab.1 Comparison of anal temperature before and after modeling of gastrointestinal dampness-heat syndrome in each group(±s,℃)
注:与同组造模前比较,*P<0.05Note:Compared with the same group before modeling,*P<0.05
组别造模前 造模后空白组 37.8±0.3 37.9±0.3模型对照组 37.6±0.2 37.8±0.3胃肠湿热组 37.8±0.3 38.8±0.2*牛肉组 37.6±0.4 38.9±0.5*羊肉组 37.8±0.3 39.1±0.5*
2.2 各组大鼠皮损情况比较 空白组背部表皮完好,无皮损。模型对照组大鼠背部见红斑伴轻度肿胀,呈淡红色,少量针尖大小水疱、部分糜烂;皮肤镜表现为淡红色背景下不规则分布的多形性或线状血管。48h后见红斑、结痂和少量鳞屑。牛肉组和羊肉组及胃肠湿热组大鼠背部见边缘清晰的红斑,呈鲜红色,部分糜烂,伴有明显肿胀,其上密布针尖大小水疱;皮肤镜下表现为红色背景下大量不规则分布的多形性血管及水疱。48h后肉眼见少量红斑,部分已结痂,可见较多鳞屑。见图1及图2。

图1 肉眼观察大鼠皮损表现Fig.1 Skin lesions of rats observed with naked eyes
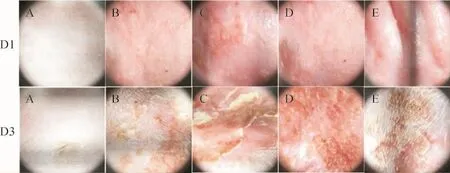
图2 皮肤镜下观察大鼠皮损表现(30×)Fig.2 Skin lesions of rats observed with dermatoscope(30×)
2.3 各组大鼠病理表现比较 空白组表皮结构完整,细胞排列紧密,无明显细胞内及细胞间水肿,真皮处可见少量淋巴细胞。牛肉组、羊肉组、胃肠湿热组均见表皮结构严重破坏,出现严重海绵水肿,棘层内水疱,疱内有少量淋巴细胞,表皮及真皮内大量炎症细胞浸润,主要为淋巴细胞,真皮浅层血管扩张,内皮细胞肿胀明显,周围大量淋巴细胞浸润。模型对照组表皮结构破坏,出现明显海绵水肿,棘层内水疱,真皮内较多以淋巴细胞为主的炎症细胞浸润,真皮浅层血管扩张,内皮细胞肿胀,其病理表现与上3组类似,但细胞水肿及炎症细胞浸润程度较轻。见图3。
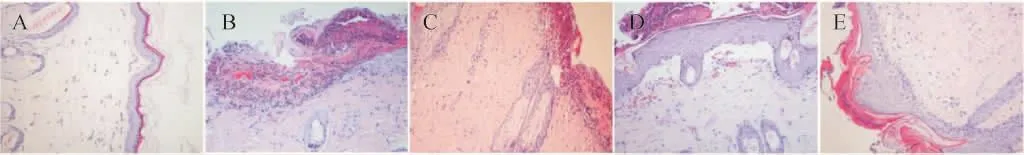
图3 大鼠皮损病理表现(HE染色,200×)Fig.3 Pathological manifestations of skin lesions of rats(HE staining,200×)
2.4 各组大鼠皮损及胃肠道组织中Notch1表达比较 空白组中,Notch1蛋白在所测组织中均呈阴性表达。模型对照组中,Notch1在表皮及血管内皮中呈弱阳性,在消化道组织中均为阴性。牛肉组和羊肉组中,皮损及消化道组织中,Notch1均呈强阳性表达。胃肠湿热组中,Notch1在表皮及血管内皮呈阳性表达,在胃黏膜层和空肠、回肠、结肠的黏膜层和肌层呈阳性表达。见图4。

图4 各组大鼠皮肤及消化道组织中Notch1蛋白的表达(标尺=250μm,40×)Fig.4 Expression of Notch1 in skin and digestive tract tissues in each group(scale=250μm,40×)
2.5 各组大鼠血清TNF-α、IL-35水平比较 与空白组比较,模型对照组大鼠血清炎症因子水平差异无统计学意义(P>0.05)。与模型对照组比较,牛肉组、羊肉组大鼠TNF-α水平明显升高(P<0.05),牛肉组的IL-35表达水平明显降低(P<0.05)。与模型对照组比较,胃肠湿热组IL-35水平明显降低 (P<0.05),TNF-α水平稍升高,但差异无统计学意义(P>0.05)。见表2。
表2 各组大鼠血清TNF-α、IL-35水平比较(±s,pg·mL-1)Tab.2 Comparison of serum levels of TNF-α and IL-35 in each group(±s,pg·mL-1)

表2 各组大鼠血清TNF-α、IL-35水平比较(±s,pg·mL-1)Tab.2 Comparison of serum levels of TNF-α and IL-35 in each group(±s,pg·mL-1)
注:与模型对照组比较,△P<0.05Note:Compared with model control group,△P<0.05
分组 n TNF-α IL-35空白组 5 511.58±27.41 136.06±3.14模型对照组 5 506.99±23.13 134.67±4.66胃肠湿热组 5 528.28±34.25 125.16±6.92△牛肉组 5 569.53±21.64△ 116.29±4.85△羊肉组 5 614.34±42.23△ 132.29±11.03
3 讨论
CD是一种接触某些物质后出现的炎症性皮肤病,根据接触物为致敏物或刺激物分为过敏性CD和刺激性CD两类[6]。目前,CD大鼠造模多采用2,4-二硝基氟苯,但在前期实验中,笔者发现在大鼠皮肤上涂抹脱毛膏,并停留8min以上,再次涂抹时,90%以上大鼠会出现CD急性期样表现,而且病理组织改变为表皮海绵水肿、细胞间水疱、真皮层大量炎症细胞浸润,与标准CD模型相似,因此本研究采用脱毛膏诱导大鼠CD模型。
中医认为,CD主要是由患者禀赋不足,复感风、热、湿邪所致,其中患者素体湿热内蕴是重要内因,与脏腑功能(尤其是脾胃功能)失调密切相关,饮食不节是重要的诱发因素。《素问》中云:“饮食自倍,肠胃乃伤。”说明饮食不节与疾病发生之间具有密切关系。患者常因过食膏粱厚味、甘温之物滋腻碍胃,助湿生热,从而出现胃肠湿热的表现。《金匮翼》云:“有饮食之湿,酒水乳酪之类也。”[7]内生湿热蕴于皮肤,在外接触毒邪,蕴而化热,与人体之气血相搏,拂郁肌肤发而为病。现代医学研究发现,高糖高脂的西方饮食会促使TNF-α、白细胞介素-17(interleukin-17,IL-17)等促炎因子的水平升高[8],这可能是因为动物油脂中富含的长、中链脂肪酸会破坏肠道屏障功能,提高肠上皮通透性,促进辅助性T细胞1(helper T cell 1,Th1)和Th17的增殖和分化,从而诱导肠道炎症性改变;而高纤维饮食所含有的短链脂肪酸,能促进调节性T细胞(regulatory T cells,Treg)的数量增加,从而抑制肠道炎症[9-10]。故在胃肠湿热动物模型中,常选用油脂、白糖、蜂蜜、白酒等作为饮食因素进行造模。而减少食肉在皮肤疾病的饮食管理中也经常被提及。《素问·热论》曰:“食肉则复。”牛羊肉是传统意义上的发物,被认为辛甘性温,动而升浮,多食则能动火生风,与皮肤病有密切的关系。《本草纲目》中记载:“牛肉甘温……羊肉大热。”[11]牛羊肉中富含花生四烯酸,其体内代谢产物白三烯是过敏性疾病和炎症性疾病的重要参与者[12]。有研究发现,羊肉煎剂灌胃可明显加重CD小鼠皮损,增加局部炎症细胞的浸润,上调干扰素-γ(interferon-γ,IFN-γ)等炎症因子的水平[13]。
CD包括致敏阶段和激发阶段,致敏阶段由朗格汉斯细胞(Langerhans cell,LC)呈递外来过敏原,激活T淋巴细胞,其中TNF-α是活化LC的关键因素之一[14]。CD动物模型血清中,TNF-α水平明显升高[15]。在CD早期,TNF-α局部水平增高,促进细胞间黏附分子-1 (intercellular cell adhesion molecule-1,ICAM-1)的分泌,从而诱导以中性粒细胞为主的炎症细胞聚集,加重局部炎症反应[16]。有报道高脂饮食可升高小鼠血清TNF-α水平[17],且TNF-α可协同IFN-γ改变肠上皮细胞的形态,并可影响肠上皮的屏障特性,使肠黏膜的通透性增加,继而进一步引起肠道的炎症性改变[18]。本次研究中,牛肉组、羊肉组大鼠血清TNF-α水平明显上升,提示牛羊肉可能通过上调血清TNF-α水平加重CD症状。
在CD病程中,Treg细胞起到免疫抑制的作用。当再次接触抗原时,Treg细胞募集至皮肤中,能够强烈地抑制炎症反应[14]。IL-35由Treg细胞分泌,是一种具有抗炎作用的细胞因子,其分泌可以进一步反馈促进Treg细胞的分化[19]。研究发现,银屑病患者血清中IL-35表达水平低于健康对照组,且其表达水平与皮损严重程度呈负相关,提示IL-35作为一种抗炎因子参与皮肤炎症的发病过程[20]。唐文静等[21]研究也发现,IL-35的表达水平与炎症性肠病活动度呈负相关,提示肠道炎症反应可能与IL-35表达降低,不能有效发挥抗炎作用有关。本研究中,牛肉组大鼠血清IL-35水平明显下降,提示摄入牛肉加重CD症状可能与此有关。
Notch信号通路包括受体(Notch1~4)、配体(Jagged1、2和Delta-like1、3、4)以及DNA结合蛋白,Notch1受体能够直接作用于核因子-κB(nuclear factor-κ B,NF-κB),使T细胞中的NF-κB保留在细胞核中;并能够与IFN-γ的启动子形成复合物,从而调控IFN-γ的表达,增加IFN-γ的分泌。另有研究发现,Notch信号通路能够抑制Treg细胞的功能[22]。研究发现,Notch1能抑制Treg细胞的免疫调节功能,并降低相关炎症抑制因子的表达[23];激活的Notch1信号也可促进TNF-α的释放[24]。在CD小鼠中,高表达的Notch1可促进血管内皮细胞分泌血管细胞黏附因子-1(vascular cell adhesion protein-1,VCAM-1),促进炎症细胞募集,加重局部炎症反应[25]。Notch1蛋白表达升高能影响肠道上皮细胞分化方向,促进上皮细胞向吸收型细胞分化,减少向分泌型细胞尤其是杯状细胞的分化,从而降低肠黏膜屏障的防御功能,导致炎症反应[26]。本研究结果提示,牛、羊肉组大鼠消化道组织中Notch1表达上升,说明牛羊肉可能通过上调Notch1表达,影响消化道黏膜的屏障功能,促进炎症细胞聚集,导致炎症反应发生,从而加重CD的症状。
本研究发现,脱毛膏可诱导大鼠CD模型;牛肉组和羊肉组大鼠皮损表现较胃肠湿热组及模型对照组更严重,病理结果中表皮、真皮内炎症细胞浸润较多,提示传统发物牛羊肉能加重胃肠湿热证CD,这可能与消化道中Notch1表达上调,以及促进血清中TNF-α水平上升、IL-35水平下降有关。但本研究样本量较少,因此结果的局限性和偏倚性难以避免,有待扩大样本量进一步加以验证。而Notch1的表达是否与TNF-α和IL-35水平有关,发物对CD的影响是否具有时间和剂量关系,以及脱毛膏长期施用于大鼠皮肤导致CD样表现的内在机制尚需要深入研究。
