基于VEGF/VEGFR-2信号通路研究淫羊藿苷促进大鼠胫骨干骨折愈合的作用机制
2021-03-23
郑州大学附属郑州中心医院 郑州 450000
骨折是指骨的力学连续性、完整性丢失,以骨折处疼痛、肿胀、功能障碍、异常活动等主要临床表现,是常见的外科疾病之一[1]。骨折愈合是极为复杂的组织学修复过程,其中血管新生贯穿于整个骨折愈合过程,从血肿机化期、原始骨痂形成期到骨痂改造塑形期都有血管新生的参与。临床已证实血液供应是影响骨折愈合情况的主要因素[2-3],因此促进血管新生是加快骨折愈合的关键。淫羊藿苷(icariin,ICA)是提取自淫羊藿茎叶的总黄酮类物质,具有调节免疫功能、改善内分泌、抗肿瘤等多种药理学功能[4]。近年来有研究指出,ICA可通过激活血管生成信号分子,刺激血管新生,为骨折治疗提供新的可能[5]。血管内皮生长因子/血管内皮生长因子受体-2(vascular endothelial growth factor/vascular endothelial growth factor receptor-2,VEGF/VEGFR-2)信号通路在血管新生过程中起着关键作用,研究证实该信号通路介导和参与了骨折愈合过程[6]。然而,目前鲜有基于VEGF/VEGFR-2信号通路研究ICA对骨折愈合影响的报道。鉴于此,本研究建立大鼠胫骨干骨折模型,研究ICA对大鼠胫骨干骨折愈合的作用并探讨相关机制,以期指导临床。
1 材料和方法
1.1 实验动物 无特定病原体(specific pathogen free,SPF)雄性SD大鼠50只,8周龄,体质量(300±20)g,饲养于郑州大学实验动物中心 [实验动物使用许可证号码:SYXK(豫)2011-0001],温度(23±2)℃,湿度(50±5)%,明暗周期12h/12h,所有大鼠适应性饲养7d。
1.2 药物、主要试剂和仪器 ICA购于上海源叶生物科技有限公司(批号:20120706);复方骨肽注射液购于常州方圆制药有限公司(剂量:5mL/75mg,国药准字:H20065416);戊巴比妥钠购于上海化学试剂总厂试剂二厂(批号:820219);Trizol试剂盒购于美国Invitrogen公司(批号:79407);RT-Kit逆转录试剂盒购于上海Roche公司(批号:4897030001);二喹啉甲酸(bicinchoninic acid,BCA)蛋白定量分析试剂盒购于武汉博士德生物工程有限公司(批号:AR0146);十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)上样缓冲液购于上海雷浩信息科技有限公司(批号:B1007);Tris缓 冲 液(Tris-buffered saline and 0.1% Tween-20,TBST)购于南京安培化工科技有限公司(批号:SBJ-1020);VEGF、VEGFR-2单抗均购于美国Abcam公司(批号:ab32152、ab245725);辣根过氧化物酶标记的山羊抗兔IgG抗体购于碧云天生物技术有限公司(批号:A0208)。
数字化X线摄片机为美国hologic公司产品;BX51显微镜购于日本Olympus株式会社;Inveon Research Wofkplace软件购于德国西门子股份公司;Image Pro-Plus Software 6.0 IPP软件为美国微软公司产品;Electro Force 3200生物力学性能测试仪购于美国BOSE公司;Viva CT40微计算机断层扫描(microcomputed tomography,Mirco-CT) 机购于瑞士SCANCO Medical AG公司;ChemiDoc XRS化学发光成像分析系统为美国Bio-rad公司产品。
1.3 方法
1.3.1 模型建立及分组 参照文献[7],采用锯开法建立大鼠胫骨干骨折模型。所有SD大鼠均以2%戊巴比妥钠50mg/kg腹腔注射麻醉,6%硫化钠于左下肢备皮后,以右侧卧位固定于造模台。碘伏消毒左足至左大腿上段,于胫骨结节下方2mm沿胫骨脊作1.5cm纵向切口,剥离外皮,继续沿胫骨脊外侧0.5mm位置将浅筋膜与深筋膜层纵向切开,游离胫骨前肌群,暴露胫骨外骨面。采用5mL注射器针头于胫骨髌韧带开口,插入克氏针沿髓腔达胫骨粗隆间,于胫骨中段前方最高点锯开约3mm左右缺损,缺损达骨髓腔,形成胫骨中段横行骨折。继续插入克氏针穿过骨折位置贯穿整个胫骨髓腔,固定骨折,剪除多余克氏针,将其远端埋于骨皮质下。以0.9%氯化钠溶液冲洗干净后逐层缝合切口,涂抹适量红霉素软膏,连续3d每天注射8万U青霉素以预防感染。术后即刻于大鼠麻醉状态下拍摄患肢X线片,建模成功标准:胫骨中段斜形或横形骨折,骨折端内固定效果理想,未发生明显移位。50只大鼠建模成功41只、失败9只,将建模成功的41只大鼠随机分为对照组 (10只)、ICA低剂量组(10只)、ICA高剂量组(10只)、阳性药物组(11只)。
1.3.2 术后干预 术后第2天开始进行干预,参照文献[8]结合前期研究确定ICA的剂量,ICA低、高剂量组分别为40mg/(kg·d)、80mg/(kg·d)。ICA采用0.9%氯化钠溶液溶解,以5mL/(kg·d)的剂量腹腔注射,1次/d。阳性药物组采用复方骨肽注射液治疗,取0.4mL溶于0.9%氯化钠溶液,以5mL/(kg·d)的剂量腹腔注射,1次/d。对照组以等量0.9%氯化钠溶液腹腔注射,1次/d。各组均连续干预21d。
1.3.3 Mirco-CT活体扫描 干预第7、14、21天进行Mirco-CT活体扫描。扫描前以2%戊巴比妥钠50mg/kg腹腔注射麻醉,保持大鼠俯卧位,屈曲双下肢,使股骨纵轴平行于Mirco-CT床滑轨的移动轴,在心电监护下行活体扫描。扫描分辨率47μm,扫描电压80kV,电流500μA,旋转角度360°,扫描时间2 000ms,帧平均数6,扫描范围为骨折线上下5mm。采用标准体模校准扫描结果,围绕骨痂沿股骨纵轴取100个扫描层面,上下各50个,建立感兴趣区。采用Inveon Research Wofkplace软件定量分析获取的三维图像信息,计算样本骨体积分数(bone volume/total volume,BV/TV)和骨小梁数量(trabecular number,Tb.N)。
1.3.4 生物力学测试 末次行Mirco-CT活体扫描后脱颈处死大鼠,完全剥离左下肢胫骨,采用骨水泥固定其两端避免加载时旋转移位,取等长骨架,采用生物力学性能测试仪进行三点弯曲实验。以所取胫骨段中点为加载点,承载点跨距30mm,加载速度2mm/min,记录各组最大载荷。
1.3.5 血管新生情况观察 处死大鼠后,以骨折位置作为中心,上下各取5mm×5mm骨痂组织标本,以4%多聚甲醛固定24h,组织块常规脱水、透明、浸蜡、石蜡包埋,制作成厚度5μm的切片,脱蜡后苏木精-伊红(hematoxylin-eosin,HE)染色,光镜下拍照,采用Image ProPlus Software 6.0 IPP软件测定新生血管面积,并计数新生血管数量,在骨痂愈合平面单位视野内随机选取10个不相邻视野,计算每个视野平均值。
1.3.6 实时荧光定量聚合酶链式反应(quantiative Real-time polymerase chain reaction,QRT-PCR)法检测骨痂组织VEGF、VEGFR-2 mRNA相对表达量处死大鼠后取骨折位置骨痂组织50mg,Trizol法提取总RNA,逆转录得cDNA,鉴定后进行基因序列扩增,按照QRT-PCR SYBRⅡ试剂盒说明书设定反应体系,反应体系总共25μL,包括SYBR Premix Ex Taq 10.5μL,5μmol·L-1上、 下游引物各1μL,cDNA 2μL,ddH2O 10.5μL。反应条件:90℃预变性5min,95℃变性20s,55℃退火40s,72℃延伸60s,重复40个循环,72℃延伸5min。以β-actin为内参基因,采用2-△△CT法计算各目的基因相对表达量。所有引物由生工生物工程(上海)股份有限公司合成,序列见表1。

表1 引物序列Tab.1 Primer sequences
1.3.7 Western blot法检测骨痂组织VEGF、VEGFR-2蛋白相对表达量 处死大鼠后取骨折位置骨痂组织50mg,充分研磨后冰上裂解30min,8 000r/min离心15min(离心半径10cm),BCA法测定蛋白浓度,取30μg待检测样本与等体积上样缓冲液混合,沸水浴5min,8 000r/min离心30min(离心半径10cm),取上清液,SDSPAGE分离后转膜,5%脱脂奶粉封闭2h,加入稀释倍数为1:1 000的兔抗大鼠VEGF、VEGFR-2单抗稀释液,4℃摇床孵育过夜,TBST洗涤3次,加入稀释倍数为1:8 000的辣根过氧化物酶标记的山羊抗兔IgG二抗,室温孵育2h,TBST洗涤3次后加入发光液,暗室显影,凝胶成像系统扫描分析条带灰度值,以目的条带/内参条带灰度值比值表示蛋白相对表达量。
1.4 统计学分析 应用SPSS 22.0统计软件进行统计学分析,计量资料以±s表示,多样本资料组间比较采用单因素方差分析及重复测量方差分析,经Levene检验满足方差齐性者,采用单因素方差分析,以最小显著性差异(least significant difference,LSD)-t检验行两两比较;方差不齐者,采用Welch检验,再以Dunnett T3检验进行两两比较。以P<0.05为差异有统计学意义。
2 结果
2.1 干预第7、14、21天各组活体Micro-CT结果比较 干预第7、14、21天,各组间总体比较,BV/TV、Tb.N差异有统计学意义 (P<0.01)。与对照组比较,ICA低剂量组、ICA高剂量组、阳性药物组BV/TV更高,Tb.N更多(P<0.05);与ICA低剂量组比较,ICA高剂量组、阳性药物组BV/TV更高,Tb.N更多(P<0.05);与ICA高剂量组比较,阳性药物组BV/TV更高,Tb.N更多(P<0.05)。随时间延长各组BV/TV均呈增高趋势,Tb.N呈增多趋势(P<0.01)。见表2~3。干预第21天活体Micro-CT结果显示,对照组、ICA低剂量组骨折断端尚未完全吻合,骨折线明显,骨皮质外观连续性差,提示新生骨量较少;ICA高剂量组、阳性药物组骨折断端吻合良好,骨折线不明显,骨皮质外观较为连续,提示新生骨量较多。见图1。
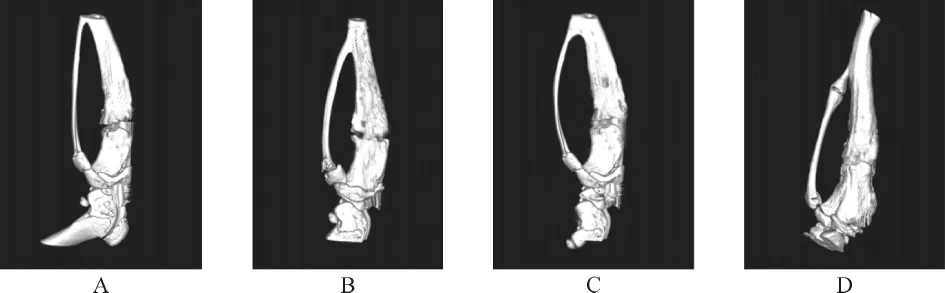
图1 干预第21天活体Micro-CT结果Fig.1 In vivo micro-CT results on the 21st day of intervention
表2 干预第7、14、21天各组BV/TV值比较(±s)Tab.2 Comparison of BV/TV value on the 7th,14th and 21st day of intervention in each group(±s)

表2 干预第7、14、21天各组BV/TV值比较(±s)Tab.2 Comparison of BV/TV value on the 7th,14th and 21st day of intervention in each group(±s)
注:与对照组比较,*P<0.05;与ICA低剂量组比较,#P<0.05;与ICA高剂量组比较,△P<0.05;与同组第7天比较,▽P<0.05;与同组第14天比较,◇P<0.05Note:Compared with control group,*P<0.05;compared with ICA low-dose group,#P<0.05;compared with ICA high-dose group,△P<0.05;compared with the same group on the 7th day,▽P<0.05;compared with the same group on the 14th day,◇P<0.05
组别 n 第7天 第14天 第21天对照组 10 0.19±0.04 0.24±0.05▽ 0.29±0.04▽◇ICA 低剂量组 10 0.24±0.05* 0.29±0.05*▽ 0.34±0.06*▽◇ICA 高剂量组 10 0.28±0.04*# 0.34±0.05*#▽ 0.40±0.05*#▽◇阳性药物组 11 0.34±0.05*#△ 0.39±0.04*#△▽ 0.46±0.07*#△▽◇F 值 F 组间=15.246,F 时间=19.712,F 交互=17.075 P 值 P 组间<0.01,P 时间<0.01,P 交互<0.01
表3 干预第7、14、21天各组Tb.N比较(±s,1·mm-1)Tab.3 Comparison of Tb.N on the 7th,14th and 21st day of intervention in each group(±s,1·mm-1)

表3 干预第7、14、21天各组Tb.N比较(±s,1·mm-1)Tab.3 Comparison of Tb.N on the 7th,14th and 21st day of intervention in each group(±s,1·mm-1)
注:与对照组比较,*P<0.05;与ICA低剂量组比较,#P<0.05;与ICA高剂量组比较,△P<0.05;与同组第7天比较,▽P<0.05;与同组第14天比较,◇P<0.05Note:Compared with control group,*P<0.05;compared with ICA low-dose group,#P<0.05;compared with ICA high-dose group,△P<0.05;compared with the same group on the 7th day,▽P<0.05;compared with the same group on the 14th day,◇P<0.05
组别 n 第7天 第14天 第21天对照组 10 1.87±0.32 2.25±0.46▽ 2.69±0.39▽◇ICA 低剂量组 10 2.22±0.37* 2.65±0.40*▽ 3.08±0.41*▽◇ICA 高剂量组 10 2.70±0.39*# 3.10±0.43*#▽ 3.54±0.55*#▽◇阳性药物组 11 3.25±0.39*#△ 3.63±0.42*#△▽ 4.21±0.81*#△▽◇F 值 F 组间=10.711,F 时间=14.482,F 交互=12.270 P 值 P 组间<0.01,P 时间<0.01,P 交互<0.01
2.2 各组生物力学测试结果比较 各组间总体比较,最大载荷差异有统计学意义(P<0.01)。与对照组比较,ICA低剂量组、ICA高剂量组、阳性药物组最大载荷更大(P<0.05);与ICA低剂量组比较,ICA高剂量组、阳性药物组最大载荷更大(P<0.05);与ICA高剂量组比较,阳性药物组最大载荷更大(P<0.05)。见表4。
表4 各组生物力学测试结果比较(±s,N)Tab.4 Comparison of biomechanical test results in each group(±s,N)
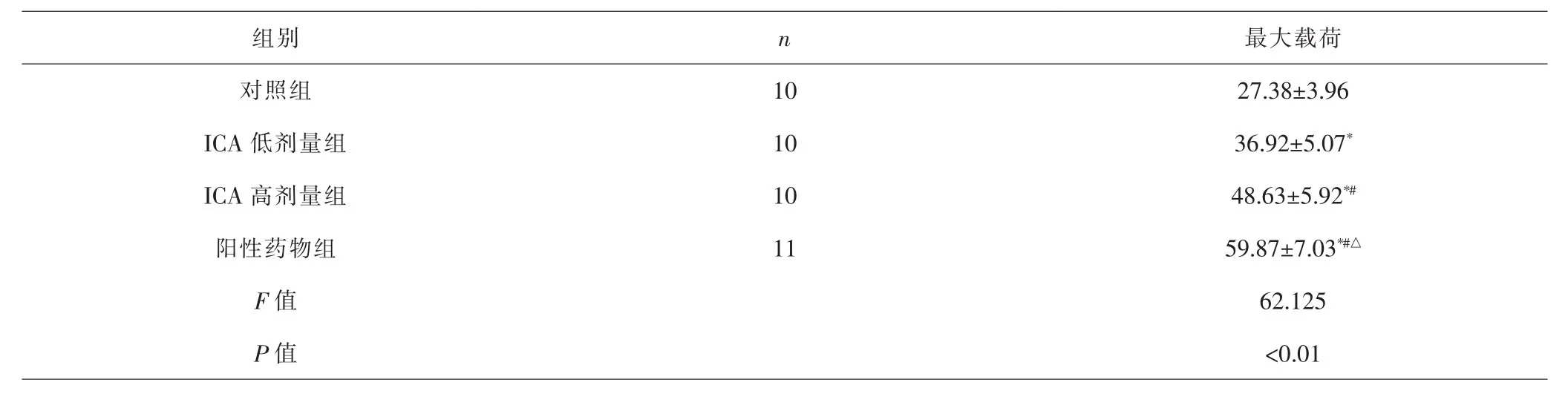
表4 各组生物力学测试结果比较(±s,N)Tab.4 Comparison of biomechanical test results in each group(±s,N)
注:与对照组比较,*P<0.05;与ICA低剂量组比较,#P<0.05;与ICA高剂量组比较,△P<0.05Note:Compared with control group,*P<0.05;compared with ICA low-dose group,#P<0.05;compared with ICA high-dose group,△P<0.05
组别n最大载荷对照组 10 27.38±3.96 ICA低剂量组 10 36.92±5.07*ICA高剂量组 10 48.63±5.92*#阳性药物组 11 59.87±7.03*#△F值 62.125 P值 <0.01
2.3 各组新生血管数量、新生血管面积比较 各组间总体比较,新生血管数量、新生血管面积差异有统计学意义(P<0.01)。与对照组比较,ICA低剂量组、ICA高剂量组、阳性药物组新生血管数量更多,新生血管面积更大(P<0.05);与ICA低剂量组比较,ICA高剂量组、阳性药物组新生血管数量更多,新生血管面积更大(P<0.05);与ICA高剂量组比较,阳性药物组新生血管数量更多,新生血管面积更大(P<0.05)。见表5、图2。
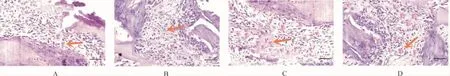
图2 各组血管新生情况(HE染色,200×)Fig.2 Angiogenesis in each group(HE staining,200×)
表5 各组新生血管数量、新生血管面积比较(±s)Tab.5 Comparison of the number and the area of new blood vessels in each group(±s)
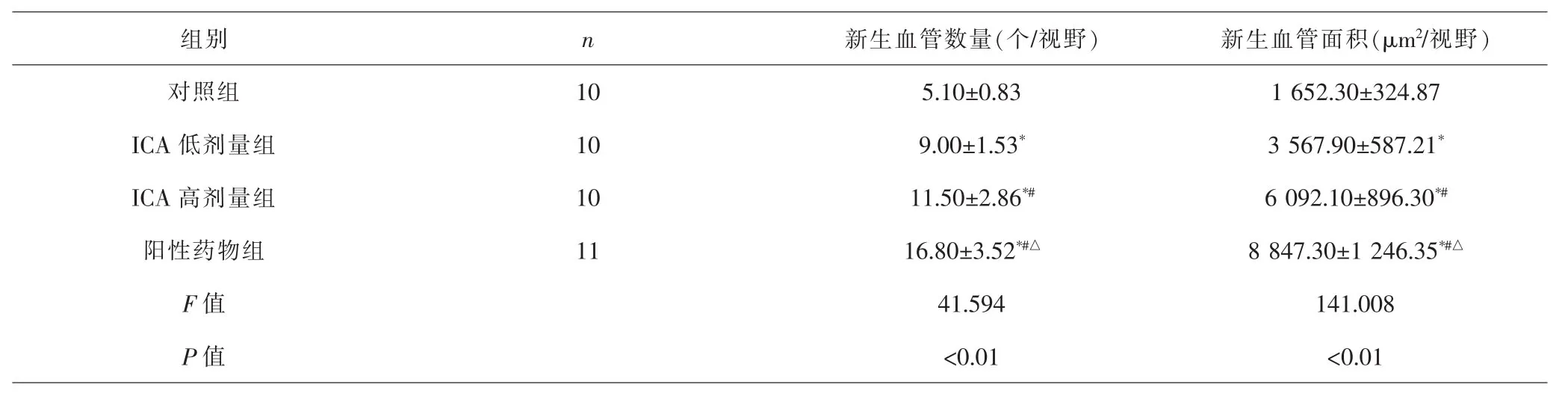
表5 各组新生血管数量、新生血管面积比较(±s)Tab.5 Comparison of the number and the area of new blood vessels in each group(±s)
注:与对照组比较,*P<0.05;与ICA低剂量组比较,#P<0.05;与ICA高剂量组比较,△P<0.05Note:Compared with control group,*P<0.05;compared with ICA low-dose group,#P<0.05;compared with ICA high-dose group,△P<0.05
组别 n 新生血管数量(个/视野) 新生血管面积(μm2/视野)对照组 10 5.10±0.83 1 652.30±324.87 ICA 低剂量组 10 9.00±1.53* 3 567.90±587.21*ICA 高剂量组 10 11.50±2.86*# 6 092.10±896.30*#阳性药物组 11 16.80±3.52*#△ 8 847.30±1 246.35*#△F值 41.594 141.008 P 值 <0.01 <0.01
2.4 各组骨痂组织VEGF、VEGFR-2 mRNA相对表达量比较 各组间总体比较,骨痂组织VEGF、VEGFR-2 mRNA相对表达量差异有统计学意义(P<0.01)。与对照组比较,ICA低剂量组、ICA高剂量组、阳性药物组VEGF、VEGFR-2 mRNA相对表达量较高(P<0.05);与ICA低剂量组比较,ICA高剂量组、阳性药物组VEGF、VEGFR-2 mRNA相对表达量较高 (P<0.05);与ICA高剂量组比较,阳性药物组VEGF、VEGFR-2 mRNA相对表达量较高(P<0.05)。见表6。
表6 各组骨痂组织VEGF、VEGFR-2 mRNA相对表达量比较(±s)Tab.6 Comparison of relative expression content of VEGF and VEGFR-2 mRNA in callus tissue in each group(±s)

表6 各组骨痂组织VEGF、VEGFR-2 mRNA相对表达量比较(±s)Tab.6 Comparison of relative expression content of VEGF and VEGFR-2 mRNA in callus tissue in each group(±s)
注:与对照组比较,*P<0.05;与ICA低剂量组比较,#P<0.05;与ICA高剂量组比较,△P<0.05Note:Compared with control group,*P<0.05;compared with ICA low-dose group,#P<0.05;compared with ICA high-dose group,△P<0.05
组别 n VEGF VEGFR-2对照组 10 0.18±0.03 0.19±0.03 ICA 低剂量组 10 0.30±0.05* 0.38±0.05*ICA 高剂量组 10 0.49±0.06*# 0.54±0.06*#阳性药物组 11 0.68±0.07*#△ 0.70±0.08*#△F值 166.562 144.748 P 值 <0.01 <0.01
2.5 各组骨痂组织VEGF、VEGFR-2蛋白相对表达量比较 各组间总体比较,骨痂组织VEGF、VEGFR-2蛋白相对表达量差异有统计学意义(P<0.01)。与对照组比较,ICA低剂量组、ICA高剂量组、阳性药物组VEGF、VEGFR-2蛋白相对表达量较高(P<0.05);与ICA低剂量组比较,ICA高剂量组、阳性药物组VEGF、VEGFR-2蛋白相对表达量较高(P<0.05);与ICA高剂量组比较,阳性药物组VEGF、VEGFR-2蛋白相对表达量较高(P<0.05)。见表7、图3。

图3 各组骨痂组织VEGF、VEGFR-2蛋白相对表达量Fig.3 Relative expression contents of VEGF and VEGFR-2 proteins in callus tissue in each group
表7 各组骨痂组织VEGF、VEGFR-2蛋白相对表达量比较(±s)Tab.7 Comparison of relative expression contents of VEGF and VEGFR-2 protein in callus tissue in each group(±s)
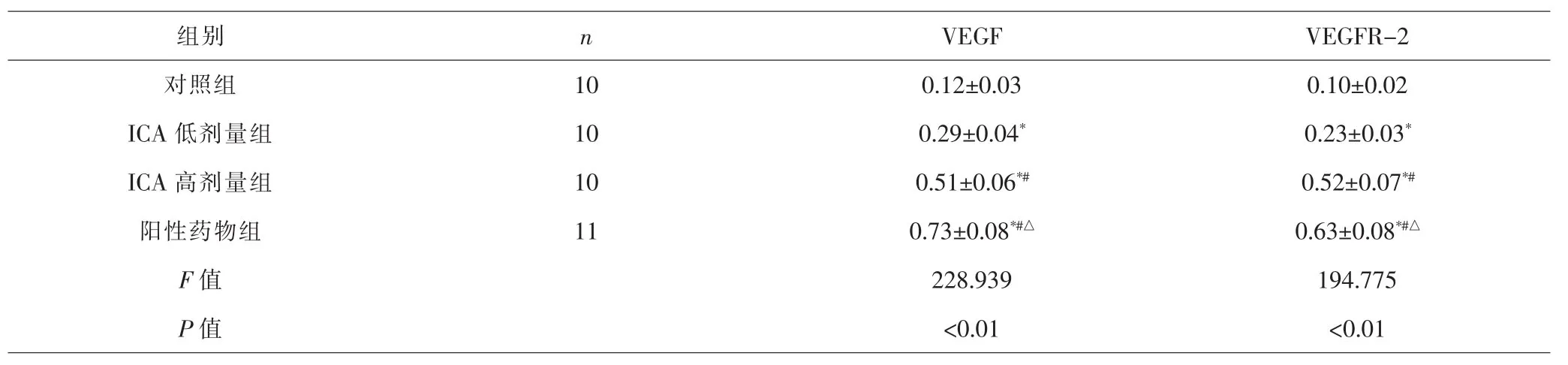
表7 各组骨痂组织VEGF、VEGFR-2蛋白相对表达量比较(±s)Tab.7 Comparison of relative expression contents of VEGF and VEGFR-2 protein in callus tissue in each group(±s)
注:与对照组比较,*P<0.05;与ICA低剂量组比较,#P<0.05;与ICA高剂量组比较,△P<0.05Note:Compared with control group,*P<0.05;compared with ICA low-dose group,#P<0.05;compared with ICA high-dose group,△P<0.05
组别 n VEGF VEGFR-2对照组 10 0.12±0.03 0.10±0.02 ICA 低剂量组 10 0.29±0.04* 0.23±0.03*ICA 高剂量组 10 0.51±0.06*# 0.52±0.07*#阳性药物组 11 0.73±0.08*#△ 0.63±0.08*#△F值 228.939 194.775 P 值 <0.01 <0.01
3 讨论
骨折时,骨折断端与临近骨膜、血管受损,导致局部范围骨坏死。当骨折正确固定后,断端张力降低,断端破骨细胞开始管性吸收,形成新的Haversian管系统,为血管内皮细胞、血管周干细胞、成骨前体细胞、成骨细胞以及新生血管进入骨痂创造条件,从而促进软骨骨痂吸收、骨性骨痂形成、骨改建,实现骨折愈合[9-10]。骨折愈合是生物学、内分泌学、组织学、生物力学综合作用的动态过程,需要血管发生与骨发生之间精密、协调地配合,其中血管发生先于骨发生,而且是软骨成骨时期最为关键的环节[11]。因此,探寻安全、有效的促血管新生药物对加快骨折愈合至关重要。
本研究结果显示,与对照组比较,ICA低剂量组、ICA高剂量组、阳性药物组的BV/TV、新生血管面积、最大载荷均增大,Tb.N、新生血管数量均增加,提示ICA可增加新生骨量、促进血管新生,加快骨折愈合,并增强其抵抗外力冲击的能力。中医认为,骨折后肢体经络受损,血溢脉外,淤血不散,致经脉受阻、筋骨失养,骨折难愈[12]。肾主骨与髓,肾强则达骨和,淤散则达血新,筋骨得以濡养,气血旺盛,则骨愈合。淫羊藿味辛、甘,归于肾、肝经,具有补肾壮阳、祛风除湿、强健筋骨的功效。ICA是淫羊藿提取物中的主要有效成分,因其具有雌激素样结构,逐渐被作为植物雌激素类药物应用于抗骨质疏松治疗[13]。既往研究显示,ICA治疗老龄大鼠骨质疏松骨折,可促使骨密度显著回升,同时成骨标志蛋白表达明显上调,提示ICA对该病具有良好的治疗作用[14]。现代药理学研究显示,ICA可增强成骨细胞活性,同时促进类骨质钙化与骨折位置的血管生成[15-16]。本研究应用不同剂量的ICA干预胫骨干骨折大鼠后,新生骨量及新生血管增加,抗冲击能力增强,与ICA促进成骨细胞分化、血管生成等功效关系密切。
VEGF是一种具有特异性的强力血管新生诱导剂,可活化成纤维细胞,并促使其分泌基质,促进血管内皮细胞增殖、迁移,诱导血管生成。VEGFR-2是介导血管新生的重要信号传递分子,VEGF可与其结合,刺激血管内皮释放基质蛋白降解酶,诱导内皮细胞游离,促进血管新生。同时VEGFR-2有助于提升内皮细胞增殖、迁移能力,还参与血管通透性的调节,在骨折愈合早期即能够促使骨祖细胞聚集到骨折断端,加快骨愈合速度,而其他相关因子对血管新生的促进作用也全部或部分通过VEGF而实现[17]。Liu等[18]研究发现,肿瘤细胞中VEGF/VEGFR-2表达显著升高,VEGF/VEGFR-2信号通路抑制剂Apatinib可阻断该信号通路,从而抑制肿瘤血管生成。安晓晖等[19]采用穿山龙总皂苷治疗去势大鼠骨折时发现,大鼠骨痂处骨密度及新生血管数量均增加,且VEGF、VEGFR-2蛋白表达均上调,提示VEGF/VEGFR-2信号通路与骨折愈合相关。本研究结果显示,对照组、ICA低剂量组、ICA高剂量组、阳性药物组VEGF、VEGFR-2 mRNA及蛋白相对表达量依次升高,提示ICA对大鼠胫骨干骨折愈合的促进作用可能与激活VEGF/VEGFR-2信号通路有关。
综上所述,ICA可加快胫骨干骨折大鼠骨量新生,促进血管形成,增强抵抗外力冲击的能力,且其作用呈剂量依赖性,推测其作用机制与上调VEGF、VEGFR-2表达,激活VEGF/VEGFR-2信号通路有关。本研究结果为ICA应用于骨折治疗提供了理论基础,然而关于ICA对胫骨干骨折是否存在其他影响及相关机制仍需进一步探讨。
