番茄USP1响应干旱和高温胁迫的研究
2021-03-22赵焕兰卢若兮范叶珍
宗 宁,赵焕兰,刘 奎,卢若兮,范叶珍,苗 敏
番茄1响应干旱和高温胁迫的研究
宗 宁,赵焕兰,刘 奎,卢若兮,范叶珍,苗 敏*
(合肥工业大学食品与生物工程学院,合肥 230601)
DDB1作为CUL4泛素连接酶的核心组件参与细胞内许多重要的生命活动。前期研究发现番茄CUL4-DDB1复合物(CRL4)调节植物细胞的非生物胁迫应答。为进一步阐明DDB1在植物抗逆中的调控机制和生理功能,通过酵母双杂交筛选,发现普遍应激蛋白USP1与DDB1存在相互作用,USPs家族蛋白参与提高生物体对逆境胁迫的耐受;进一步研究发现USP1定位于细胞质中,且其基因表达受到多种胁迫条件诱导。此外泛素化实验揭示USP1可以被泛素化修饰降解,上调1表达导致植株对干旱和高温抗性的增强,表明1可能正调控番茄植株对逆境下胁迫的应答,且它的作用受CUL4-DDB1泛素连接酶的靶向降解调控。结果不仅揭示新的植物抗逆机理,而且为植物抗逆分子育种提供新的基因资源和技术途径。
番茄;1;CUL4-DDB1;泛素化修饰;环境胁迫
植物在生长发育的过程中往往会受到外界环境胁迫的影响,例如紫外线辐射、干旱、盐碱、重金属、高温或者低温以及病虫害等。这些逆境胁迫会严重阻碍植物的正常生长,甚至导致植物死亡[1-2]。面对环境胁迫,植物逐渐进化出了许多策略来克服这些外界压力,这种进化来自于植物在习性、形态或者生理上的变化,从而以最大化其生存和繁殖机会的方式优化其生长和发育[3-4]。
普遍应激蛋白(universal stress protein, USP)最早在1990年发现于大肠杆菌中,此后陆续在包括细菌、古细菌、植物和多细胞动物在内的多种生物中都发现了该蛋白。研究发现,该蛋白在细胞防御信号和抗应激代谢途径中有很重要的作用[5-7]。植物中存在着大量的USPs蛋白,目前,从不同来源的植物中一共鉴定到了2 141种不同形式的USPs[8]。所有的蛋白质都包含至少一个USP结构域和其他的催化基序,它们在特定的组织、器官和发育阶段或在不同的应激条件下的表达存在差异[9-10]。USPs在保护植物免受胁迫方面具有不同的功能。拟南芥中的USP蛋白HRU1能够调节缺氧条件下细胞内过氧化氢(H2O2)的水平[11]。拟南芥中的另一种USP,,在植物受到热刺激或者氧化应激时,其存在形式会产生变化,从而影响到酶的活性,提高植物对热或者氧化应激的抗性[12]。同时,Melencion等发现在低温下的mRNA水平显著提高[13],说明在保护植物免受低温的伤害方面也发挥着生理功能。烟草中的异位表达通过去除细胞内活性氧来增强对渗透胁迫的抗性,显著增强烟草的耐盐性[14]。除了非生物胁迫,USPs在植物遭受生物胁迫时也能发挥作用[15-16]。
泛素-蛋白酶体系统(ubiquitin-proteasome system, UPS)介导了真核生物80% ~ 85%的蛋白质降解[17],是重要的负调节蛋白水平的机制。底物的泛素化是由3种酶的连续活性完成的,分别是泛素化酶(ubiquitin-activating enzyme, E1)、泛素结合酶(ubiquitin-conjugating enzyme, E2)和泛素连接酶(ubiquitin ligase, E3)[18]。被泛素化修饰的蛋白大部分通过蛋白酶体系统降解,也有部分修饰后的蛋白会改变细胞定位和活性。有研究发现,受损DNA结合蛋白1(DDB1)是CULLIN4(CUL4)-RING E3连接酶复合物的核心组分[19], CUL4与DDB1和另一种DDB1的相互作用蛋白DDB1-CUL4相关因子( DDB1-CUL4 associated factor, DCAF)组装,形成基于DDB1-CUL4的泛素连接酶(CRL4)家族[1]。作为CRL4泛素连接酶复合体的重要组成部分,DDB1由3个WD40 β-propeller结构域 (BPA、BPB和BPC)和一个C-末端螺旋结构域组成[20],BPB介导与CUL4的相互作用,而BPA和BPC可以与CRL4泛素连接酶的底物受体DCAF结合[21]。DCAF与靶向底物结合,番茄中有100多个DCA F接合蛋白,识别不同底物蛋白而参与各种生命活动[22]。DDB1作为CRL4泛素连接酶的核心组分参与调控番茄中的多种生理活动,包括叶绿体发育和次生代谢的调节、细胞增殖的表观遗传调控以及生物与非生物的应激反应[18, 23-25]。
前期的研究发现DDB1与几个DCAF参与高盐、紫外和干旱的胁迫应答[1, 25],但参与这一进程的靶向底物未知。为了进一步探究DDB1在非生物胁迫应答中调控机制以及哪些蛋白底物参与其中,本课题进行了以番茄DDB1为诱饵蛋白的酵母双杂交筛选,得到了一个USPs蛋白,称为USP1(universal stress protein 1)。本研究中,我们验证了DDB1与USP1的相互作用,并且证明了USP1可以作为CRL4泛素连接酶复合体的底物被泛素化降解。同时发现过表达USP1的番茄植株能够显著增强对于干旱以及高温胁迫的抗性,证明了USP1可以参与到番茄植株对于上述非生物胁迫的耐受性的调控之中,且极有可能通过DDB1介导的USP1泛素化降解参与调控胁迫应答。
1 材料与方法
1.1 材料
本研究所用的野生型(wild-type, WT)番茄(Mill. cv. Ailsa Craig) 来自美国康奈尔大学THOMPSON植物研究所,烟草 ()来自美国爱德华大学Fangming Xiao 副教授,均由本实验室繁育保存。大肠杆菌() DH5α,根瘤农杆菌() GV2260,EHA105,LBA4404购自上海唯地生物有限责任公司,酵母菌EGY48()由本实验室保存。
1.2 方法
1.2.1 USP1的亚细胞定位 根据1基因的CDS序列(Solyc04g014600.2.1)设计特异性引物USP1FI和USP1RI(引物信息见表1)以扩增去除了终止密码子的目的片段,将PCR产物连接到PART27-MCS-GFP载体(I和l酶切)上,将构建好的重组质粒PART27-USP1-GFP转入大肠杆菌DH5α,将成功转化的菌株测序验证,提取重组质粒转入农杆菌GV2260中,并通过注射法侵染生长1个月大小的本氏烟草叶片。黑暗放置36 h后用激光共聚焦显微镜观察烟草叶片细胞中绿色荧光蛋白的分布情况。
1.2.2 CO-IP实验 在生长4周龄的烟草叶片中利用烟草瞬时表达得到总蛋白,再用蛋白提取缓冲液提取。蛋白提取缓冲液含有50 mmol·L-1Tris-HCl(pH7.5)、150 mmol·L-1NaCl、5 mmol·L-1乙二胺四乙酸(EDTA)、2 mmol·L-1二硫苏糖醇(DTT)、10%甘油(Glycerol)、1%聚乙烯吡咯烷酮(PVPP)、0.1 mol·L-1苯甲基磺酰氟(PMSF)和100×植物蛋白酶抑制剂。蛋白提取液与15 μL Anti-HA磁珠于4 ℃孵育2 h,将磁珠清洗3次后加入5×蛋白loading buffer,95 ℃煮样5 min,再进行蛋白免疫印迹。
1.2.3 RNA提取和定量PCR分析 Trizol法提取番茄1转基因植株以及野生型植株幼嫩叶片的RNA,提取后的RNA用HiScriptⅢ反转录试剂盒反转录为cDNA,再进行定量PCR的分析。定量引物为USP1qPCRF和USP1qPCRR(引物信息见表1),同时以番茄3作为内参基因。
1.2.4 酵母双杂交实验 根据1基因的CDS序列(Solyc04g014600.2.1)设计特异性引物USP1FR I和USP1Rl,以野生型番茄cDNA为模板扩增得到包含终止密码子的基因片段,将基因片段连接到PJG4-5载体上获得重组质粒,重组质粒测序验证正确后与诱饵质粒共转化到EGY48酵母感受态中,于营养缺陷型三缺培养基(-Ura,-His,-Trp)进行筛选培养。将克隆转至显色培养基(-Ura,-His,-Trp,X-gal)中验证相互作用。

表1 本研究所用引物信息
1.2.51过表达载体的构建和转基因植株的获得 根据番茄1基因(Solyc04g014600.2.1)的序列设计引物USP1F、USP1R、USP1FI和USP1RI,用巢式PCR扩增得到目的基因片段,使用限制性内切酶I和I以及T4 DNA连接酶将基因连接到带有35S启动子的PBI121载体上,载体带有II筛选标记。
将构建好的载体转入农杆菌LBA4404中,再利用农杆菌介导的转化得到PBI121:35S-USP1转基因愈伤组织。愈伤组织在含有卡那霉素的MS筛选培养基上分化生长,待长成苗型后移入营养土中栽培。提取转基因植株的叶片DNA,采用PCR扩增标记基因II(引物信息见表1)和定量PCR进行转基因植株的鉴定。
1.2.61过表达植株的胁迫处理 选取长势相同的4周龄的1过表达植株进行胁迫处理,对照组与处理组均保持14 h光照,10 h黑暗。高温胁迫处理将番茄植株放置于40 ℃人工气候箱,正常浇水。干旱胁迫处理则将番茄植株置于25 ℃的温室内,并停止浇水。对照组的番茄均生长于25 ℃的温室内,正常浇水。
种子萌发实验选取刚露白的种子置于相应的1/2 MS培养基上,在25 ℃的温室内,14 h光照,10 h黑暗条件下生长。
2 结果与分析
2.1 USP1的基因表达模式分析及亚细胞定位
为了探究1基因的表达模式,根据1基因的Locus ID(Solyc04g014600.2.1),在番茄基因表达数据库网站TomExpress(http://tomexpress. toulouse.inra.fr/)查询了1基因在番茄不同组织器官及不同生长时期的表达量,发现1基因在番茄的种子、分生组织、花以及果实中均有表达,其中在种子和果实的表达量较高(图1)。
通过构建含有GFP标记的USP1融合蛋白载体,对USP1的亚细胞定位进行了探究,同时设置了GFP空载作为对照。USP1-GFP融合蛋白以及GFP蛋白均通过农杆菌介导的侵染在烟草叶片中瞬时表达,侵染的烟草叶片在黑暗中放置36 h后于激光共聚焦显微镜下观察。通过观察可以发现,USP1蛋白主要在细胞质中表达(图2)。
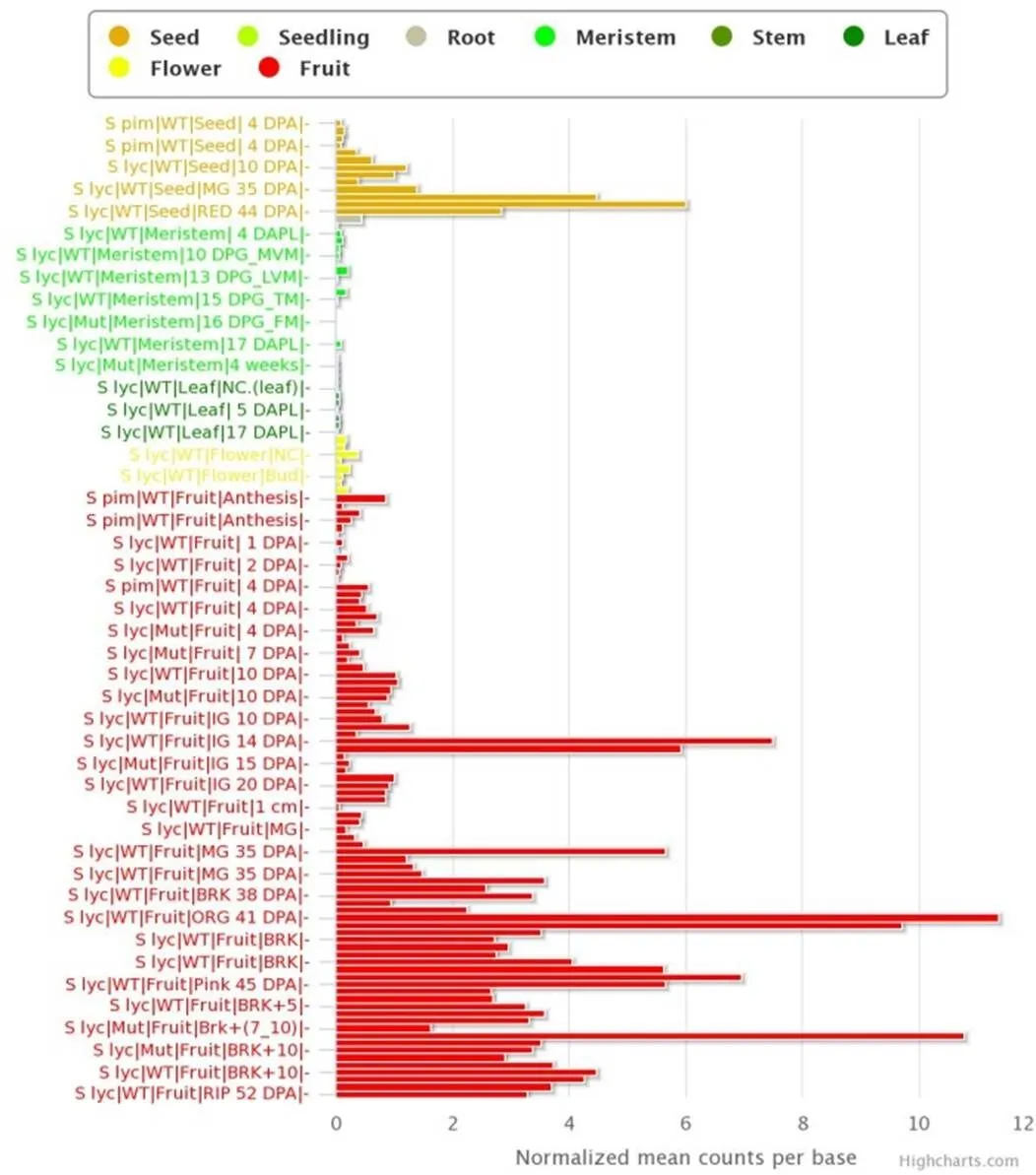
图1 番茄USP1基因的表达模式
Figure 1 Expression pattern of1 gene in tomato
2.2 USP1在不同胁迫诱导下的表达量分析
为了探明1基因的表达是否受胁迫条件的影响,我们选用5周龄的野生型番茄(AC+)进行了胁迫诱导实验。高温胁迫处理组的番茄植株放置于40 ℃人工气候箱中,正常浇水,分别于0、2、6和10 h后取样用于定量分析。NaCl处理组置于25 ℃温室中,用300 mmol·L-1的NaCl进行浇灌,在处理后0、12、24和48 h取样分析。模拟干旱处理组置于25 ℃温室中,用400 mmol·L-1的Mannitol进行浇灌,在处理后0、12、24和48 h取样分析。所有处理组光照周期均保持14 h光照,10 h黑暗。胁迫处理定量PCR结果表明,番茄植株在高温、盐和模拟干旱胁迫处理后,1基因的表达量均产生了明显的变化(图3),这种变化说明1基因确实参与到了番茄在应对高温、盐以及干旱胁迫的调控之中,为后续的实验探明了方向。
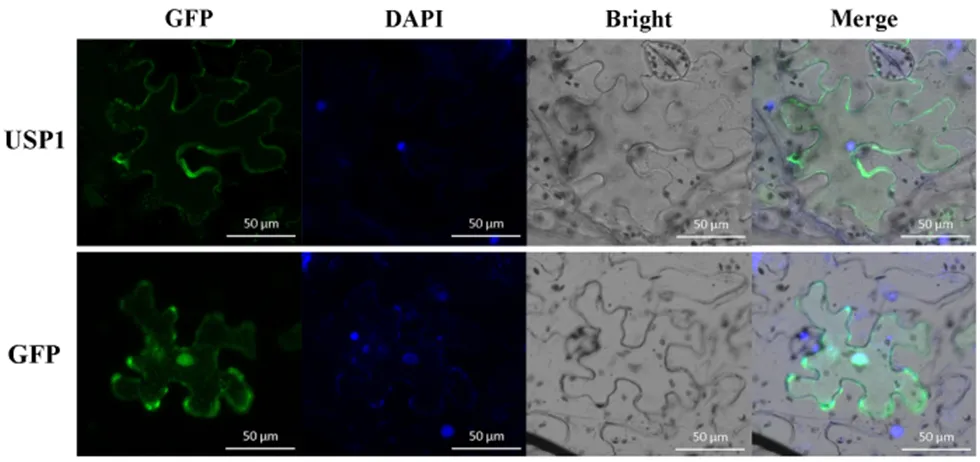
GFP, 绿色荧光蛋白;DAPI, 细胞核染料;Bright, 明视野;Merge, 叠加场。
Figure 2 Subcellular localization of USP1
2.3 USP1与DDB1存在相互作用
USP1蛋白与DDB1蛋白之间的相互作用通过酵母双杂交系统得到了验证。将PEG202:DDB1与PJG4-5:USP1共同转化到EGY48酵母感受态中,同时设置PEG202空载和PJG4-5:USP1的组合为负对照。可以明显观察到,在三缺显色培养基Gal/Raff (-Ura, -His, -Trp, X-gal)上,含有PEG202:DDB-1和PJG4-5:USP1质粒的EGY48酵母可以显现出蓝色(图4A),而负对照没有任何变色的迹象(图4C),同时正对照在三缺显色平板上可以正常显色(图4B)。说明USP1与DDB1在酵母中存在相互作用,但可能因为酵母是异源系统,所以USP1与DDB1的相互作用在酵母中表现得较弱。
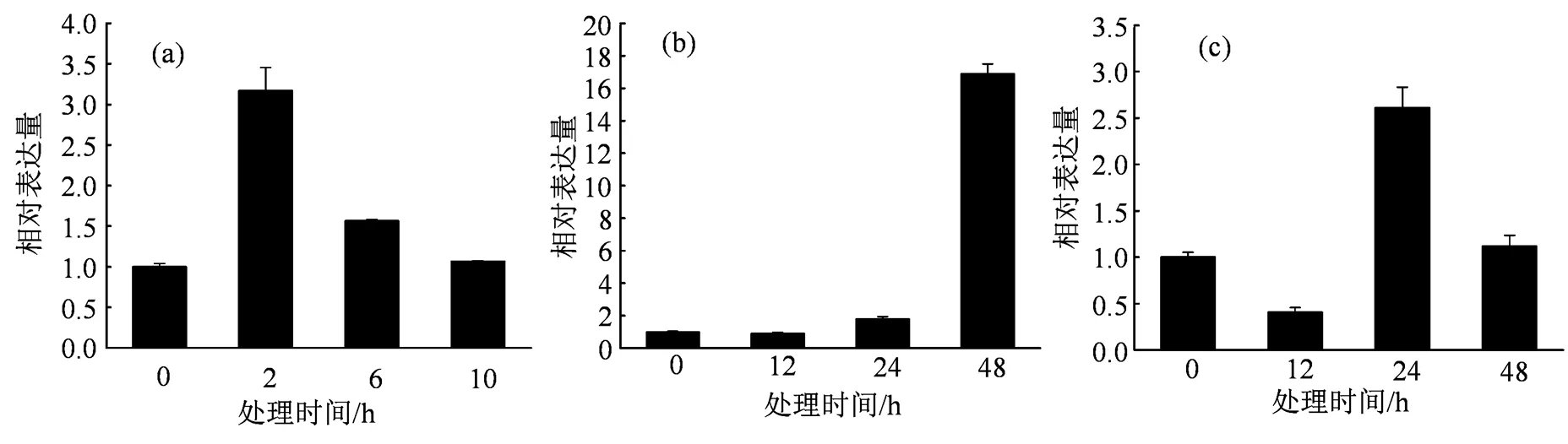
(a)热胁迫;(b)NaCl胁迫;(c)甘露醇胁迫。
Figure 3 Expression of1 under different stress
为了进一步验证USP1与DDB1的相互作用,我们进行了免疫共沉淀实验。在免疫共沉淀实验中,DDB1-HA和USP1-Flag在烟草叶片中共表达,同时以DDB1-HA和GFP-Flag共表达作为对照组。这几种蛋白在总蛋白(Input)中都可以检测得到,说明所有的蛋白在烟草瞬时表达系统中均正常表达。而在免疫沉淀部分(IP),则只能检测到USP1蛋白的存在,GFP蛋白未被检测到(图5)。这表明USP1-Flag蛋白连同Anti-HA 免疫磁珠和DDB1-HA蛋白一同被沉淀了下来,说明USP1蛋白与DDB1蛋白在植物细胞体内存在着相互作用,且相互结合能力较强。
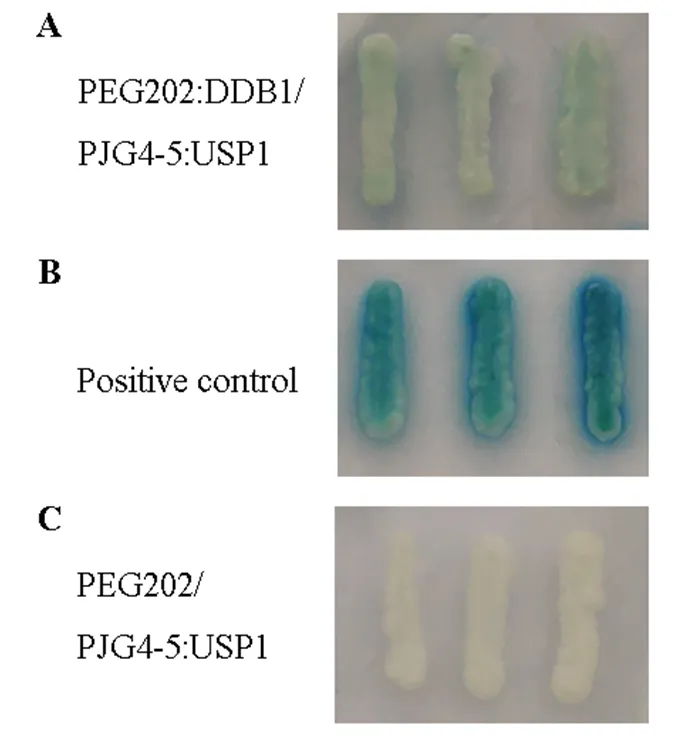
图4 USP1与DDB1在酵母中有相互作用
Figure 4 USP1 interacts with DDB1 in yeast
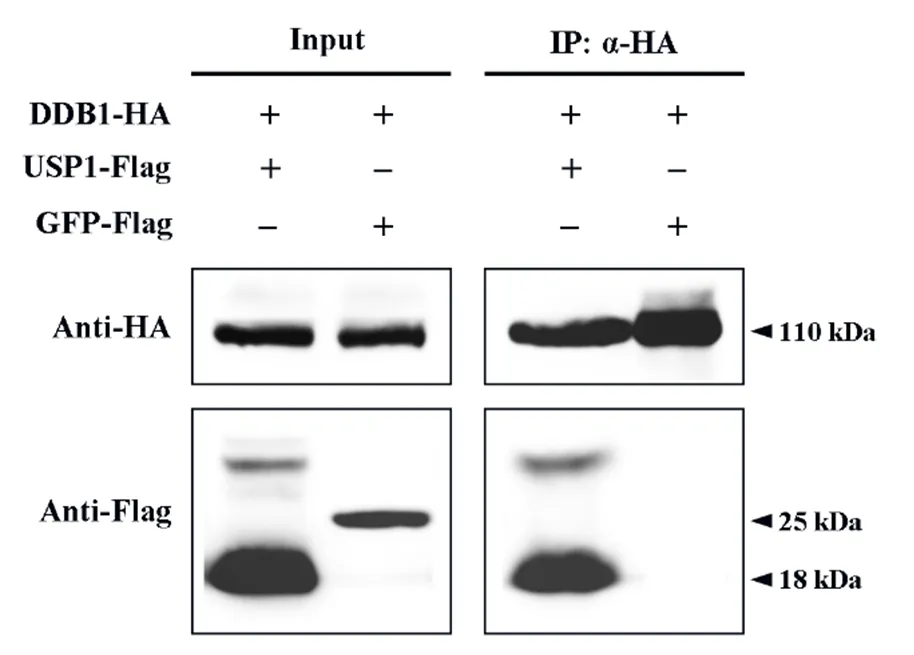
图5 USP1与DDB1的免疫共沉淀分析
Figure 5 Immuno-precipitation analysis of USP1 and DDB1
由酵母双杂交实验和免疫共沉淀实验可以得出USP1与DDB1之间确实存在着相互作用,这也为后面我们探究USP1的泛素化和功能性质奠定了基础。
2.4 USP1可以被泛素化
我们已经验证了USP1与DDB1之间存在着相互作用,而DDB1与CUL4可以形成CRL4泛素连接酶复合体[1],所以猜测USP1可以作为底物被CRL4泛素化修饰。为了探究USP1是否可以被泛素化修饰,将Ub-HA与USP1-Flag在烟草叶片中共同表达,同时设置Ub-HA与GFP-Flag作为对照组。由免疫共沉淀实验结果可知,Ub-HA与USP1-Flag可以被共同沉淀下来,在IP部分被检测到,同时USP1-Flag在IP部分的条带呈现出多泛素化修饰的典型弥散的状态,而作为对照组的其他两组合没有在IP部分中检测到条带(图6)。这说明了USP1可以与泛素分子结合受到多泛素化修饰。多泛素化修饰的蛋白经由26S蛋白酶体降解。
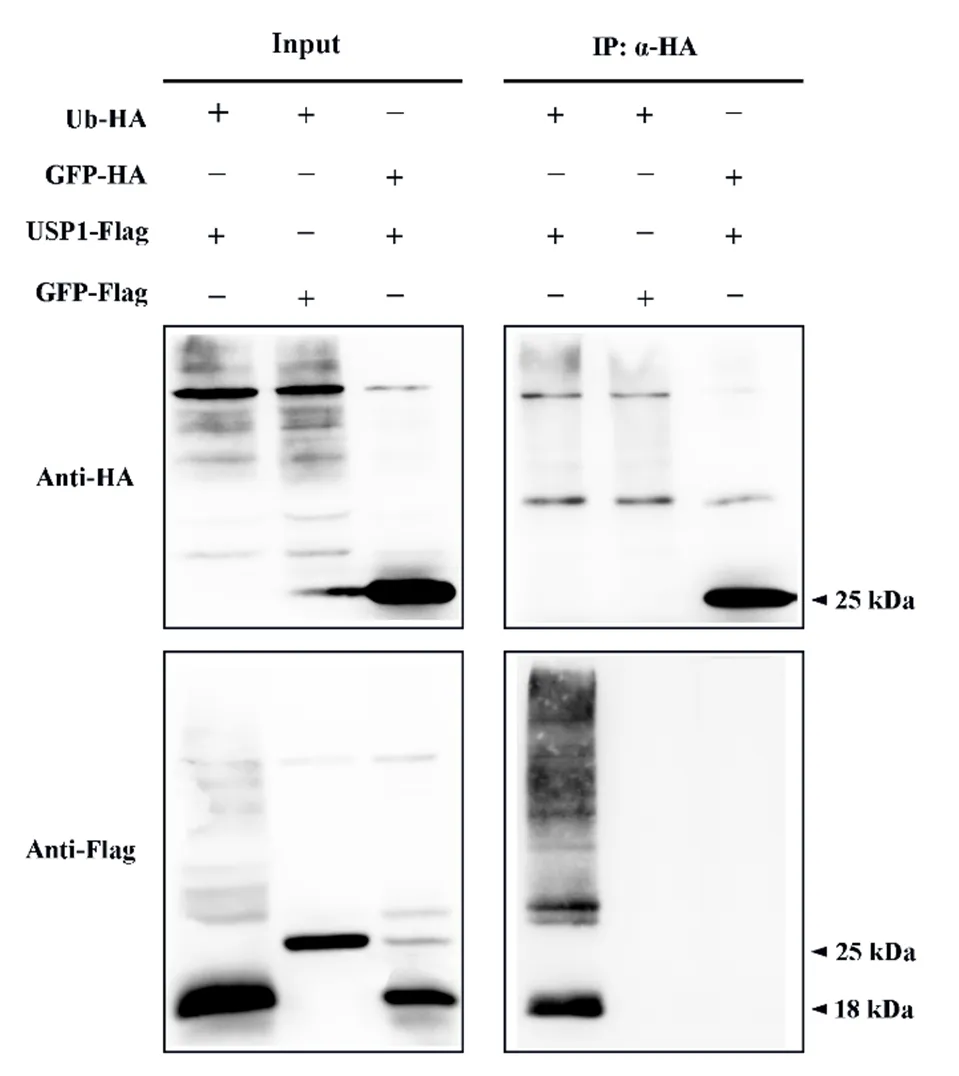
图6 USP1的泛素化实验
Figure 6 Ubiquitination of USP1
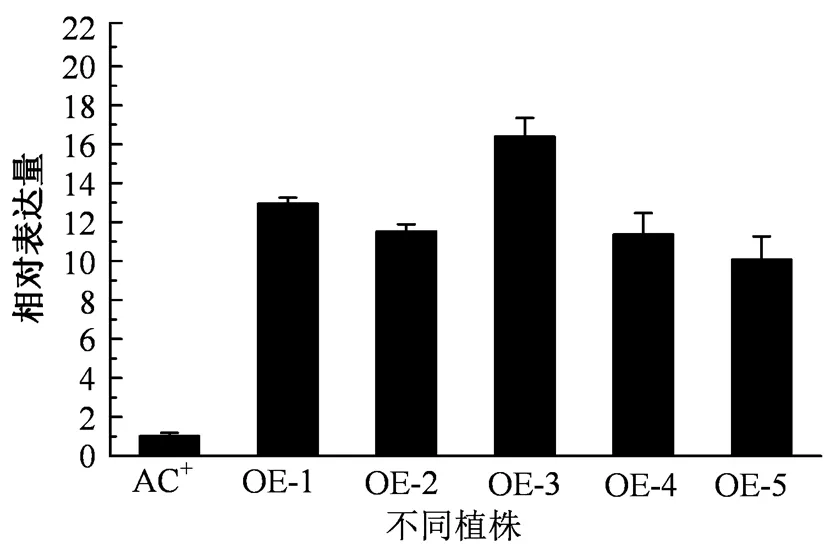
图7 USP1-OE植株RNA水平鉴定
Figure 7 RNA level identification of1-OE plants
2.5 过表达USP1可以提高番茄植株对于胁迫的耐受性
1在受不同胁迫环境中的诱导表达,干旱、高温、高盐胁迫条件下,基因表达量均有显著的提高。为了进一步验证1基因在对于番茄逆境胁迫中的生物学功能,利用根癌农杆菌介导的转化获得了1的过表达植株(1-OE),经过定量PCR鉴定,结果显示5个1-OE株系中1基因的表达上调,均为阳性株系(图7)。选取其中的3个株系用于胁迫实验,同时以野生型番茄(AC+)作为对照,胁迫实验选取4周龄健康植株。在高温胁迫处理5 d,干旱胁迫处理3周后,AC+与1-OE的生长状况出现了明显的差异,可以看到,相较于野生型番茄(AC+) (图8A, C) ,1-OE(图8B, D)的生长状态良好,这说明1的过表达可以显著提高番茄植株对于干旱以及高温胁迫的耐受性。此外,还选取了OE-2株系在1/2 MS培养基上进行了番茄种子萌发实验,在添加450 mmol·L-1的1/2 MS培养基上生长6 d后,OE-2株系的生长状况明显好于野生型,表现为OE-2株系根系的长度要明显比AC+长,同时,在不添加胁迫条件的1/2 MS培养基上,1过表达株系和野生型的生长状况无明显差异(图9),说明过表达1也可以增强番茄幼苗耐受干旱胁迫的能力。

A、C分别表示高温和干旱胁迫的野生OE-2植株;B、D分别表示高温和干旱胁迫的USP1-OE植株。
Figure 8 Overexpression of1 significantly enhanced tomato tolerance to high temperature and drought
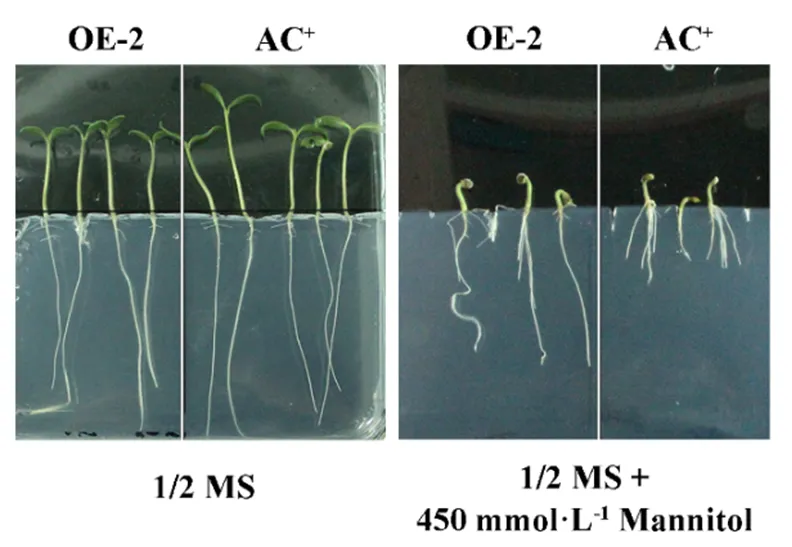
图9 USP1过表达对番茄幼苗生长发育的影响
Figure 9 Effects of1 overexpression on the growth and development of tomato seedlings
3 讨论与结论
在本研究中,我们分析了1的表达模式,发现1在番茄植株中表达广泛,通过亚细胞定位揭示了1主要在细胞质中表达。并且发现,1在环境胁迫的条件下,其表达量会发生变化,这种变化在干旱和高温胁迫中表现的尤为明显。这说明1在番茄遭受这几种环境胁迫时会发挥作用。为了探究1在番茄体内作用的机制,根据之前的研究发现,我们验证了USP1与DDB1之间的相互作用,而DDB1作为CRL4泛素连接酶复合体的关键组成部分[1],这种相互作用说明USP1可以作为底物被CRL4泛素化降解。泛素化实验印证了这一观点,USP1可以与泛素分子结合并且被泛素化修饰,但连接DDB1与USP1的接合蛋白DCAF在本研究中尚未探究。
根据之前的研究,USPs家族基因在包括拟南芥、烟草、水稻等多种植物中,都具有提高植物对于逆境胁迫耐受性的功能[8]。为了进一步说明1对于番茄植株在面对环境胁迫的具体作用,我们构建了1的过表达植株(USP1-OE),选取了干旱和高温胁迫对1-OE植株进行处理,实验结果印证了我们的假设,1-OE植株对于干旱和高温胁迫的耐受性要明显强于野生型(对照组)。同时,我们还发现1-OE植株在形态上与野生型番茄植株有明显的不同,过表达植株的叶片更宽,叶子的裂片更小,颜色更绿。这些形态上的差别极有可能是转基因植株抗逆性强的原因之一。
总而言之,1能够响应番茄植株遭受的各种环境胁迫,并且能够显著提高番茄植株对于干旱和高温胁迫的耐受性,但对于高盐胁迫的耐受性并未改变,500 mmol·L-1NaCl处理后,野生型与转基因植株生长状态相似。番茄植株在胁迫环境下,1的表达量会显著升高(图3),来响应外界胁迫,提升对于胁迫的耐受性,此时USP1蛋白的数量维持在一个较高的水平,而DDB1会进入细胞核中,启动其他抗逆基因的表达。当外界胁迫消失时,DDB1会进入细胞质中,此时USP1可以通过CUL4-DDB1组成的CRL4泛素连接酶复合体进行泛素化降解,通过泛素化的途径来维持USP1蛋白的数量在一个合适的水平,以保证植株的正常生长。下一步的研究方向是构建USP1的敲除转基因植株,结合1-OE植株,探究在逆境胁迫中,1对于下游的相关基因的表达和ROS、H2O2、植物激素等与抗逆相关的物质含量的影响,以及1转基因植株形态的差别对于其抗逆性的关系,构建一条完整的1对于番茄植株抗逆作用机制的通路。
[1] MIAO M, ZHU Y Y, QIAO M J, et al. The tomato DWD motif-containing protein DDI1 interacts with the CUL4-DDB1-based ubiquitin ligase and plays a pivotal role in abiotic stress responses[J]. Biochem Biophys Res Commun, 2014, 450(4): 1439-1445.
[2] 周少燕. 转录因子网络与植物对环境胁迫的响应分析[J]. 南方农业, 2016, 10(12): 177,180.
[3] VINOCUR B, ALTMAN A. Recent advances in engineering plant tolerance to abiotic stress: achievements and limitations[J]. Curr Opin Biotechnol, 2005, 16(2): 123-132.
[4] 乌凤章, 王贺新, 徐国辉, 等. 木本植物低温胁迫生理及分子机制研究进展[J]. 林业科学, 2015, 51(7): 116-128.
[5] KVINT K, NACHIN L, DIEZ A, et al. The bacterial universal stress protein: function and regulation[J]. Curr Opin Microbiol, 2003, 6(2): 140-145.
[6] SIEGELE D A. Universal stress proteins in Escherichia coli[J]. J Bacteriol, 2005, 187(18): 6253-6254.
[7] KERK D, BULGRIEN J, SMITH D W, et al. Arabidopsis proteins containing similarity to the universal stress protein domain of bacteria[J]. Plant Physiol, 2003, 131(3): 1209-1219.
[8] CHI Y H, KOO S S, OH H T, et al. The physiological functions of universal stress proteins and their molecular mechanism to protect plants from environmental stresses[J]. Front Plant Sci, 2019, 10: 750.
[9] WANG X F, SU J, YANG N, et al. Functional characterization of selected universal stress protein from(SmUSP) in Escherichia coli[J]. Genes (Basel), 2017, 8(9): E224.
[10] LI W T, WEI Y M, WANG J R, et al. Identification, localization, and characterization of putative USP genes in barley[J]. Theor Appl Genet, 2010, 121(5): 907-917.
[11] GONZALI S, LORETI E, CARDARELLI F, et al. Universal stress protein HRU1 mediates ROS homeostasis under Anoxia[J]. Nat Plants, 2015, 1: 15151.
[12] JUNG Y J, MELENCION S M, LEE E S, et al. Universal stress protein exhibits a redox-dependent chaperone function in Arabidopsis and enhances plant tolerance to heat shock and oxidative stress[J]. Front Plant Sci, 2015, 6: 1141.
[13] MELENCION S M B, CHI Y H, PHAM T T, et al. RNA chaperone function of a universal stress protein in Arabidopsis confers enhanced cold stress tolerance in plants[J]. Int J Mol Sci, 2017, 18(12): E2546.
[14] UDAWAT P, JHA R K, SINHA D, et al. Overexpression of a cytosolic abiotic stress responsive universal stress protein (SbUSP) mitigates salt and osmotic stress in transgenic tobacco plants[J]. Front Plant Sci, 2016, 7: 518.
[15] CHOU M X, WEI X Y, CHEN D S, et al. A novel nodule-enhanced gene encoding a putative universal stress protein from[J]. J Plant Physiol, 2007, 164(6): 764-772.
[16] MERKOUROPOULOS G, ANDREASSON E, HESS D, et al. An Arabidopsis protein phosphorylated in response to microbial elicitation, AtPHOS32, is a substrate of MAP kinases 3 and 6[J]. J Biol Chem, 2008, 283(16): 10493- 10499.
[17] 卢亮, 李栋, 贺福初. 蛋白质泛素化修饰的生物信息学研究进展[J]. 遗传, 2013, 35(1): 17-26.
[18] TANG X F, MIAO M, NIU X L, et al. Ubiquitin-conjugated degradation of golden 2-like transcription factor is mediated by CUL4-DDB1-based E3 ligase complex in tomato[J]. New Phytol, 2016, 209(3): 1028-1039.
[19] HOU P, REN P F, ZENG D E, et al. Differential expression patterns and a novel interaction factor of Damaged DNA Binding Protein 1A (DDB1A) and DDB1B in[J]. J Plant Biol, 2014, 57(4): 239-244.
[20] ANGERS S, LI T, YI X H, et al. Molecular architecture and assembly of the DDB1–CUL4A ubiquitin ligase machinery[J]. Nature, 2006, 443(7111): 590-593.
[21] HUA Z, VIERSTRA R D. The cullin-RING ubiquitin-protein ligases[J]. Annu Rev Plant Biol, 2011, 62: 299-334.
[22] ZHU Y Y, HUANG S X, MIAO M, et al. Genome-wide identification, sequence characterization, and protein-protein interaction properties of DDB1 (damaged DNA binding protein-1)-binding WD40-repeat family members in[J]. Planta, 2015, 241(6): 1337-1350.
[23] LIU J K, LI H J, MIAO M, et al. The tomato UV-damaged DNA-binding protein-1 (DDB1) is implicated in pathogenesis-related (PR) gene expression and resistance to[J]. Mol Plant Pathol, 2012, 13(2): 123-134.
[24] LIU J K, TANG X F, GAO L Y, et al. A role of tomato UV-damaged DNA binding protein 1 (DDB1) in organ size control via an epigenetic manner[J]. PLoS One, 2012, 7(8): e42621.
[25] GAO L Y, YANG S Z, ZHU Y Y, et al. The tomato DDI2, a PCNA ortholog, associating with DDB1-CUL4 complex is required for UV-damaged DNA repair and plant tolerance to UV stress[J]. Plant Sci, 2015, 235: 101-110.
Study on tomato1in response to drought and high temperature stress
ZONG Ning,ZHAO Huanlan,LIU Kui, LU Ruoxi,FAN Yezhen,MIAO Min
(School of Food and Biological Engineering, Hefei University of Technology, Hefei 230601)
As the core component of CUL4 ubiquitin ligase, DDB1 participates in many important biological processes. Our previous study found that tomato CUL4-DDB1 complex regulates abiotic stress response. In order to further clarify the regulatory mechanism and physiological function of DDB1 in plant stress resistance, we found that USP1 interacted with DDB1 through yeast two hybrid screening, and USPs family proteins were involved in improving the tolerance of organisms to stress. Further studies found that USP1 was located in the cytoplasm, and its gene expression was induced by a variety of stress conditions. In addition, ubiquitination experiments revealed that USP1 could be degraded by ubiquitination modification, and upregulation of1 expression led to the enhancement of plant resistance to drought and high temperature, indicating that1 may regulate tomato plant response to stress, and its role is regulated by the targeted degradation of CUL4-DDB1 ubiquitin ligase. The result not only reveal new mechanisms of plant stress resistance, but also provide new gene resources and technical approaches for plant stress resistance molecular breeding.
tomato;1; CUL4-DDB1; ubiquitination; environmental stress
S641.2; Q945.78
A
1672-352X (2021)06-0916-07
10.13610/j.cnki.1672-352x.20220106.006
2022-1-7 8:15:44
[URL] https://kns.cnki.net/kcms/detail/34.1162.S.20220106.1230.012.html
2021-02-24
国家自然科学基金(31970345,31701059)资助。
宗 宁,硕士研究生。E-mail:1412489149@qq.com
通信作者:苗 敏,副教授。E-mail:minmiao@hfut.edu.cn
