陆地棉转录因子GhWRKY91基因的原核表达及鉴定
2021-03-22顾丽姣魏恒玲喻树迅
顾丽姣,魏恒玲,喻树迅*
陆地棉转录因子基因的原核表达及鉴定
顾丽姣1,2,魏恒玲1,喻树迅1*
(1. 中国农业科学院棉花研究所,棉花生物学国家重点实验室,安阳 455000;2. 河北农业大学林学院,保定 071000)
为了筛选出高表达棉花GhWRKY91可溶性蛋白的原核表达载体。以中棉所10号叶片的cDNA为模板PCR扩增基因,扩增产物分别构建到4个不同的原核表达载体pET-22b(+)、pET-32a(+)、pMAL-c5x和pGEX-4T-1。将重组载体pET-22b(+)-、pET-32a(+)-、pMAL-c5x-和pGEX-4T-1-转化到大肠杆菌菌株BL21(DE3)或Arctic-Express™(DE3)RP中,IPTG诱导表达,SDS-PAGE电泳分析不同原核表达载体的蛋白表达情况。结果显示,pET-22b(+)-和pET-32a(+)-在BL21(DE3)中以及pMAL-c5x-在Arctic-Express™(DE3)RP中均未见明显蛋白表达,而pGEX-4T-1-在Arctic-Express™(DE3)RP中表达的蛋白基本存在于上清中,可获得可溶性蛋白。因此,将基因构建到pGEX-4T-1原核表达载体上可成功获得可溶性蛋白。
棉花;基因;SDS-PAGE;原核表达;表达分析
WRKY转录因子是植物中最大的转录调控因子家族之一[1]。WRKY转录因子的典型特征是包含1~2个由60个氨基酸残基构成的WRKY结构域,该结构域的N末端含有保守的WRKYGQK序列,C末端含有一个锌指结构域(Cx4–5Cx22–23HxH 或 Cx7Cx23HxC)。根据WRKY结构域的数目和锌指结构的特征,WRKY转录因子家族可以分为3个亚家族[1-2]。1994年Ishiguro等[3]从甘薯中克隆了第一个WRKY基因。随着测序成本的降低,越来越多物种的基因组数据被释放出来,这为鉴定更多的WRKY转录因子提供了基础。例如,目前分别在拟南芥中鉴定了74个[2]、水稻101个[4]、油菜145个[5]、陆地棉239个[6]和雷蒙德式棉120个[7]WRKY转录因子,并初步鉴定了它们在进化、植物发育和非生物胁迫中的功能。WRKY转录因子具有丰富的生物学功能,如拟南芥参与雄性不育[8],棉花参与盐和干旱胁迫[9],黄瓜参与病菌抵抗[10],日本黄连参与次生代谢物苯基异喹啉生物碱的合成[11],锦鸡儿参与调控叶片衰老[12]等过程。
高华等[13]通过原核表达苹果MdWRKY蛋白鉴定了其蛋白大小;刘蕾等[14]构建了银杏抗菌肽基因原核表达载体表达重组蛋白,鉴定了其抗菌活性;孙威[15]和刘裕峰[16]等分别构建了日本蛇根草基因和板栗基因的原核表达载体,鉴定了其重组蛋白的最佳诱导条件,为制备大量可溶性蛋白并进行功能研究奠定了基础;洪克前等[17]构建香蕉原核表达载体表达重组蛋白用于免疫新西兰兔获得多克隆抗体;程先坤等构建了水稻基因的全长和截断的原核表达载体表达重组蛋白,通过凝胶组织电泳和晶体生长解释W-box侧翼序列对WRKY蛋白核酸位点的偏好性的影响[18]。这些研究结果表明原核蛋白表达在研究蛋白质大小、蛋白纯化以及功能分析等方面具有重要的应用价值。
基因在生物胁迫、非生物胁迫、次生物质代谢和生长发育中发挥着重要作用,对WRKY转录因子进行原核表达有助于进一步研究蛋白的功能。棉花是世界上重要的纤维作物,为纺织工业提供了大量的天然纤维,研究基因在棉花中的功能具有重要的意义。本研究以中棉所10号为材料克隆基因,构建不同的原核表达载体表达GhWRKY91重组蛋白来获得可溶性蛋白,以期进一步阐明GhWRKY91蛋白的功能,为棉花育种提供理论基础和基因资源。
1 材料与方法
1.1 材料
棉花品种中棉所10号;大肠杆菌感受态BL21(DE3)购自天根生化科技有限公司,Arctic-Express™(DE3)RP感受态细胞来自南京钟鼎生物技术有限公司;原核表达载体pET-22b(+)和pET-32a(+)购自北京华越洋生物科技有限公司,pMAL-c5x和pGEX-4T-1来自南京钟鼎生物技术有限公司。
1.2 方法
1.2.1基因的克隆使用多糖多酚植物总RNA提取试剂盒(天根)提取中棉所10号叶片总RNA,用PrimeScript™ II 1st Strand cDNA Synthesis Kit(TAKARA)进行反转录。根据Dou等[19]提交到NCBI GeneBank中的(KF669793)序列设计原核表达引物,分别为:pET-22b(+)-上游引物:5'GAATTAATTCATG GACAGCGGTGGTAG-3',pET-22b(+)-下游引物:5'-GTGCGGCCGCGCAGATCCC AACCTGTGG-3';pET-32a(+)-上游引物:5'-GGCTGATATCATGGACAGCGGTGG T AG-3',pET-32a(+)-下游引物:5'-GTGCGG CCGCTCAGCAGATCCCAACCT-3';pMAL- c5x-上游引物:5'-GAAGGATTTCAATGGACAGCGGTGGTAG-3',pMAL-c5x-下游引物:5'-CAGG GAATTCTCAGCAG ATCCCAACCT-3';pGEX-4T-1-上游引物:5'-CGCATGGACAGCGGTGGTAG-3',pGEX- 4T-1-下游引物:5'-CCGCTCAGCA GATCCCAACCT-3'。用高保真酶PrimeSTAR® GXL DNA Polymerase(TaKaRa)从cDNA中PCR扩增基因并进行片段纯化。PCR的扩增条件为:98 ℃变性10 s,55 ℃退火15 s,68 ℃延伸1 min,30个循环。
1.2.2 原核表达载体的构建 原核表达载体pET-22b(+)和pET-32a(+)分别用HⅠ和d Ⅲ进行双酶切,pMAL-c5x用Ⅰ和HⅠ进行双酶切,pGEX-4T-1用HⅠ和Ⅰ进行双酶切,载体酶切后进行片段纯化。用 ClonExpress® Entry One Step Cloning Kit (C114)试剂盒将1.2.1中纯化的目的片段无缝连接到pET-22b(+)、pET-32a(+)和pMAL-c5x载体上,完成pET-22b(+)-、pET-32a(+)-和pMAL-c5x- GhWRKY91载体构建。同时,将用pGEX-4T-1-上游引物和pGEX-4T-1-下游引物PCR扩增的片段用HⅠ和Ⅰ双酶切,用T4连接酶连接到双酶切后的pGEX-4T-1载体上,完成pGEX-4T-1-载体构建[20]。
1.2.3 原核表达载体转化大肠杆菌感受态 将构建好的载体pET-22b(+)-和pET-32a(+)-转化至大肠杆菌感受态BL21(DE3)菌株,pMAL-c5x-和pGEX-4T-1-转化Arctic - Express™(DE3)RP菌株,涂布在含有氨苄抗生素的LB固体平板上,挑取单克隆测序,选取测序正确的单克隆用于原核蛋白表达。
1.2.4 原核蛋白表达和检测 目的菌株接种于30 mL含有氨苄抗生素的LB培养基中,37 ℃培养至OD600为0.6 ~ 0.8。取出1 mL的培养物12 000 r·min-1室温离心2 min,弃上清后用100 μL的1×上样缓冲液重悬菌体。向剩余培养物中加入终浓度为0.5 mmol·L-1的异丙基-β-D-硫代半乳糖苷(Isopropyl- β-D-thiogalactopyranoside, IPTG),20 ℃条件下220 r·min-1震荡培养4 h(含pMAL-c5x-载体的菌株为37 ℃条件震荡培养),诱导融合蛋白表达[20]。取出1 mL的培养物12 000 r·min-1室温离心2 min,弃上清后用100 μL的1×上样缓冲液重悬菌体。剩余培养物5 000 r·min-1室温离心10 min,弃上清,用PBS缓冲液重悬菌体。重悬液超声波破碎细胞,分别取上清液与沉淀液加入上样缓冲液重悬,进行12% SDS-PAGE检测分析,考马斯亮蓝染色显带。
2 结果与分析
2.1 pET-22b(+)-GhWRKY91融合蛋白在BL21(DE3)中的表达鉴定
基因的编码蛋白,预测的蛋白质的分子量为29.82 kDa。pET-22b(+)-融合蛋白在C-端含有His标签,包含标签的蛋白的分子量约为33 kDa。以未加入IPTG诱导剂的重组菌落做对照,在加入IPTG诱导剂20 ℃条件下诱导的重组菌和诱导破碎后的上清中均未检测到明显条带(图1)。在IPTG诱导破碎后的沉淀中检测到了条带,以蛋白包涵体表达(图1)。
2.2 pET-32a(+)-GhWRKY91融合蛋白在BL21(DE3)中的表达鉴定
pET-22b(+)-融合蛋白未见明显表达,将构建到另一载体含His标签的载体pET-32a(+)上,鉴定融合蛋白表达情况。在融合蛋白的N-端含有His标签,融合蛋白的分子量约为47 kDa。用IPTG诱导剂20 ℃条件下诱导融合蛋白表达。从SDS-PAGE结果可以看出,目标蛋白在对照,经IPTG诱导的菌体,IPTG诱导超声破碎后的上清和IPTG诱导超声破碎后的沉淀中均未见明显表达(图2)。
2.3 pMAL-c5x-GhWRKY91融合蛋白在Arctic- Express™(DE3)RP中的表达鉴定
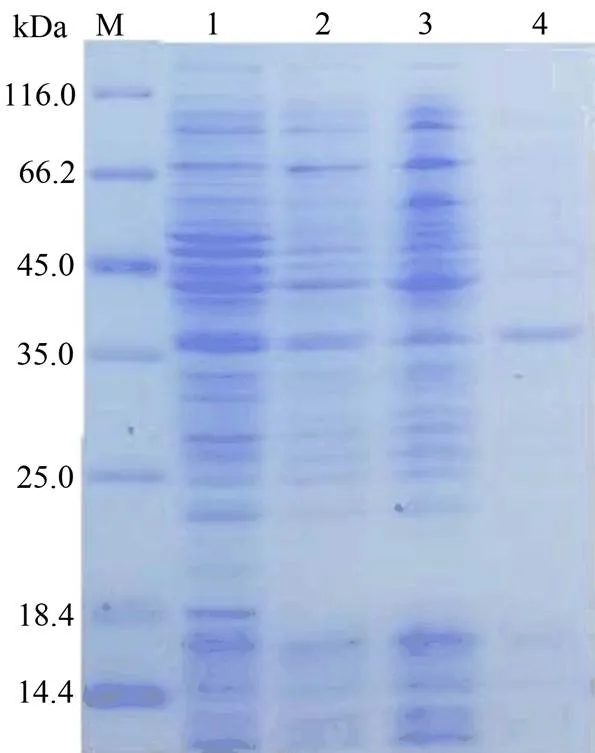
上述含有His标签的pET-22b(+)和pET-32a(+)均未得到可溶性蛋白,因此将构建到了含有麦芽糖结合标签(MBP-Tag)pMAL-c5x载体上。MBP可以减少目的蛋白的降解,提高目的蛋白的水溶性。融合蛋白的分子量约为74 kDa。结果显示,37 ℃条件IPTG诱导后,目标蛋白在对照、IPTG诱导的菌体、IPTG诱导超声破碎后的上清和IPTG诱导超声破碎后的沉淀中均未见明显表达(图3)。
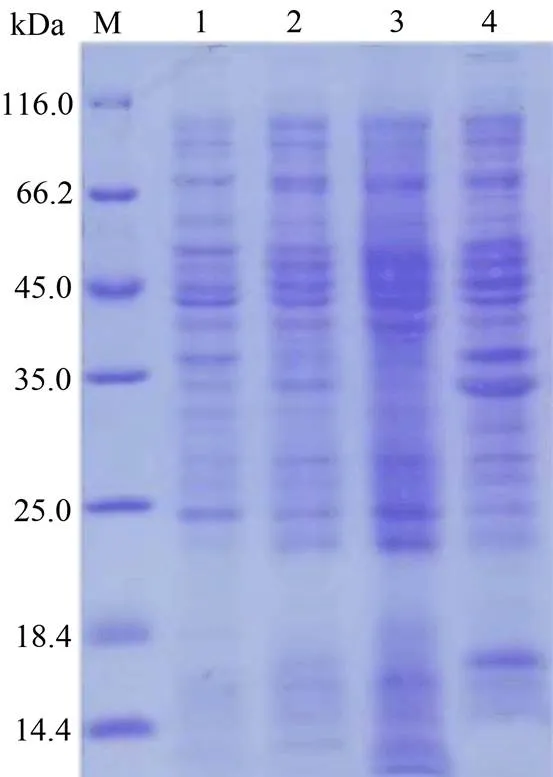
M,蛋白质分子质量标准;1.未经IPTG诱导的pET- 22b(+)-GhWRKY91;2. IPTG诱导pET-22b(+)- GhWRKY91;3. IPTG诱导pET-22b(+)-GhWRKY91超声波破碎后的上清;4. IPTG诱导pET-22b(+)-GhWRKY91超声波破碎后的沉淀。
Figure 1 SDS-PAGE analysis of pET-22b(+)-expression products
M, 蛋白质分子质量标准;1. 未经IPTG诱导pET-32a(+)- GhWRKY91;2. IPTG诱导pET-32a(+)-GhWRKY91;3. IPTG诱导pET-32a(+)-GhWRKY91超声波破碎后的上清;4. IPTG诱导pET-32a(+)-GhWRKY91超声波破碎后的沉淀。
Figure 2 SDS-PAGE analysis of pET-32a(+)-expression products
2.4 pGEX-4T-1-GhWRKY91融合蛋白在Arctic- Express™(DE3)RP中的表达鉴定
为了能够得到可溶性蛋白,我们将构建到了含有谷胱甘肽巯基转移酶标签(GST-Tag)的pGEX-4T-1载体上。GST也可以提高目的蛋白的水溶性。融合蛋白的分子量约为57 kDa。结果显示,20 ℃条件IPTG诱导后,融合蛋白在对照,IPTG诱导的菌体和IPTG诱导破碎后的沉淀中有少量表达,在IPTG诱导破碎后的上清中有相对较多的重组蛋白表达(图4),表明用pGEX-4T-1载体表达可以获得可溶性蛋白。

M,蛋白质分子质量标准;1.未经IPTG诱导的pMAL-c5x- GhWRKY91;2. IPTG诱导pMAL-c5x-GhWRKY91;3. IPTG诱导pMAL-c5x-GhWRKY91超声波破碎后的上清;4. IPTG诱导pMAL-c5x-GhWRKY91超声波破碎后的沉淀。
Figure 3 SDS-PAGE analysis of pMAL-c5x-expression products

M,蛋白质分子质量标准;1.未经IPTG诱导的pGEX-4T-1-GhWRKY91;2. IPTG诱导pGEX-4T-1- GhWRKY91;3. IPTG诱导pGEX-4T-1-GhWRKY91超声波破碎后的上清;4. IPTG诱导pGEX-4T-1-GhWRKY91超声波破碎后的沉淀。
Figure 4 SDS-PAGE analysis of pGEX-4T-1expression products
3 讨论与结论
前人在研究WRKY转录因子的功能过程中,通过构建基因的原核表达载体表达重组蛋白,利用凝胶阻滞电泳或制备免疫抗体进行染色质免疫共沉淀,进而鉴定和验证下游调控靶基因。例如在研究基因调控叶片衰老机制过程中,Miao等构建pQE30-原核表达载体表达重组蛋白,利用凝胶阻滞电泳验证了蛋白质体外结合实验获得的下游靶基因[21]。Gu等在研究调控叶片衰老通路过程中,将基因构建到pET-32a(+)原核表达载体表达重组蛋白免疫小鼠获得单克隆抗体,通过染色质免疫共沉淀测序技术获得了98个潜在靶基因,通过凝胶阻滞电泳验证到和是GhWRKY27的下游靶基因[22]。本研究的目的是构建基因的原核表达载体并成功表达可溶性蛋白,为后续研究的功能奠定基础。
甘玉迪等将多酚氧化酶基因()分别构建到含His标签的pET-32a(+)和含MBP标签的pMAL-c5x载体上,pET-32a(+)载体表达的蛋白出现在沉淀中,而pMAL-c5x载体可以在上清中表达可溶性蛋白[23]。胡威等研究了含有不同标签的原核表达载体对PR-1融合蛋白表达的影响,pET-30a和pET-P16P载体为包涵体表达,而pET-ELP载体为可溶性表达[24]。李赛赛等构建了7个含有不同标签的原核表达载体,其中含MBP标签的载体可以表达出高可溶性的VP2-LS3重组蛋白[25]。这些研究结果表明,对于一些包涵体表达或沉淀表达,可以通过更换具有不同标签的原核表达载体获得可溶性蛋白。本研究构建了基因的4个原核表达载体,包括含有His标签的载体pET-22b(+)和pET-32a(+)、含有MBP标签的pMAL-c5x以及含有GST标签的pGEX-4T-1。结果显示pGEX-4T-1载体可以使GhWRKY91蛋白在上清中成功表达,表明通过更换不同标签载体可以获得GhWRKY91的可溶性蛋白。MBP(麦芽糖结合蛋白标签)和GST(谷胱甘肽巯基转移酶标签)与His(组氨酸标签)标签相比,均属于高度可溶的标签蛋白,但是只有GST标签获得了可溶性蛋白,表明并不是所有的高度可溶标签蛋白都可以使重组蛋白进行可溶性表达[25-26]。
综上所述,本研究构建了基因的不同原核表达载体,经过诱导表达和SDS-PAGE检测,成功表达了GhWRKY91-GST可溶性融合蛋白,为进一步进行GhWRKY91的蛋白纯化和功能研究提供了基础。
[1] RUSHTON P J, SOMSSICH I E, RINGLER P, et al. WRKY transcription factors[J]. Trends Plant Sci, 2010, 15(5): 247-258.
[2] EULGEM T, RUSHTON P J, ROBATZEK S, et al. The WRKY superfamily of plant transcription factors[J]. Trends Plant Sci, 2000, 5(5): 199-206.
[3] ISHIGURO S, NAKAMURA K. Characterization of a cDNA encoding a novel DNA-binding protein, SPF1, that recognizes SP8 sequences in the 5' upstream regions of genes coding for sporamin and beta-amylase from sweet potato[J]. Mol Gen Genet, 1994, 244(6): 563-571.
[4] ROSS C A, LIU Y, SHEN Q J. The WRKY gene family in rice ()[J]. J Integr Plant Biol, 2007, 49(6): 827-842.
[5] KAYUM M A, JUNG H J, PARK J I, et al. Identification and expression analysis of WRKY family genes under biotic and abiotic stresses in[J]. Mol Genet Genom, 2015, 290(1): 79-95.
[6] MCKOWN A D, KLÁPŠTĚ J, GUY R D, et al. Ecological genomics of variation in bud-break phenology and mechanisms of response to climate warming in[J]. New Phytol, 2018, 220(1): 300-316.
[7] CAI C P, NIU E L, DU H, et al. Genome-wide analysis of the WRKY transcription factor gene family inand the expression of orthologs in cultivated tetraploid cotton[J]. Crop J, 2014, 2(2/3): 87-101.
[8] MUKHTAR M S, LIU X, SOMSSICH I E. Elucidating the role of WRKY27 in male sterility in Arabidopsis[J]. Plant Signal Behav, 2017, 12(9): e1363945.
[9] JIA H, WANG C, WANG F, et al. GhWRKY68 reduces resistance to salt and drought in transgenic[J]. PLoS One, 2015, 10(3): e0120646.
[10] LUAN Q, CHEN C, LIU M, et al. CsWRKY50 mediates defense responses toinfection in[J]. Plant Sci, 2019, 279: 59-69.
[11] YAMADA Y, SHIMADA T, MOTOMURA Y, et al. Modulation of benzylisoquinoline alkaloid biosynthesis by heterologous expression of CjWRKY1 incells[J]. PLoS One, 2017, 12(10): e0186953.
[12] WAN Y, MAO M, WAN D, et al. Identification of the WRKY gene family and functional analysis of two genes in[J]. BMC Plant Biol, 2018, 18(1): 31.
[13] 高华, 樊红科, 党志国, 等. ‘秦冠’苹果MdWRKY基因亚细胞定位及原核表达[J]. 园艺学报, 2011, 38(7): 1341-1348.
[14] 刘蕾, 何光志, 王文佳. 银杏抗菌肽蛋白基因原核表达及其重组蛋白的体内外抑菌作用研究[J]. 中国药房, 2019, 30(18): 2513-2518.
[15] 孙威, 林建, 申欢, 等. OjCHS原核表达载体的构建及重组蛋白的纯化[J]. 安徽农业大学学报, 2018, 45(6): 1102-1106.
[16] 刘裕峰, 朱天辉, 刘应高, 等. 板栗基因的克隆、序列分析与原核表达[J]. 华北农学报, 2019, 34(4): 37-45.
[17] 洪克前, 邝健飞, 陆旺金, 等. 香蕉果实转录因子基因的原核表达和多克隆抗体制备[J]. 园艺学报, 2010, 37(12): 1929-1936.
[18] 程先坤, 赵彦翔, 蒋青山, 等. 水稻转录因子WRKY45的重组表达、纯化和晶体生长[C]//中国植物病理学会2017年学术年会论文集. 泰安, 2017: 375.
[19] DOU L, ZHANG X, PANG C, et al. Genome-wide analysis of the WRKY gene family in cotton[J]. Mol Genet Genomics, 2014, 289(6): 1103-1121.
[20] GU L, MA Q, ZHANG C, et al. The cotton GhWRKY91 transcription factor mediates leaf senescence and responses to drought stress in transgenic[J]. Front Plant Sci, 2019, 10: 1352.
[21] MIAO Y, LAUN T, ZIMMERMANN P, et al. Targets of the WRKY53 transcription factor and its role during leaf senescence in Arabidopsis[J]. Plant Mol Biol, 2004, 55(6): 853-867.
[22] GU L, DOU L, GUO Y, et al. The WRKY transcription factor GhWRKY27 coordinates the senescence regulatory pathway in upland cotton (L.)[J]. BMC Plant Biol, 2019, 19(1): 116.
[23] 甘玉迪, 孙康, 李会娟, 等. 两种原核表达载体对CsPPO蛋白表达活性的影响[J]. 茶叶科学, 2018, 38(4): 396-405.
[24] 胡威, 卢会鹏, 张晓凯, 等. 盘尾丝虫ASP1蛋白佐剂活性区不同标签融合表达与佐剂活性比较[J]. 中国动物传染病学报, 2019, 27(3): 44-50.
[25] 李赛赛, 郭玉堃, 舒静超, 等. 鸡传染性法氏囊病病毒VP2蛋白可溶性原核表达及免疫原性分析[J]. 中国兽医学报, 2017, 37(12): 2281-2287
[26] 吴珊珊, 朱芸, 陈珊珊, 等. 融合标签在蛋白质可溶性表达中的应用进展[J]. 化工进展, 2014, 33(4): 993-998.
Prokaryotic expression and identification analysis of transcription factorgene in cotton ()
GU Lijiao1, 2, WEI Hengling1, YU Shuxun1
(1. State Key Laboratory of Cotton Biology, Institute of Cotton Research, Chinese Academy of Agricultural Sciences,Anyang 455000;2. College of Forestry, Hebei Agricultural University, Baoding 071000)
The study was aimed at screening out the prokaryotic expression vector with high expression of cotton GhWRKY91 soluble protein. Thegene was amplified by PCR using cDNA of CCRI10 leaves as template, and the amplified products were constructed into four different prokaryotic expression vectors, pET-22b(+), pET-32a(+), pMAL-c5x and pGEX-4T-1, respectively. The recombinant vectors, pET-22b(+)-, pET-32a(+)-, pMAL-c5x-and pGEX-4T-1-were transformed intostrains BL21(DE3) or Arctic-Express™(DE3)RP. The fusion protein expression was induced by IPTG, and SDS-PAGE electrophoresis was used to analyze the protein expression by different prokaryotic expression vectors. The results showed that no obvious protein expression was observed in pET-22b(+)-and pET-32a(+)-in BL21(DE3) and pMAL-c5x-in Arctic-Express™(DE3)RP. However, the protein expressed by pGEX-4T-1-in Arctic-Express™(DE3)RP was presented in the supernatant, and a soluble protein could be obtained. Therefore, GhWRKY91 soluble protein can be successfully obtained by constructinggene into the prokaryotic expression vector of pGEX-4T-1.
cotton;gene; SDS-PAGE; prokaryotic expression; expression analysis
S562
A
1672-352X (2021)06-0878-05
10.13610/j.cnki.1672-352x.20220106.012
2022-1-7 8:02:25
[URL] https://kns.cnki.net/kcms/detail/34.1162.S.20220106.1253.024.html
2019-09-06
国家棉花产业体系(CARS-15-06)和河北农业大学引进人才科研专项(YJ2021011)共同资助。
顾丽姣,博士。E-mail:gulijiao1990@126.com
通信作者:喻树迅, 研究员,博士生导师。E-mail:Ysx195311@163.com
