亚临床甲减与2型糖尿病患者颈动脉粥样硬化的关系
2021-03-22范月英黎克江刘新华
范月英 黎克江 刘新华
2型糖尿病(type 2 diabetes,T2DM)对机体健康主要危害是导致心血管不良事件发生,流行病学研究显示,T2DM的发病率可达(233~453)/10万人左右[1],在老年或肥胖/超重人群中,T2DM发病率进一步上升。亚临床甲状腺功能减退症(subclinical hypothyroidism,SCH)在老年人群尤其是老年女性中有较高的发病率,老年T2DM患者合并SCH比例较高,SCH通过影响脂代谢,导致氧化应激发生,促进单核细胞或巨噬细胞对血管内皮浸润,导致颈动脉粥样硬化(carotid atherosclerosis,CAS)的发生,增加患者不良预后风险[2-3]。部分研究已经证实合并SCH的T2DM人群急性冠脉综合征发病率明显上升,同时SCH还能增加T2DM患者肝肾功能受损风险[4-5],但对于颈动脉粥样硬化研究较少。为了评估SCH对T2DM患者发生颈动脉粥样硬化的影响,从而为合并SCH的T2DM患者诊治提供参考,本研究选取本院治疗的T2DM患者275例,观察合并SCH的T2DM患者生化指标及颈动脉粥样硬化发生情况,具体研究如下。
1 资料与方法
1.1 一般资料
纳入标准:(1)符合1999年WHO糖尿病诊断标准,分型为2型糖尿病。(2)亚临床甲状腺功能减退症符合诊断标准。(3)无认知功能障碍及精神疾病病史。排除标准:(1)糖尿病并发症急性期;(2)有甲状腺疾病史、正在服用甲状腺激素或抗甲状腺药物;(3)有明确心血管疾病史;(4)近1个月服用过调脂药物。本文收集本院2017年2月-2019年12月接受治疗的275例T2DM患者作为研究对象,其中单纯T2DM患者215例(对照组),合并SCH患者60例(观察组),观察组男32例,女28例,年龄46~67岁,平均(54.46±7.84)岁;对照组男112例,女103例,年龄42~65岁,平均(55.21±8.13)岁。两组上述一般资料比较差异无统计学意义(P>0.05)。患者均知情并同意参加本研究,且本研究经医院伦理委员会批准通过。
1.2 检测方法
患者于隔夜空腹安静状态下,采右上肢肘静脉血检测空腹静脉血糖(FPG)、糖化血红蛋白(HbA1c)、总胆固醇(TC)、甘油三酯(TG)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)、尿素氮(BUN)、肌酐(Scr)、谷丙转氨酶(ALT)、谷草转氨酶(AST),留尿化验尿白蛋白/尿肌酐(ACR),配套试剂购自南京博奥生物公司。
双侧颈动脉内膜中层厚度(IMT)采用东芝Aplio400超声诊断仪器进行诊断,探头扫描范围:从颈动脉根部至颈动脉主干,向上至颈动脉膨大以及分支处,在颈动脉膨大处1 cm内检测动脉血管内中膜的厚度。
1.3 统计学处理
本文得到的数据使用了SPSS 19.0软件包,其中计量资料以(±s)来描述,行t检验;计数资料行χ2检验;多因素分析采用Logistic回归分析。检验水准α=0.05,P<0.05为差异有统计学意义。
2 结果
2.1 观察组和对照组生化指标比较
观察组TC、LDL-C、ACR明显高于对照组,差异有统计学意义(P<0.05);两组FPG、HbA1c、HDL-C、ALT、AST、Scr和BUN比较,差异无统计学意义(P>0.05),见表1。
表1 观察组和对照组生化指标比较 (±s)

表1 观察组和对照组生化指标比较 (±s)
组别 FPG(mmol/L) HbA1c(%) TC(mmol/L) TG(mmol/L) HDL-C(mmol/L) LDL-C(mmol/L)观察组(n=60) 9.10±1.22 8.20±1.12 6.25±1.33 1.61±0.36 1.22±0.29 3.06±0.76对照组(n=215) 8.78±1.35 8.11±1.06 4.65±0.94 1.58±0.29 1.12±0.25 1.99±0.52 t值 1.657 0.574 7.418 0.594 1.346 -14.403 P 值 >0.05 >0.05 <0.05 >0.05 >0.05 <0.05
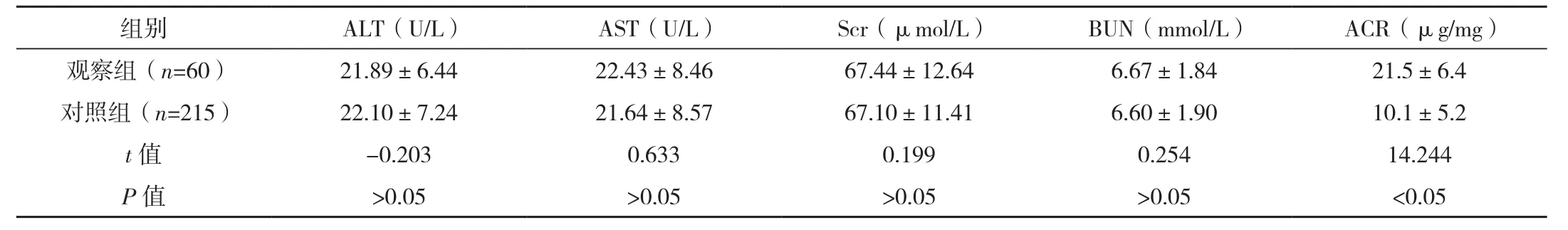
表1(续)
2.2 观察组和对照组双侧颈动脉IMT及CAS发生率比较
观察组双侧颈动脉IMT及CAS发生率明显高于对照组(P<0.05),见表2。

表2 观察组和对照组双侧颈动脉IMT及CAS发生率比较
2.3 多因素分析
以是否发生CAS为因变量,将性别、年龄、体重指数、 病 程、 高 血 压、FPG、HbA1c、TC、TG、HDL-C、LDL-C、ACR、BUN、Scr、ALT、AST及SCH作为自变量进行Logistic回归分析,结果显示高血压、年龄、糖尿病病程、TC和SCH是T2DM患者发生颈动脉粥样硬化的危险因素(OR=2.330、1.247、1.279、1.355和 2.565,P<0.001),见表 3。

表3 多因素分析结果
3 讨论
T2DM对健康主要危害是导致动脉粥样硬化、心血管不良事件的发生,SCH通过引起相关基础代谢紊乱、病理生理改变,增加患者总体生存预后恶化风险[6]。在合并SCH人群中,发生脑梗死、脑出血等脑血管疾病的风险增加15%以上[7],特别是在SCH病程大于5年、甲功未得到有效控制的患者中,发生心血管疾病或者脑血管疾病的风险更高[8]。本研究通过对合并SCH的T2DM患者相关临床病理改变的研究,能够为揭示该人群相关临床结局恶化的原因、控制心脑血管疾病进展速度、从而改善临床结局提供一定理论参考。
SCH本身不具有甲状腺功能减退症典型临床表现,但甲状腺激素相对不足可以引起肝脏对低密度脂蛋白胆固醇降解速度下降,导致低密度脂蛋白胆固醇升高,并增加了甘油三酯、总胆固醇代谢紊乱风险[9-10]。SCH能够促进泡沫细胞对颈动脉的侵蚀,促进颈动脉血管壁炎症因子的聚集及自身免疫复合物的沉积,导致血管脆性增加,增加血栓形成风险,导致脑缺血或者其他脑血管疾病的发生[11-12]。以往研究已经证实合并SCH的T2DM患者脑血管疾病发病风险增加[13],但有关T2DM合并SCH与颈动脉粥样硬化相关性缺乏可靠研究。
由于高血压或者高体重指数均能增加心血管疾病发病风险,增加本研究临床偏移度,本研究通过对不同病例组患者基础临床资料对比分析可见,两组一般临床资料如年龄、性别等差异无统计学意义(P>0.05),提示了本次研究的临床可信性。在分析不同代谢指标过程中,发现LDL-C、TC等脂代谢指标有明显差异,同时合并SCH的T2DM患者尿白蛋白/尿肌酐明显升高,考虑与SCH对于T2DM以下几方面影响有关:(1)SCH患者胆固醇降解速度减慢,合成速度增加,引起血脂异常。(2)SCH对于体内氧化应激性指标的上调作用,能够促进氧化还原酶对于肾脏组织的损伤,增加肾脏基底膜组织的通透性,导致尿蛋白漏出增多[14-15]。许本洋等[14]在探讨了SCH合并T2DM患者相关代谢指标后发现,合并SCH的T2DM患者尿白蛋白/尿肌酐明显升高,发生肾衰竭风险也上升2%以上。部分研究者认为,合并SCH时,患者的空腹血糖或者糖化血红蛋白等糖代谢指标有显著异常,但本研究并未发现SCH对于血糖代谢情况的影响,考虑可能与T2DM患者血糖控制情况、口服降糖药及皮下注射胰岛素有关。最后,本研究发现合并SCH的T2DM患者中,颈动脉内中膜厚度及颈动脉粥样硬化发生均明显高于单纯T2DM患者,证实SCH对颈动脉粥样硬化的影响。除高血压、年龄、糖尿病病程、TC是T2DM患者发生颈动脉粥样硬化的危险因素,多因素分析还发现SCH与颈动脉粥样硬化密切相关,进一步证实SCH与颈动脉粥样硬化的关系。
本研究创新在于研究了合并SCH的T2DM患者颈动脉粥样硬化的发生情况。本研究得出,SCH是T2DM患者发生CAS危险因素,因此,在T2DM诊治期间,不仅要积极控制血糖,还要重视患者甲状腺功能评价及颈动脉超声检查,及时发现并治疗SCH。
