质子泵抑制剂通过激活钙调神经磷酸酶诱发血管内皮炎症
2021-03-22张何坚鲍丽琴张学会孙鲁宁马梦圆程紫萍陈安九王永庆
张何坚,柏 蓉,鲍丽琴,张学会,孙鲁宁,马梦圆,程紫萍,陈安九*,王永庆*
1徐州医科大学江苏省新药研究与临床药学重点实验室,江苏 徐州 221004;2南京医科大学第一附属医院药学部,江苏 南京 210029;3江苏盛泽医院药学部,江苏 苏州 215228
质子泵抑制剂(如兰索拉唑)是一种强效胃酸抑制剂,前药形式的质子泵抑制剂因其良好的脂溶性可以经简单扩散自由通过细胞膜,进入胃壁细胞后在酸性环境中发生质子化,转变为次磺酰胺类活性形式,不可逆地抑制H+/K+⁃ATPase 的功能,阻止H+进入胃腔。因而对各种原因引起的胃酸分泌增加都有良好的抑制作用,是临床治疗消化性溃疡、胃食管反流病等酸相关性疾病的一线药物[1]。然而,随着此类药物临床应用越发广泛,其潜在的不良反应也逐渐显现。有研究指出,长期使用质子泵抑制剂可能增加骨质疏松等疾病的发生风险[2],还可能增加住院患者的病死率[3]。近年来,国内外学者逐渐关注质子泵抑制剂潜在的心血管风险。有研究指出,质子泵抑制剂会通过抑制CYP2C19酶的活性而影响氯吡格雷的活化,从而增加此类用药人群的心血管风险[4]。然而,也有研究报道,质子泵抑制剂的心血管风险可能与药物相互作用无关,因为在没有使用氯吡格雷的正常人群中,长时间使用质子泵抑制剂也会增加心血管事件的发生风险[5]。Yepuri 等[6]研究结果表明,长期使用质子泵抑制剂会通过抑制溶酶体酸化而加速内皮细胞衰老,而Ghebremariam 等[7]的研究证实,质子泵抑制剂可以显著增加内皮和血清中不对称二甲基精氨酸的含量,从而减弱一氧化氮合酶的血管保护作用。这些结果表明,质子泵抑制剂可能直接作用于血管内皮而影响其正常功能。有研究报道,质子泵抑制剂会增加细胞内游离钙离子浓度[8],而胞内钙离子稳态长期失衡可能活化钙调神经磷酸酶(calcineurin,CaN)并进一步诱导活化T 细胞核因子(nuclear fac⁃tor of activated T cell,NFAT)向细胞核内转移,引起组织功能障碍。另有研究报道,CaN 活化与血管内皮中白介素6(interleukin 6,IL⁃6)、细胞间黏附分子⁃1(intercellular adhesion molecule⁃1,ICAM⁃1)和血管细胞黏附分子⁃1(vascular cell adhesion molecule⁃1,VCAM⁃1)表达增加密切相关,这也是一部分血管毒性物质发挥作用的重要途径[9]。因此,本研究以内皮细胞中CaN为基础,探究质子泵抑制剂增加心血管风险的可能机制,为临床安全用药提供一定参考。
1 材料和方法
1.1 材料
人脐静脉内皮细胞(human umbilical vein endo⁃thelial cell,HUVEC)购自生工生物工程(上海)股份有限公司。
兰索拉唑标准品购于中国食品药品检定研究院(纯度:99.6%);DMEM 培养基(Gibco 公司,美国),胎牛血清(Biological Industries 公司,以色列);Trypsin⁃EDTA 消化液(Gibco 公司,美国);FK506(APExBIO 公司,美国);DMSO(Sigma 公司,美国);GAPDH 抗体、IL⁃6 抗体、HRP 标记山羊抗兔IgG、FITC标记驴抗兔IgG、抗荧光淬灭封片剂(武汉塞维尔生物科技有限公司);NFAT抗体、CaN抗体、ICAM⁃1抗体、VCAM⁃1抗体、Lamin B1抗体(Abcam 公司,英国);PMSF、RIPA裂解液、核蛋白浆蛋白提取试剂盒(上海碧云天生物技术有限公司);PVDF 膜(Mer⁃ck 公司,美国);化学发光液(Millipore 公司,美国);逆转录试剂盒(TaKaRa公司,日本),内参引物GAP⁃DH,其余引物由生工生物工程有限公司合成,引物序列信息见表1。
CO2培养箱HF100(上海力申科学仪器有限公司);涡旋震荡仪(Eppendorf 公司,德国);离心机(Eppendorf 公司,德国);倒置荧光显微镜IX73(Olympus 公司,日本),荧光显微镜LSM 5(德国Zeiss 公司);电泳仪PowerPacTMBASIC(Bio⁃Rad 公司,美国);酶标仪(Bio Tek公司,美国);实时荧光定量PCR 仪(Applied Biosystems 公司,美国);超声破碎仪(Sonics 公司,美国);化学发光图像分析系统Tanon 5200 Multi(上海天能科技有限公司);MilliQ超纯水机(Millipore公司,美国)。
1.2 方法
1.2.1 细胞培养及分组
HUVEC细胞贴壁生长,正常培养阶段使用含有1%双抗和10%胎牛血清的DMEM培养基进行培养,隔天换液。细胞给药阶段用含有0.1%DMSO、1%双抗和10%胎牛血清的培养基或相应的含药培养基进行培养,每天换液。细胞于37 ℃、含有5%CO2的培养箱中培养,当细胞生长至80%汇合时进行传代,传代比例为1∶2,取状态良好的对数生长期细胞进行实验。
第一阶段实验以兰索拉唑10 μmol/L 分别处理细胞0、24、48、72 和96 h,各处理组细胞间DMSO含量、总培养时间保持一致。第二阶段实验分为Veh 组、LPZ 组、FK506 组、LPZ+FK506 组共4 组。Veh 组为对照组;LPZ 组中含有10 μmol/L 兰索拉唑;FK506 组中含有1 μmol/L FK506;LPZ+FK506组中含有1 μmol/L的FK506和10 μmol/L的兰索拉唑,各组间DMSO含量保持一致,共同培养96 h。
1.2.2 qRT⁃PCR法检测各组细胞中IL⁃6、ICAM⁃1和VCAM⁃1 mRNA表达
用浓度为10 μmol/L 的兰索拉唑孵育细胞0、24、48、72、96 h后,用TRIzol试剂盒提取各组细胞的总RNA,调齐浓度后逆转录成cDNA。以每孔5 μL SYBR Green、0.2 μL 正向引物、0.2 μL 反向引物、3.6 μL 无酶水和1 μL 经稀释的cDNA 配成10 μL 反应体系。每个样本设置3 个复孔,上样结束后经4 ℃2 000 r/min离心5 min以除尽气泡。上机进行IL⁃6、ICAM⁃1 和VCAM⁃1 等基因的扩增,以GAPDH 为内参分析经不同时间药物作用后相关基因mRNA 表达水平的变化。
1.2.3 Western blot法检测蛋白表达
细胞经不同药物处理后,用RIPA 裂解液和核浆蛋白提取试剂盒(使用前2 min 内加入蛋白酶抑制剂)分别提取细胞总蛋白、核蛋白和浆蛋白。提取的蛋白用细胞破碎仪超声3~5 次,每次5 s,随后离心取上清。用BCA试剂盒测定蛋白浓度,调齐浓度后加入5×蛋白上样缓冲液煮沸10 min,变性后的蛋白样本立即使用或保存于-80 ℃冰箱。使用SDS⁃PAGE按照每孔35 μg的上样量进行电泳,待蛋白分离后停止电泳。用湿转法将蛋白转移至PVDF 膜上,室温条件下用5%脱脂奶粉溶液封闭90 min,经TBST 漂洗后放入相应的一抗中,4 ℃孵育过夜。次日用TBST缓冲液漂洗3次,每次10 min。室温条件下在摇床上孵育二抗约1 h,结束后仍用TBST 缓冲液漂洗3次,最后使用Tanon显色系统进行显影。以GAPDH 为内参,用Image J 软件对Western blot 条带进行半定量分析,各给药组目的蛋白的表达用对照组进行标准化。
1.2.4 免疫荧光
细胞经不同药物处理后,在室温条件下固定15 min,结束后用Triton 破膜15 min,弃去Triton,用山羊血清室温封闭1 h,结束封闭后加入一抗过夜,次日加入荧光二抗室温孵育1 h,PBS 漂洗3 次后用DAPI 染液对细胞核进行染色,3 min 后用PBS 洗净残余DAPI 染液,以488 nm 为激发波长在荧光显微镜下进行观察。
1.3 统计学方法
实验数据以均数±标准差()的形式表示,所有数据均使用SPSS 22.0 软件进行统计分析,多组间的比较使用单因素方差分析,P<0.05 为差异有统计学意义。每项实验均独立重复3 次,使用Graph⁃Pad Prism 5软件进行作图。
2 结果
2.1 兰索拉唑能时间依赖性激活CaN,并促进NFAT向核内转移
为了研究兰索拉唑长期作用对HUVEC 中CaN表达的影响,分别用兰索拉唑处理细胞24、48、72、96 h后,应用Western blot技术进行检测。结果如图1A 所示,兰索拉唑可以时间依赖性地上调细胞中CaN 蛋白的表达。此外,本研究进一步探索了细胞中NFAT 的表达情况。结果如图1B、C所示,兰索拉唑能减少细胞浆中NFAT的表达,并能时间依赖性上调细胞核中NFAT蛋白的表达,免疫荧光结果(图1D)与Western blot结果一致,共同说明兰索拉唑长期反复刺激会诱导细胞浆中的NFAT向细胞核内转移。
2.2 兰索拉唑诱导血管炎症,增加HUVEC 黏附分子表达
为了研究兰索拉唑对HUVEC 黏附分子和炎症因子表达的影响,分别用兰索拉唑处理细胞24、48、72、96 h 后,用Western blot 和qRT⁃PCR 技术进行检测。结果显示,兰索拉唑可以增加HUVEC 中IL⁃6蛋白的表达,且在96 h时最为明显(图2A、B)。兰索拉唑还可以时间依赖性增加ICAM⁃1 蛋白的表达(图2A、C),而对于VCAM⁃1,虽然未呈现时间依赖性,给药48、72、96 h 后蛋白表达也出现显著上调(图2A、D)。此外qRT⁃PCR 结果显示,兰索拉唑能时间依赖性增加ICAM⁃1 mRNA 的表达(图3B),而对于IL⁃6 及VCAM⁃1 mRNA 的表达水平,虽然未出现统计学差异,但随着给药时间的增加也出现了上调趋势(图3A、C)。这些结果共同说明长时间的兰索拉唑刺激可能诱发血管内皮炎症,并增加内皮细胞黏附。
2.3 CaN抑制剂能缓解兰索拉唑诱导的血管损伤
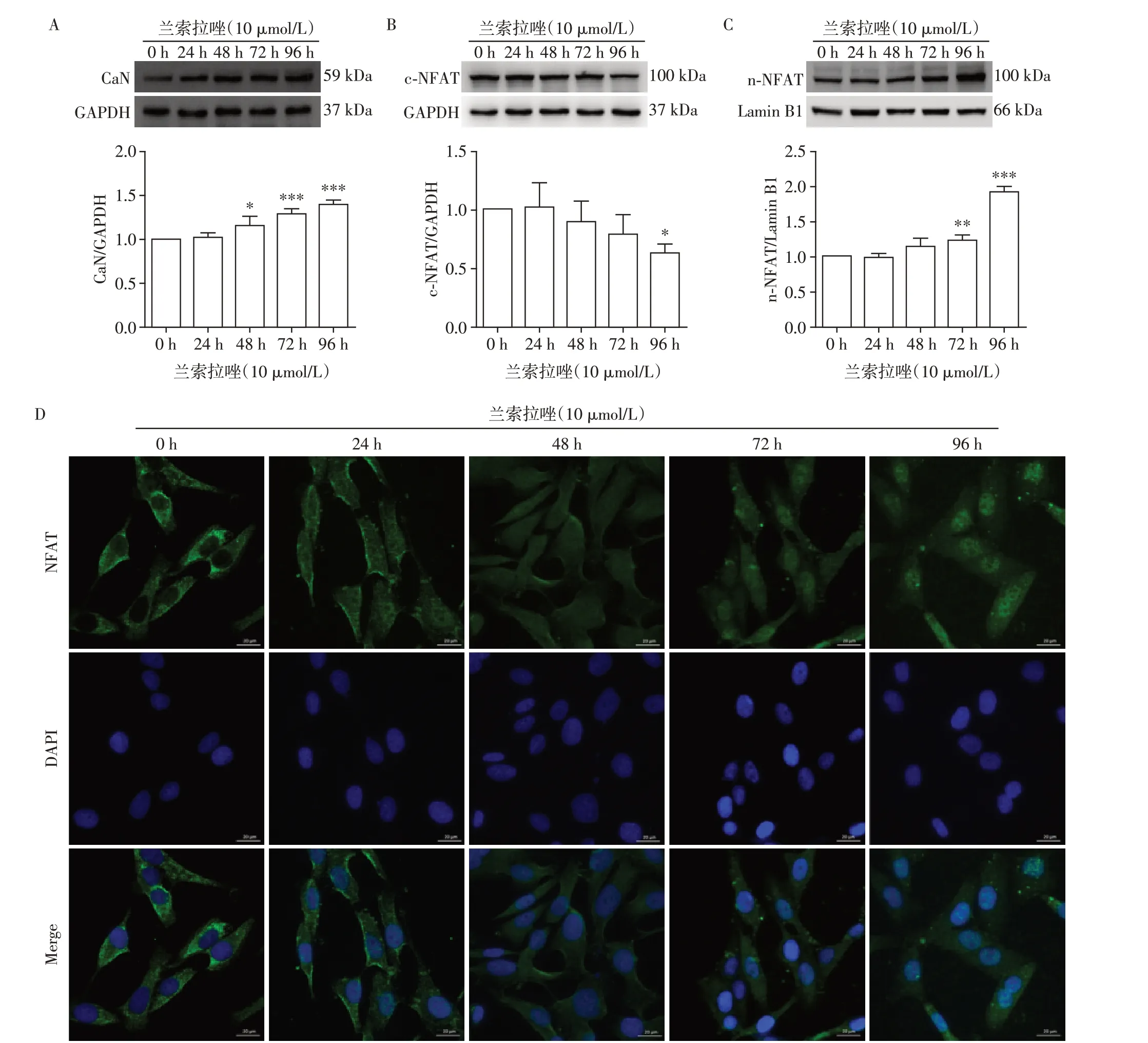
图1 各组HUVEC中CaN和NFAT的表达量Figure 1 Expression of CaN and NFAT of HUVECs in each group
为了进一步验证CaN 活化在兰索拉唑诱导的血管炎症中发挥的作用。本研究使用CaN 抑制剂FK506(1 μmol/L)单独或联合兰索拉唑共同孵育细胞96 h,并使用Western blot检测蛋白表达水平的变化。结果如图4A 所示,FK506 对兰索拉唑诱导的CaN表达升高有显著的抑制作用。图4B~D显示,与Veh 组相比,LPZ 组NFAT 的核转位显著增加,而FK506 组NFAT 的核转位情况无显著变化,LPZ+FK506 组NFAT 的核转位情况虽然也有升高,但是与LPZ 组相比升高幅度显著降低。此外,与Veh 组相比,LPZ组IL⁃6、ICAM⁃1和VCAM⁃1的蛋白表达量显著增加,而FK506组与LPZ+FK506组IL⁃6、ICAM⁃1和VCAM⁃1的蛋白表达量无显著变化(图5),说明兰索拉唑诱导的血管炎症及黏附增加与CaN 的激活密切相关。
3 讨论
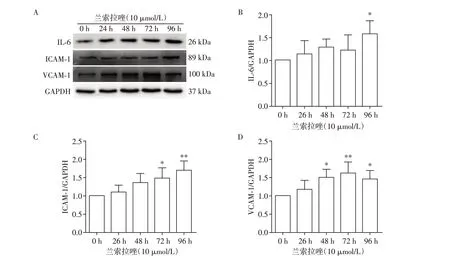
图2 Western blot 检测各组IL⁃6、ICAM⁃1、VCNM⁃1蛋白表达Figure 2 Expression of IL⁃6,ICAM⁃1 and VCAM⁃1 proteins in each group detected by Western blot

图3 qRT⁃PCR检测各组IL⁃6、ICAM⁃1、VCAM⁃1 mRNA Figure 3 mRNA of IL⁃6,ICAM⁃1,VCAM⁃1 in each group detected by qRT⁃PCR
质子泵抑制剂广泛用于治疗酸相关性疾病,临床使用量逐年增加,但在发挥强效抑酸作用的同时,其潜在的不良反应也逐渐引起人们的重视[10]。在心血管领域,质子泵抑制的潜在作用一直存在争议。Lin 等[11]指出,兰索拉唑可以通过抑制Akt/GSK3β/β⁃catenin 信号通路的激活而缓解高血压诱导的心脏重构。而Sehested 等[12]的研究发现,长期使用质子泵抑制剂会使缺血性脑卒中的风险增加13%,使急性心肌梗死的风险增加31%。Sun等[5]一项包含17 项RCT 的meta 分析表明,质子泵抑制剂可能增加患者心血管事件的发生风险,且在长期用药人群中风险会进一步增加。
心血管疾病是威胁人类生活的严重疾病之一,因心血管疾病死亡的人数占每年全球疾病死亡总人数的30%以上。而血管内皮炎症引起的内皮功能障碍是各种心血管疾病(动脉粥样斑块形成、心肌梗死等)发生发展的关键步骤[13]。正常情况下,炎症因子IL⁃6 和黏附分子ICAM⁃1 及VCAM⁃1 在血管组织中表达量较低,而发生内皮炎症时,表达量会显著升高[14]。Yu 等[9]的研究结果表明,在TNF⁃α诱导的内皮炎症中,CaN的激活发挥了关键作用,抑制CaN 可以显著减弱TNF⁃α诱导的NFAT 核转位,并降低IL⁃6、ICAM⁃1 和VCAM⁃1 的表达量。CaN 是一种钙调蛋白/钙离子依赖性的蛋白磷酸酶,在血管内皮中表达较为丰富。CaN对胞内钙离子变化有较高的敏感性,胞内钙离子升高会显著增加CaN 的表达并进一步诱导NFAT 向细胞核内转移[11]。Schil⁃linger等[8]的研究结果表明,质子泵抑制剂急性给药会减少内质网钙容量,并能显著增加心肌细胞中舒张期游离钙离子浓度,而长期使用质子泵抑制剂对血管内皮细胞中CaN的影响,尚未见报道。
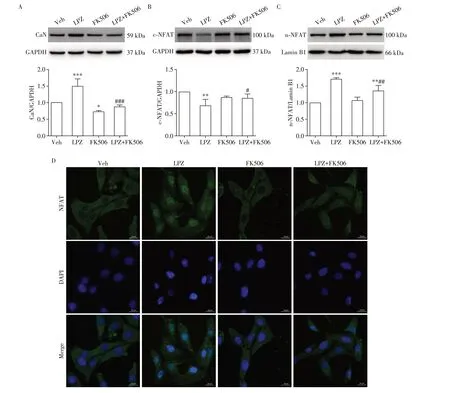
图4 FK506对兰索拉唑诱导的HUVEC中CaN和NFAT表达的影响Figure 4 The effects of FK506 on expression of CaN and NFAT induced by lansoprazole in HUVECs
在本研究中,用兰索拉唑孵育HUVEC 不同时间后发现,兰索拉唑能时间依赖性地增加CaN 的表达,并显著增加NFAT的核转位。此外,兰索拉唑还能显著增加HUVEC 中IL⁃6、ICAM⁃1 及VCAM⁃1 的表达,提示兰索拉唑长时间作用能激活CaN 并进一步诱发血管内皮炎症。为了进一步验证兰索拉唑诱导的血管炎症与CaN 激活的相关性,本研究将CaN抑制剂FK506单独或联合兰索拉唑共同作用于细胞96 h。结果显示,1 μmol/L 的FK506 单独作用于HUVEC 96 h后对NFAT的核转位没用影响,也不会增加IL⁃6、ICAM⁃1 和VCAM⁃1 蛋白的表达,但是它能显著减弱由兰索拉唑诱导的NFAT 核转位,并能很大程度上抑制由兰索拉唑诱导的IL⁃6、ICAM⁃1和VCAM⁃1 表达增加,这些结果进一步证实了兰索拉唑诱导的血管内皮炎症和细胞黏附增加与CaN的活化有较大相关性。

图5 FK506对兰索拉唑诱导的HUVEC 中IL⁃6、ICAM⁃1、VCAM⁃1表达的影响Figure 5 The effects of FK506 on the expression of IL⁃6,ICAM⁃1 and VCAM⁃1 induced by lansoprazole in HUVECs
虽然质子泵抑制剂在发挥抑酸作用时需要先被活化,但考虑到体循环及血管内皮细胞内的pH不足以使质子泵抑制剂发生质子化,因此本研究采用兰索拉唑的原型药物进行实验符合药物在体内的实际情况。以往在研究兰索拉唑心血管效应时较少关注该药物对心肌细胞或血管内皮细胞的长期影响[8,11],而心血管不良事件往往发生在长期使用质子泵抑制剂的患者中[12]。本研究通过比较不同时间的兰索拉唑对HUVEC 的作用,探讨质子泵抑制剂产生心血管效应的潜在规律,为临床质子泵抑制剂的安全使用提供参考。
综上所述,临床相关浓度的兰索拉唑可能诱导血管内皮炎症,并增加内皮细胞黏附,且这一作用与内皮细胞中CaN 的活化密切相关。本研究表明CaN可作为预防质子泵抑制剂相关心血管不良反应的潜在靶点,值得进行更加全面和深入的研究,这对于促进质子泵抑制剂在临床的安全合理使用具有重要意义。
