YY1 通过下调长链非编码RNA SOX2OT 抑制胰腺癌细胞的迁移和侵袭
2021-03-22汪冬艳张静静
汪冬艳,张静静
1南京医科大学第一附属医院普外科,江苏 南京 210029;2南京中医药大学附属中西医结合医院,江苏省中西医结合医院普外科,江苏 南京 210028
转录因子YY1是锌指蛋白家族中的一员,参与了许多生物学和生理过程,包括胚胎发生、细胞增殖、DNA复制和分化等[1-3]。本课题组先前研究表明YY1 在胰腺癌中具有抑癌作用[4-5]。染色质免疫共沉淀⁃ 测序(chromatin immunoprecipitation high ⁃throughput sequencing,ChIP⁃seq)结果表明YY1可以直接与长链非编码RNA SOX2OT的启动子区结合[6],表明YY1 可能调控SOX2OT 的转录,SOX2OT 可能参与胰腺癌的发生和进展。本研究以人胰腺癌细胞株BXPC⁃3 和PANC⁃1 为研究对象,探讨YY1/SOX2OT 轴在胰腺癌细胞迁移和侵袭中的作用,为YY1作为胰腺癌早期诊断、预后及治疗的靶标提供理论依据。
1 材料和方法
1.1 材料
人胰腺癌细胞株BXPC⁃3 和PANC⁃1 购于上海细胞所;YY1过表达及YY1干扰的稳转细胞株由本实验室构建及保存[4];PBS、胰酶、DMEM 高糖培养基、胎牛血清(Wisent 公司,加拿大);双抗(青、链霉素)、RIPA 细胞裂解液、PMSF、BCA 蛋白浓度测定试剂盒、GAPDH 抗体、二抗(上海碧云天);TRIzol、Lipofectamine 3000 转染试剂(Invitrogen 公司,美国);反转录试剂盒、SYBR green master mix、蛋白Marker(Bio⁃Rad公司,美国);PVDF膜、ECL试剂盒、Transwell 小室(Millipore 公司,美国);Matrigel 基质胶(BD公司,美国);细胞培养耗材(Corning公司,美国);YY1抗体(Abcam公司,美国);其他常用试剂均为国产分析纯;引物由上海吉玛设计合成;siRNA片段由广州锐博设计合成;定量PCR 仪为美国ABI Stepone plus 型号;倒置荧光显微镜为美国Nikon Ti⁃E 型;成像分析系统为美国Protein simple Fluo⁃rchem 型。
1.2 方法
1.2.1 细胞培养
BXPC⁃3 和PANC⁃1 细胞使用含10%胎牛血清、50 U/mL青霉素和50 mg/mL链霉素的DMEM高糖培养基,在37 ℃、5%CO2饱和湿度下培养,待细胞融合率为70%左右时,以0.25%胰蛋白酶、0.02%乙二胺四乙酸消化、传代。
1.2.2 定量RT⁃PCR
使用TRIzol试剂抽提细胞总RNA。分光光度法测定浓度后,根据说明,使用1 μg 总RNA 和iscript cDNA 合成试剂盒在20 μL 的最终体积中进行逆转录(RT)。采用SYBR green master mix 在定量PCR仪中进行定量PCR。采用2-ΔCt法,即用YY1/SOX2OT(靶基因)的Ct 值减去GAPDH(内参基因)的Ct值,计算相对基因表达量。每一个定量PCR均设置3 个复孔,独立重复3 次。YY1 上游引物:5′⁃CTTTTCACTGGACTTCAATTTGCG⁃3′;下游引物:5′⁃CACTGGTTGTTTTTGGCCTTAGC⁃3′;SOX2OT 上游引物:5′⁃AGACAGCTCTGTTCAGTATT⁃3′;下游引物:5′⁃TTACACCAGCCTCCAAGA⁃3′;GAPDH 上游引物:5′⁃ACGGGAAGCTTGTCATCAAT⁃3′;下游引物:5′⁃TGGACTCCACGACGTACTCA⁃3′。
1.2.3 Western blot
使用RIPA 细胞裂解液抽提细胞总蛋白,并用BCA 蛋白浓度测定试剂盒测定浓度。蛋白加1 ×SDS 上样缓冲液后于100 ℃水浴5 min,取20 μg 进行SDS⁃PAGE 电泳,而后把蛋白质转移至PVDF 膜上,5%脱脂奶粉封闭2 h,加入1∶1 000 一抗,4 ℃过夜,TBST 洗涤3 次,加二抗(1∶2 000)室温孵育1 h,TBST洗3次,然后用ECL化学发光试剂于暗室自显影。用成像分析系统拍照记录并进行灰度分析。
1.2.4 细胞划痕实验
先用记号笔在6 孔板背面划横线,每隔0.5~1.0 cm一道,横穿过孔;每孔至少穿过5条线。在孔中加入5×105个细胞。第2 天用枪头垂至于背后的横线划痕。PBS洗细胞3次,去除划下的细胞,加入无血清培养基,放入37 ℃、5%CO2培养箱培养。按0 h、24 h时间点取样,拍照。
1.2.5 Transwell细胞侵袭实验
将Matrigel 1∶8稀释,包被Transwell小室底部膜的上室面,置37 ℃30 min,使Matrigel 聚合成凝胶。使用前进行基底膜水化。细胞撤血清饥饿12 h后,消化细胞,调整细胞密度至5×105个/mL,取细胞悬液100 μL 加入Transwell 小室。24 孔板下室加入600 μL含20%胎牛血清的培养基,放入37 ℃5%CO2培养箱培养24 h。随后取出Transwell 小室,弃去孔中培养液,PBS洗2遍,甲醇固定30 min,将小室适当风干。0.1%结晶紫染色20 min,用棉签轻轻擦掉上层未侵入细胞,用PBS洗3遍。400倍显微镜下随机5个视野观察细胞,记数。
1.2.6 SOX2OT过表达慢病毒及稳转细胞株构建
SOX2OT过表达慢病毒及其对照病毒由上海和元公司构建。将全长人SOX2OT 亚克隆入pLenti⁃CMV⁃MCS⁃3FLAG H155载体,测序验证。YY1过表达BXPC⁃3细胞(BXPC⁃3⁃YY1)感染SOX2OT过表达慢病毒或对照慢病毒。6~8 h 后换液并在荧光显微镜下观察荧光,批量扩增培养后用嘌呤霉素进行细胞筛选,加药浓度由低到高,直至细胞正常培养状态,筛选出稳转细胞株(BXPC⁃3⁃YY1⁃SOX2OT 和BXPC⁃3⁃YY1⁃Vector)。定量RT⁃PCR 证实SOX2OT表达。
1.2.7 SOX2OT siRNA干扰片段转染及筛选
转染前1 d 铺6 孔板(每孔3×105个细胞),长至50%~70%进行转染;Lipofectamine 3000 法体系(每孔)如下:分别以裸培125 μL+siRNA 5 μL,裸培125 μL+Lipofectamine 3000 5 μL两个预混液,各自充分混匀,静置5 min;将两者混合后再次静置15 min,加入换了新鲜完全培养基的6 孔板中;转染24 h 后换液,2~3 d后提取RNA用定量RT⁃PCR进行转染效率验证。3组SOX2OT干扰片段靶序列如下:siRNA⁃1 5′⁃CAAAATAGGTCATAGCAA⁃3′、siRNA⁃2 5′⁃GGA⁃CAAG⁃ACAACATTTGGT⁃3′、siRNA⁃3 5′⁃CTCAC⁃CAATGCTTTAT⁃TCT⁃3′。
1.3 统计学方法
采用SPSS15.0进行统计分析。定量数据显示为平均值±标准差()。两组数据比较采用t检验。多组数据比较采用ANOVA⁃SNK检验。所有的统计检验都是双尾检验,P<0.05为差异有统计学意义。
2 结果
2.1 YY1对胰腺癌细胞中SOX2OT表达的调控
定量PCR及Western blot结果表明:YY1过表达及YY1干扰的稳转细胞株(BXPC⁃3和PANC⁃1)构建成功。定量PCR 结果显示:与对照组相比,YY1 过表达组的BXPC⁃3和PANC⁃1细胞中SOX2OT表达水平被显著抑制(P<0.05,图1),相反,YY1 干扰组SOX2OT 表达水平与对照组相比显著增加(P<0.05,图1)。
2.2 YY1对胰腺癌细胞迁移与侵袭能力的影响
细胞划痕实验结果表明:与对照组相比,YY1过表达抑制BXPC⁃3 细胞的迁移,相反YY1 干扰促进细胞的迁移(图2A)。Transwell 细胞侵袭实验结果表明:与对照组相比,YY1 过表达组穿过基质胶的细胞数显著减少(P<0.05,图2B),相反YY1干扰组穿过基质胶的细胞数与对照组相比显著增加(P<0.05,图2B)。
2.3 SOX2OT对YY1的功能回复作用
为了证明SOX2OT是否介导了YY1抑制胰腺癌细胞迁移和侵袭的作用,在YY1 过表达的BXPC⁃3细胞中过表达SOX2OT,或在YY1敲低的BXPC⁃3细胞中干扰SOX2OT 的表达,观察其是否具有功能回复作用。定量PCR 结果表明:过表达SOX2OT 稳转细胞株构建成功(图3A);3 组SOX2OT 干扰片段中siRNA⁃1 的干扰效率最高(图3B),因此后续功能回复实验选择siRNA⁃1。细胞划痕实验结果表明:在YY1过表达的BXPC⁃3细胞中过表达SOX2OT,可以逆转过表达YY1 抑制细胞迁移的作用(图3C);在YY1敲低的BXPC⁃3细胞中干扰SOX2OT的表达,可以逆转YY1 敲低促进细胞迁移的作用(图3D)。Transwell 细胞侵袭实验结果表明:在YY1过表达的BXPC⁃3 细胞中过表达SOX2OT,可以逆转过表达YY1 抑制细胞侵袭的作用(图4A);在YY1 敲低的BXPC⁃3细胞中干扰SOX2OT的表达,可以逆转YY1敲低促进细胞侵袭的作用(图4B)。

图1 定量PCR及Western blot检测YY1过表达或干扰后胰腺癌细胞BXPC⁃3和PANC⁃1中YY1及SOX2OT mRNAFigure 1 qRT⁃PCR and Western blot analyzed of YY1 and SOX2OT mRNA and protein expression in BXPC⁃3 and PANC⁃1 pancreatic cancer cells with YY1 overexpressing or knockdown

图2 YY1过表达或干扰对BXPC⁃3细胞迁移和侵袭能力的影响Figure 2 Effects of YY1 overexpression or interference on migration and invasion of BXPC⁃3 cells
3 讨论
在本研究中发现YY1过表达抑制,而YY1干扰促进胰腺癌细胞中长链非编码RNA SOX2OT 的表达;YY1 过表达抑制、而YY1 干扰促进胰腺癌细胞的迁移和侵袭。功能回复实验结果表明:在YY1过表达的胰腺癌细胞中过表达SOX2OT,或者在YY1敲低的细胞中干扰SOX2OT的表达,可以逆转YY对胰腺癌细胞迁移和侵袭的作用,YY1 通过下调SOX2OT表达抑制胰腺癌细胞的迁移和侵袭。
YY1 对肿瘤的促进或抑制作用与其参与癌基因、抑癌基因、血管生成相关因子和抗细胞凋亡途径密切相关[7]。一方面,YY1 可以通过上调癌基因(如c⁃myc和血管内皮生长因子)的表达,下调抑癌基因(如P53 和E⁃cadherin)的表达发挥促癌作用[8-11]。另一方面,YY1 可以通过上调抑癌基因(如HLJ1 与BRCA1)发挥抑癌作用,并通过直接作用抑制癌基因c⁃myc的功能[12-14]。因此,YY1可以作为一种抑癌基因或癌基因,这取决于组织类型、与其相互作用的蛋白因子及下游靶基因。本课题组先前研究表明YY1 在胰腺癌中具有抑癌作用[4-5]。ChIP⁃seq 结果表明YY1 可以直接与SOX2OT 的启动子区结合,提示YY1 可能调控SOX2OT 的转录,SOX2OT 可能参与胰腺癌的癌变和进展。
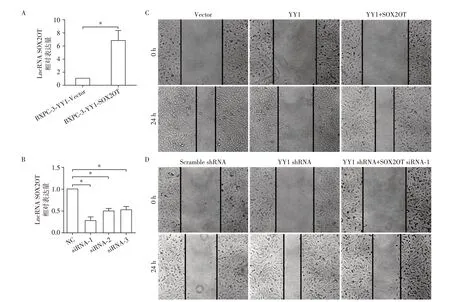
图3 细胞划痕实验检测SOX2OT过表达或SOX2OT干扰对YY1的功能恢复的作用Figure 3 Effects of SOX2OT overexpression or interference on YY1 functional recovery by wound healing assay

图4 Transwell细胞侵袭实验检测SOX2OT过表达(A)或SOX2OT干扰(B)对YY1抑制胰腺癌细胞BXPC⁃3侵袭的影响(×100)Figure 4 Effect of SOX2OT overexpression(A)or interference(B)on cell invasion inhibited by YY1 in BXPC⁃3 cells by transwell cell invasion assay(×100)
SOX2OT 的内含子区包含了干细胞调控因子SOX2 基因。SOX2 是SOX 转录因子家族中的一个主要成员,表达于胚胎干细胞,在胚胎的各个发育过程中起重要作用,是诱导人成体细胞为多能干细胞的一个关键和必需的因子[15]。干细胞和肿瘤都具有自我更新等共同特性,在干细胞起关键作用的基因在肿瘤的发生和发展中也起一定作用。SOX2OT基因定位于3号染色体3q26.3[16],其确切功能还不清楚。然而,最近研究已经证明了它对SOX2 基因的转录调控作用[17]。类似于SOX2,SOX2OT 在胚胎干细胞中高表达,在诱导分化过程中表达降低,仅表达于正常成年小鼠和人类的大脑组织[18]。SOX2OT 在胰腺癌中的表达模式和生物学作用尚不清楚。本研究发现的几项证据表明SOX2OT 可能是胰腺癌中的一个促癌因子。首先,YY1 在胰腺癌中具有抑癌作用,而YY1 负性调节SOX2OT 的表达;其次,SOX2OT 的过表达可以逆转YY1 过表达对胰腺癌细胞迁移和侵袭的作用。
总之,YY1 负调控胰腺癌细胞中SOX2OT 的表达。YY1通过下调SOX2OT的表达抑制胰腺癌细胞的迁移和侵袭。尽管其他尚未发现的机制可能与YY1 介导的抑癌作用有关,但本研究提示SOX2OT在胰腺癌中起到促癌作用。YY1/SOX2OT轴可能是胰腺癌的一个有价值的诊断和预后指标。
