巨噬细胞中神经损伤诱导蛋白1在肝脏缺血再灌注损伤及其炎症反应中的作用
2021-03-22周顺,王勇,张峰,游伟
周 顺,王 勇,张 峰,游 伟
南京医科大学第一附属医院肝胆中心,江苏 南京 210029
肝脏缺血再灌注(ischemia reperfusion,IR)损伤可发生于部分肝切除术后、肝移植以及各种原因导致的休克,是术后器官功能恢复迟缓甚至出现衰竭的重要原因[1]。肝脏IR 损伤发病机制复杂,巨噬细胞介导的无菌性免疫炎症反应在其中扮演了极其重要的角色[2-3]。大量研究证实了外周来源的巨噬细胞(infiltrating macrophage,iMɸ)在IR后被募集入肝脏介导继发性炎性反应从而加重肝脏IR 损伤[4-5]。
神经损伤诱导蛋白1(nerve injury⁃induced pro⁃tein 1,Ninj1)是最初发现于神经损伤时施旺细胞中的一种黏附分子[6],以后的研究发现其在单核细胞、内皮细胞、上皮细胞以及多种组织中均有不同程度的表达[7]。最近研究表明,Ninj1能够调控外周单核细胞向炎症区域迁移的能力,参与调控体内多种炎症反应。多发性硬化症患者外周单核细胞中Ninj1的表达上调与其越过血脑屏障迁移至中枢神经有关,并且在实验性自身免疫性脑脊髓炎(experimen⁃tal allergic encephalomyelitis,EAE)的小鼠模型中,抑制Ninj1的表达能明显减少脑组织中巨噬细胞的浸润,减轻炎症反应,改善组织病理学指标[8]。在小鼠结肠炎模型中,髓系特异性敲除Ninj1 的小鼠肠道炎症较野生型小鼠明显减轻[9]。
目前,Ninj1 在肝脏IR 损伤中肝内炎症反应的作用尚未见报道。本研究收集肝部分切除术中行肝门阻断以及未行肝门阻断的患者术前及术后的外周血标本,提取外周单核细胞(peripheral blood mononuclear cell,PBMC)并分析Ninj1 在两组患者PBMC中的表达情况,进一步建立小鼠肝脏IR模型,采用小干扰RNA(small interfering,siRNA)特异性敲低巨噬细胞中Ninj1的表达,探讨Ninj1在肝脏IR后炎症反应中的作用和机制,为临床防治肝脏IR损伤提供新的思路。
1 材料和方法
1.1 材料
冷冻离心机(Eppendorf 公司,德国);ABI Prism7900 荧光定量PCR 仪(Applied Biosystems 公司,美国);SDS⁃PAGE 电泳仪、酶标仪(Bio⁃Rad 公司,美国);显微镜(Leica公司,德国);化学发光检测仪(Thermo Fisher Scientific公司,美国);TRIzol(Invi⁃trogen公司,美国);逆转录试剂盒、SYBR Green Mas⁃ter、定量PCR 试剂盒(TaKaRa 公司,日本);BCA 蛋白浓度测定试剂盒(上海Beyotime 公司);胰蛋白酶(Sigma Aldrich 公司,美国);蛋白裂解液RIPA(Cell Signaling 公司,美国);脂多糖(lipopolysaccharide,LPS)(InvivoGen 公司,美国);TNF⁃α ELISA 试剂盒、IL⁃6 ELISA试剂盒、IL⁃1β ELISA试剂盒(eBioscience公司,美国);Ninj1⁃siRNA、Non⁃specific siRNA、siR⁃NA 转染试剂盒(Santa Cruz Biotechnology 公司,美国);兔抗人Ninj1一抗、羊抗兔二抗(Abcam公司,美国),兔抗人GAPDH一抗(Cells Galing公司,美国)。
雄性C57BL/6小鼠60只,6~8周龄(南京江苏集萃药康生物科技有限公司),饲养于南京医科大学动物实验中心。在建立模型之前,小鼠至少在动物房饲养1周。饲养环境为:温度20~25 ℃,湿度50%左右,正常昼夜更替,12 h 光照/12 h 无光照交替进行的方式模拟,自由饮水进食。所有动物实验严格按照动物实验规范执行。
1.2 方法
1.2.1 人PBMC的提取
肝门阻断组患者6例,年龄(61.3±4.6)岁,5例原发性肝癌,1例肝脏炎性组织增生,手术方式均为肝部分切除术,术中行第一肝门阻断;对照组患者6例,年龄(58.9±6.7)岁,均为原发性肝癌,5例行肝部分切除术,1例行腹腔镜下肝部分切除术,术中未行肝门阻断。分别于术前、术后第1、3 天采集患者外周血行天门冬氨酸氨基转移酶(aspartate amino⁃transferase,AST)检测。本研究经医院伦理委员会批准,所有患者并知情同意。
肝部分切除术前1 h 和术后6 h 采集患者外周血标本。用PBS 按照1∶2 的比例稀释外周血,将稀释好的外周血小心加入到含有5 mL Ficoll淋巴细胞分离液的15 mL离心管中。室温下2 000 r/min离心20 min。离心结束,小心取出离心管,离心管分成3 层,上层为血浆,下层为红细胞和粒细胞,中层为淋巴细胞分离液,上层与中层之间有一白色云雾层,即为淋巴细胞和单核细胞。移液枪插入云雾层,小心吸取。PBS洗涤2次,用红细胞裂解液裂解红细胞,收集PBMC。
1.2.2 小鼠分组和IR手术方法
分组:假手术组(Sham 组)、IR 组、IR+NS(Non⁃specific)⁃siRNA组、IR+Ninj1⁃siRNA组。
IR 模型手术方法:水合氯醛腹腔注射麻醉小鼠,将小鼠固定于手术台上,碘伏、酒精消毒2 遍。取腹正中切口,剪开皮肤,经腹白线剪开腹膜。小拉钩充分暴露术野,生理盐水浸润棉签,充分显露肝脏左叶、中叶,小心剪开肝胃韧带,游离第一肝门,用无损伤血管夹夹闭肝左、中叶脉管共干,观察肝脏缺血情况,计时。关腹缝合,将小鼠置于保温毯上,维持麻醉状态和体温。缺血90 min 后,再次开腹,小心松开无损伤血管夹,恢复肝脏血流。关腹缝合,恢复血流后6 h 收集下腔静脉血和缺血的肝脏组织标本。假手术(Sham)组基本操作相同,但只游离第一肝门,并不进行夹闭。
1.2.3 小鼠血清转氨酶检测
1 mL 注射器采取小鼠下腔静脉血,转入含有EDTA 抗凝剂的离心管中,室温下7 000 r/min 离心8 min,收集上层血清样品。取50 μL血清采用自动生化检测仪检测血清中丙氨酸氨基转移酶(ALT)和AST的水平。剩余血清样本置入-80 ℃冰箱保存。
1.2.4 肝脏组织样本病理学检测
HE 染色:剪成小块型的肝脏组织样本放入4%多聚甲醛溶液中固定,脱水后石蜡包埋。将石蜡包埋后的组织切成4 μm厚度置于载玻片中,进行苏木精⁃伊红(HE)染色,中性树胶封片固定,显微镜下观察。肝脏损伤程度采用Suzuki’s 评分标准(0~4 分)进行分析。判断标准依据有无肝细胞坏死、肝窦充血、淤血,小叶中心水肿等进行评判。
免疫组化:小鼠肝脏标本切片后用二甲苯浸泡2次,每次10 min,利用不同浓度梯度乙醇分别浸泡5 min 进行水化。清洗3 次后在抗原修复液中进行抗原修复。3%双氧水⁃甲醇溶液处理切片15 min。CD11b 染色按照试剂盒操作说明进行,染色结果中CD11b+巨噬细胞被染成黄褐色,200 倍镜下取6~8个视野进行计数。
1.2.5 骨髓来源巨噬细胞(bone marrow derived mac⁃rophages,BMDM)的分离培养和LPS刺激
将6~8 周龄的雄性小鼠腹腔注射120 μL 的5%水合氯醛麻醉后,脱颈处死。置入70%乙醇中浸泡5 min消毒。无菌剪刀剪开双侧后肢皮肤,将皮肤分离至髋关节,小心离断髋关节,取下双侧后肢。将供体双侧后肢移至超净工作台,去除肌肉组织,仔细剥离出胫骨和股骨。用无菌注射器吸取完全培养基插入骨髓腔,反复冲洗骨髓腔,将骨髓移入离心管,移液枪反复混匀细胞。放入离心机,1 200 r/min离心5 min,取下层细胞,PBS 重悬,显微镜下计数。将骨髓细胞用红细胞裂解液处理3 min,再将骨髓细胞按照2×104个/皿的密度分入10 cm细胞培养皿,加入含有20%的L929 上清配制的完全DMEM 培养基培养4 d,用含有20%的L929 上清配制的完全DMEM培养基换液,继续培养3 d。PBS清洗2遍,用0.25%的胰酶消化贴壁细胞,重新铺板,37 ℃培养箱培养过夜。LPS 组用含有500 ng/mL LPS 的完全DMEM培养基刺激6 h,对照组(PBS组)用含同等体积的PBS 完全DMEM 培养基继续培养6 h。PBS 清洗2 遍,用0.25%的胰酶消化贴壁细胞,镜下计数,用于后续实验。
1.2.6 RT⁃PCR实验
取适量肝组织或者BMDM,采用TRIzol 两步法逆转录合成cDNA,定量PCR分析Ninj1和炎性因子的mRNA表达量。引物设计见表1。
1.2.7 免疫印迹实验
人PBMC 或者小鼠BMDM 加入1 mL 预冷的蛋白裂解液研磨均匀后冰上静置30 min,12 000 r/min离心15 min,取上清液,BCA 法测定蛋白质浓度。SDS⁃PAGE 电泳、转膜后封闭,一抗4 ℃摇床孵育过夜,电泳缓冲液洗膜3次,每次10 min,二抗孵育2 h,加入电化学发光试剂显影,检测Ninj1蛋白表达水平。
1.2.8 siRNA干扰
体外:将体外诱导成功的小鼠原代BMDM用胰蛋白酶消化,镜下计数,按2×104个/孔重新铺至6孔板,用无抗生素的DMEM 培养基培养过夜。按照siRNA转染试剂盒说明书进行体外siRNA转染。实验分组为:PBS 组、LPS 组、LPS+NS⁃siRNA 组、LPS+Ninj1⁃siRNA组。
体内:巨噬细胞特异性表达甘露糖受体,采用甘露糖偶联聚合体为载体,将NS⁃siRNA 和Ninj1⁃siRNA 与甘露糖偶联聚合体混合静置20 min,在建立缺血再灌注模型4 h之前按照2 mg/kg通过尾静脉高压注射入小鼠体内,以达到体内特异性干扰巨噬细胞的目的。
1.2.9 酶联免疫吸附实验ELISA
取细胞培养上清,上清中细胞因子IL⁃6、TNF⁃α、IL⁃1β采用美国eBioscience 公司的ELISA 试剂盒检测,实验步骤遵照说明书进行。
1.3 统计学方法
采用SPSS 19.0 软件进行统计学分析。计量资料以均数±标准差()表示,采用单因素方差分析进行比较,组间比较采用LSD⁃t检验。P<0.05为差异有统计学意义。
2 结果
2.1 肝部分切除术患者术前、术后肝功能以及PBMC中Ninj1表达水平的比较
两组患者的肝功能如图1A 所示,与对照组相比,肝门阻断组患者术后第1天AST有增高趋势,但两组患者术前、术后AST的差异无统计学意义。
RT⁃PCR结果显示,肝门阻断组患者术后PBMC中Ninj1的基因表达水平较术前明显上调(P<0.05,图1B)。免疫印迹实验也证实,肝门阻断组患者术后PBMC 中Ninj1 的蛋白表达水平与术前相比明显增高(P<0.05),而对照组患者PBMC 中Ninj1 的表达无明显变化(图1C),提示外周单核细胞中Ninj1参与肝脏IR损伤的过程。
2.2 体外干扰Ninj1 的表达对LPS 诱导的小鼠BM⁃DM炎性反应的影响
体外LPS刺激小鼠BMDM后,Ninj1的蛋白表达水平较PBS 组明显增高(图2A)。RT⁃PCR 和ELISA的结果均证实LPS刺激能诱导BMDM分泌大量炎症因子(IL⁃6、TNF⁃α、IL⁃1β)(图2B)。而与LPS 组相比,Ninj1⁃siRNA+LPS 组的BMDM 分泌的炎症因子明显减少(P<0.05)。
2.3 体内特异性干扰巨噬细胞Ninj1的表达对肝脏IR损伤的作用
IR 后小鼠血清ALT 和AST 的水平较Sham 组明显增高(图3A、B)。HE染色显示,IR组肝脏组织结构的损伤明显(图3C)。与IR组相比,Ninj1⁃siRNA+IR 组HE 染色和Suzuki’s评分均提示肝脏组织的损伤明显减轻(图3C、D),并且ALT和AST水平显著降低(P<0.05,图3A、B)。
2.4 体内特异性干扰巨噬细胞Ninj1 对IR 后炎症反应的影响
与Sham 组相比,肝脏IR 后体内炎症反应明显激活,表现为IR组肝脏内CD11b+巨噬细胞的数量明显增多,肝组织中炎性因子的mRNA 水平显著升高,血清中炎性因子的分泌显著增多(图4)。而与IR组相比,Ninj1⁃siRNA+IR 组中上述炎性指标均明显下降(P<0.05)。
3 讨论
肝脏IR损伤的发生机制非常复杂,巨噬细胞介导的先天免疫在其中发挥了至关重要的作用。在肝脏的缺血期,肝实质细胞由于缺血缺氧直接受损,释放出损伤相关分子模式(damage⁃associated molecular pattern,DAMP)激活肝枯否细胞(Kupffer cells,KC)启动肝内炎症反应;在肝脏的再灌注期,激活的KC 释放出大量的炎性因子和趋化因子,趋化外周的单核细胞迁移入肝,进一步加重肝内的炎性损伤[10-11]。Ninj1 是一种表达于外周单核细胞的黏附分子,在多种炎性疾病的模型中被证实与外周单核细胞的迁移和炎性反应有关[12-16]。因此,本研究的着重点在于外周来源的巨噬细胞中Ninj1在肝脏IR损伤中调控炎性反应的作用。
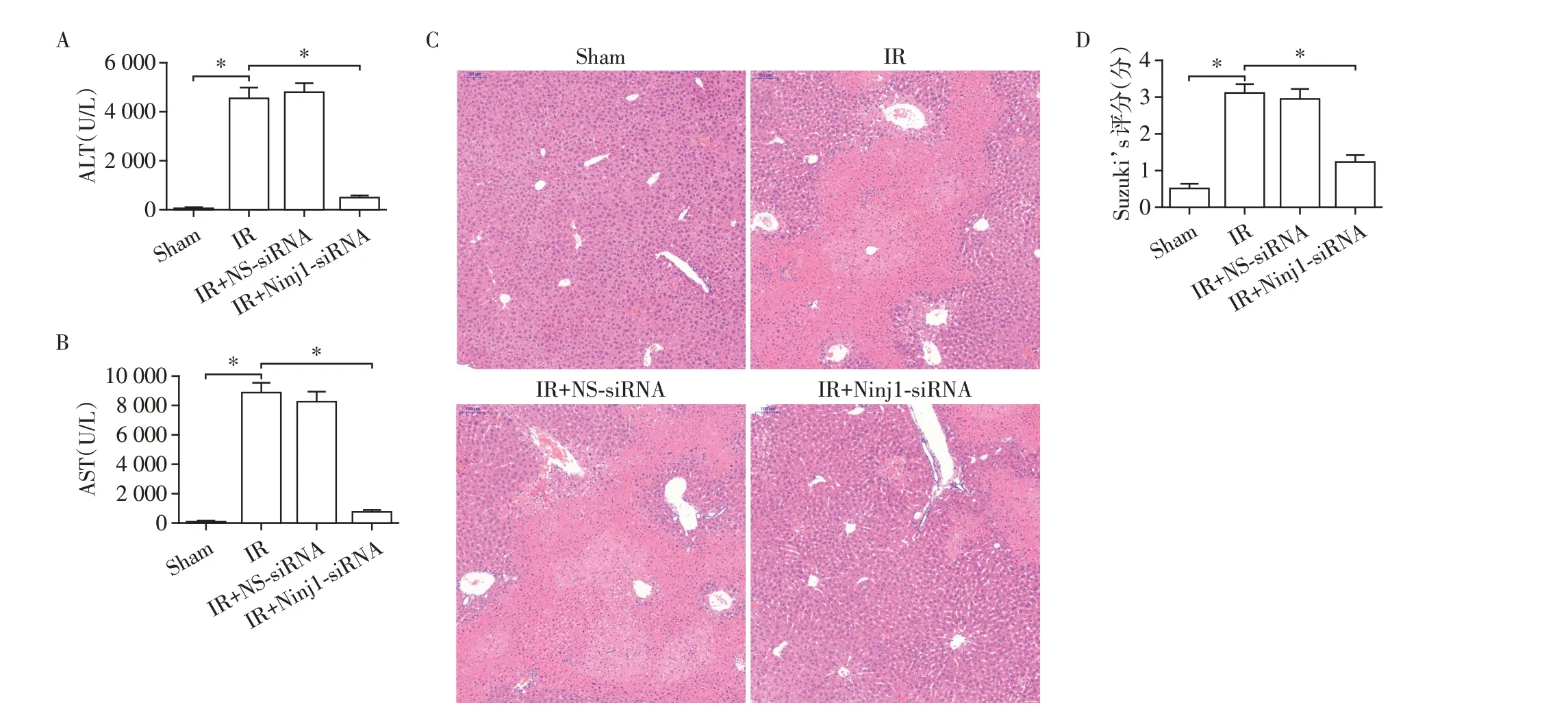
图3 各组小鼠血清ALT、AST及肝脏损伤程度的比较。Figure 3 Comparison of levels of ALT and AST and degree of liver IR injury among different groups
首先,分析了肝部分切除术中肝门阻断组与对照组患者术前及术后肝功能的变化,结果显示术后第1 天,肝门阻断组患者的AST 较对照组有增高的趋势,但差异无统计学意义,这可能与病例数较少有关。进一步分析了两组患者术前和术后PBMC中Ninj1 的表达情况,结果与预想的一致,肝门阻断后患者PBMC中的Ninj1表达显著增高,而对照组患者中Ninj1 的表达无明显变化,提示肝脏IR 能激活外周单核细胞Ninj1 的表达,但是其与继发的免疫炎症反应有无关系尚不清楚。
PBMC中含有多种细胞类型,包括淋巴细胞、单核细胞和树突状细胞(dendritic cell,DC)[17]。Choi等[7]的研究显示,在正常人PBMC 中Ninj1仅少量表达于B 淋巴细胞和T 淋巴细胞,但是在利用抗CD3抗体和IL⁃2体外激活后的人PBMC中,CD68+巨噬细胞和CD83+DC 细胞中Ninj1 的表达显著增高,而在淋巴细胞中的表达无显著性差异,提示Ninj1 在炎性反应中的作用主要通过单核细胞实现。本研究结果也表明,在接受第一肝门阻断的肝部分切除术患者中,肝脏IR 同样能够激活PBMC 中Ninj1 的表达,提示Ninj1 可能在肝脏IR 后继发的炎性损伤中发挥重要的作用。
以往的研究表明,在体外LPS 刺激人微血管内皮细胞和巨噬细胞可明显上调2 种细胞中Ninj1 的表达,并且抑制Ninj1 的表达,进而通过TLR4 受体信号通路减轻败血症小鼠体内的炎症反应和器官损伤[15]。与上述研究结果相似,本研究在体外利用LPS 刺激小鼠BMDM 发现Ninj1 的表达明显上调,siRNA 干扰实验证实Ninj1 的表达增加与巨噬细胞的促炎性反应密切相关。Ahn等[18]研究表明,Ninj1促进BMDM 膜突触的形成,增强其迁移能力,从而促进BMDM 穿过血管内皮细胞进入炎症组织中。事实上,本研究的体内实验也表明,敲低巨噬细胞中Ninj1的表达能明显减少IR后肝脏组织中CD11b+巨噬细胞的数量,这种现象是否与外周巨噬细胞的迁移能力减弱有关有待进一步的研究。
综上所述,肝脏IR能显著激活人PBMC中Ninj1的表达,抑制巨噬细胞中Ninj1 的表达能明显减轻小鼠肝脏IR 损伤以及肝内的炎性反应,提示Ninj1可能成为防治肝脏IR损伤新的作用靶点。
