高通量测序技术检测非小细胞肺癌相关驱动基因的突变
2021-03-22严晓娣史国振毛旭华
严晓娣,史国振,毛旭华
1南通大学附属医院肿瘤放疗科,江苏 南通 226001;2江苏大学附属宜兴医院心胸外科,3检验科,江苏 无锡 214200
肺癌是世界范围内发病率和病死率最高的恶性肿瘤之一[1]。据中国癌症统计报告,中国2015 年有429 万例肺癌新发病例,281 万例肺癌死亡病例[2-3]。肺癌患者中约80%为非小细胞肺癌(non⁃small⁃cell lung cancer,NSCLC),60%~70%的NSCLC患者首诊时已处于中晚期[4],失去了手术治疗机会。近年来以表皮生长因子受体(epidermal growth factor receptor,EGFR)⁃酪氨酸激酶抑制剂(tyro⁃sine kinase inhibitor,TKI)为代表的靶向治疗取得飞速发展。研究表明,EGFR、KRAS、BRAF、NRAS、PIK3CA 和Her⁃2 等基因的突变状态与NSCLC患者TKI 靶向治疗的疗效、肿瘤转移以及预后相关[5-7]。因此,全面准确地检测相关基因显得尤为重要。
目前常用的基因检测方法主要有Sanger 测序法、高通量测序技术、实时荧光定量PCR法、微滴式数字PCR 技术(droplet digital PCR,ddPCR)等。Sanger 测序法被认为是基因检测的“金标准”,但其操作步骤繁琐、耗时长、检测灵敏度不高。高通量测序技术具有海量检测分析能力,能够一次检测多个基因的多个突变位点序列,节省肿瘤样本DNA。ddPCR 技术是一种新发展起来的检测方法,其具有更高的精度和灵敏度,且可绝对定量。
本研究应用个体化基因组测序(personal genome machine,PGM)平台,对150 例NSCLC 患者EGFR、KRAS、BRAF、NRAS、Her⁃2 和PIK3CA 基因突变状态进行检测并分析,同时采用Sanger 测序及ddPCR技术对150例NSCLC患者EGFR基因突变状态进行检测并加以对比分析。
1 材料和方法
1.1 标本
病例纳入标准:①病理证实为NSCLC;②年龄大于18岁;③有可测量病灶(CT测得长径≥10 mm);④心电图、血常规、肝肾功能、骨髓功能基本正常;⑤患者及家属知情并同意。病例排除标准:①造血功能严重障碍者,肝肾功能严重损害者;②精神病患者;③怀孕或哺乳期妇女。按照病例纳入及排除标准收集江苏大学附属宜兴医院和南通大学附属医院2016 年5 月— 2018 年6 月就诊患者160 例作为研究对象。肿瘤组织标本来源于研究病例穿刺或术后福尔马林固定石蜡包埋样本。本研究所有患者均知情同意,并经医院医学伦理委员会批准。
1.2 方法
1.2.1 DNA提取
采用QIAamp DNA FFPE Tissue Kit 试剂盒(批号157050679,凯杰公司,德国),按照试剂盒说明书操作,提取DNA。采用Qubit®2.0 fluorometer dsD⁃NA HS assay Kit 试剂盒(批号1871944,赛默飞世尔公司,美国)检测提取DNA 的浓度和纯度。琼脂糖凝胶电泳检测DNA的片段化程度。
1.2.2 高通量测序技术检测EGFR、KRAS、BRAF、NRAS、Her⁃2和PIK3CA基因突变
DNA 采用Agencourt®AMPureTMXP beads(贝克曼库尔特公司,美国)进行纯化。采用肺癌文库制备试剂盒(赛默飞世尔公司,美国),按照说明书操作,进行扩增、片段化,连接接头和条码,从而获得DNA 文库。采用Ion PGM Template OT2 Reagents 200 试剂盒(批号4481107,赛默飞世尔公司,美国),按照说明书操作,利用Ion OneTouch 仪器进行油包水PCR 反应,Ion OneTouch ES 仪器进行模板富集。采用Ion PGMTMSequencing Supplies 200 v2 测序试剂盒(批号4482007,赛默飞世尔公司,美国),上机测序,要求测序平均深度>1 000 倍,测序区域均一度>95%。采用Iontorrent variant caller plugin v4.0软件分析结果。
1.2.3 Sanger测序法检测EGFR基因突变
运用PCR仪扩增EGFR 基因18~21外显子目的片段,引物参考文献[8]。采用Cycle⁃Pure Kit 纯化试剂盒(批号D6492⁃02,Omega Biotek 公司,美国),按照说明书操作纯化PCR 产物。采用Big Dye Ter⁃minator v3.1 kit(批号1705129,赛默飞世尔公司,美国)进行测序反应,纯化,运用ABI 3500Dx 基因测序仪进行测序。
1.2.4 ddPCR法检测EGFR基因突变
采用美国Bio⁃Rad 公司QX200 Droplet Digital PCR 系统,按照商用试剂盒Prime PCRTMddPCRTMMutation Detection Assay Kit(批号1863107、1863103、1863104、1863105、1863106,美国Bio⁃Rad 公司)说明书操作,检测EGFR基因18外显子p.G719S,19外显子p.E746_A750del,20 外显子p.T790M,21 外显子p.L858R 和p.L861Q 位点突变状态。阳性判定:“ch1+ch2⁃”区的点≥3个。
1.3 统计学方法
采用SPSS 19.0 统计学软件进行分析,定性资料组间比较采用卡方检验,P<0.05 为差异有统计学意义。
2 结果
2.1 高通量测序法检测基因突变在NSCLC 患者中的分布
本研究入组160 例NSCLC 患者,提取其组织标本DNA。经检测10例标本DNA质量不符合实验要求,对其余150 例标本进行检测。其中男87 例,女63例;年龄<60岁57例,≥60岁93例;病理类型为腺癌109 例,鳞癌34 例,腺鳞癌2 例,其他5 例;高⁃中分化61例,低分化89例;TNM分期Ⅰ~Ⅱ期52例;Ⅲ~Ⅳ期98 例。150 例标本进行高通量测序检测,结果显示,EGFR、KRAS、BRAF、NRAS、Her⁃2 和PIK3CA基因突变检出率分别为51.33%(77/150)、7.33%(11/150)、1.33%(2/150)、1.33%(2/150)、2.00%(3/150)和4.67%(7/150)。57例标本未检出任何基因突变,84例标本检出单个驱动基因发生突变,9 例标本检出2 个及以上驱动基因发生突变。
6 种驱动基因中,EGFR 基因突变检出率最高,77 例标本共检出86 个EGFR 基因突变,其中有9 例患者检出EGFR 基因双位点复合突变。EGFR 基因突变位点集中在EGFR 基因19 外显子缺失突变和21 外显子L858R 位点突变,分别占33.72%(29/86)和45.35%(39/86),具体结果见表1。KRAS 基因突变集中在12、13 密码子,其中12 密码子占91.67%(11/12),1例患者12密码子检出G12C和G12V两个不同位点复合突变。2 例BRAF 基因突变分别为V600E 和L618F 位点突变。2 例NRAS 基因突变分别为G12D 和D33E 位点突变。3 例Her⁃2 基因突变均为P761H 位点突变。PIK3CA 基因突变分别为E542K、E545K 和H1047L 位点突变,其中1 例患者检出E542K和E545K两个不同位点复合突变,具体结果见表2。
2.2 高通量测序法、Sanger测序法和ddPCR法检测EGFR基因突变的比较
150 例标本采用金标准Sanger 测序法检测EG⁃FR 基因突变,突变检出率为38.67%(58/150),与高通量测序法突变检出率[51.33%(77/150)]比较,差异有统计学意义(χ2=4.862,P=0.027)。高通量测序法灵敏度为98.28%,特异度为78.26%。
150 例标本采用ddPCR 法检测EGFR 基因突变,突变检出率为50.00%(75/150),与高通量测序法比较,差异无统计学意义(χ2=0.053,P=0.818)。阳性一致率为82.67%,阴性一致率80.00%,总一致率为81.33%。3种不同方法的具体比较见表3。

表1 高通量测序法检测EGFR基因突变Table 1 EGFR mutations detected by high⁃throughput se⁃quencing
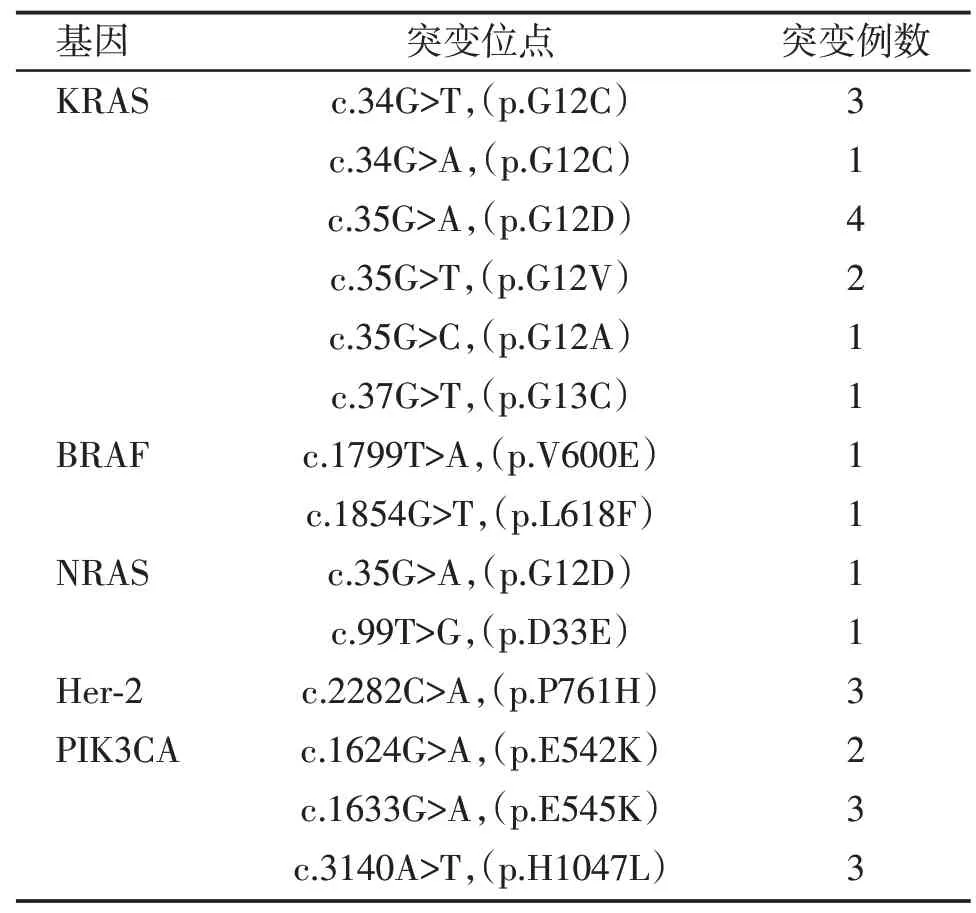
表2 高通量测序法检测KRAS、BRAF、NRAS、Her⁃2 和PIK3CA 基因突变Table 2 KRAS,BRAF,NRAS,Her⁃2 and PIK3CA muta⁃tions detected by high⁃throughput sequencing

表3 Sanger测序法、ddPCR法和高通量测序法特点比较Table 3 The characteristics comparison of ddPCR,Sanger sequencing and high ⁃ throughput se⁃quencing
3 讨论
随着高通量测序技术的不断发展,以其为技术基础的基因检测在NSCLC 诊疗中的应用日益广泛。本研究选择了NSCLC诊疗中相关的6个驱动基因进行高通量测序检测,并分析其在我国NSCLC患者中的变异情况。
EGFR 基因突变是NSCLC 最常见的突变基因,本研究EGFR 基因突变的检出率为51.33%,与以往的研究报道相符[9-10]。检出的EGFR 基因突变以常见的19 外显子缺失突变和21 外显子L858R 位点突变为主,同时也检测到罕见位点突变。文献报道,EGFR 基因18外显子G719S罕见位点突变对TKI治疗敏感,但其敏感性不及常见突变,同时厄洛替尼比吉非替尼在罕见突变方面有更好的疗效[11]。18外显子E709X罕见位点突变与G719S罕见位点突变相比,敏感性更低[12]。21外显子L861Q罕见位点突变同18 外显子G719S 罕见位点突变一样表现出不及常见突变的敏感性[12]。20 外显子T790M 位点突变经大量研究证实是耐药位点[12,13]。本研究中有9例患者检出EGFR 基因双位点复合突变,有研究指出,罕见突变的复合突变其疗效要优于单一罕见突变[12,14]。本研究中尚有部分罕见突变未见报道或相关证据不足,还需进一步研究。
本研究中KRAS基因突变检出率与文献报道相吻合[15]。文献报道KRAS基因突变以G12C和G12V突变位点最为常见[15],而本研究与之不同,G12D 位点突变检出最多。Zer等[16]学者的研究表明,G12C/G12V 位点突变患者经TKI治疗后预后差,而G12D/G12S 位点突变患者可以从TKI 治疗中获益。本研究检测到的2 例BRAF 基因突变,1 例为经典的V600E 位点突变,另1 例为L618F 位点罕见突变。研究表明,NRAS 基因突变在NSCLC 中的发生频率极低,3 号外显子上61 号密码子突变最常见,其次是2 号外显子上的12 号密码子突变[17]。本研究检出NRAS 基因12 号密码子G12D 位点突变及D33E罕见位点突变,由于样本量较小,并未检出61 号密码子突变。Song等[18]研究指出NSCLC中Her⁃2 基因突变以插入突变最为常见,其次为P761H 位点突变。本研究与之不同,检出的3 例突变均为P761H位点突变,未检出插入突变,具体原因还需进一步分析。本研究中PIK3CA基因突变检出率为4.67%,与此前的研究相符[19]。除1 例标本检出PIK3CA 基因2 个不同位点的复合突变外,其余6 例突变均和其他驱动基因以复合突变的形式存在,该特征与Scheffler等[7]学者的研究一致。
近年来国内外的研究发现,肿瘤驱动基因可以以复合突变的形式存在[17,20],本研究也得到相同的结论,共发现9例标本存在驱动基因复合突变,这提示某些NSCLC 的形成可能不单是一个驱动基因的作用,而是多个驱动基因共同作用的结果。
本研究通过对EGFR 基因突变的检测,分析比较了Sanger 测序法、ddPCR 法和高通量测序法3 种不同的方法。高通量测序法与基因检测金标准Sanger测序法相比较,EGFR基因突变检出率大幅提升,差异有统计学意义。高通量测序法检测灵敏度明显高于Sanger 测序法,但研究中发现1 例标本Sanger测序法检出19外显子缺失突变,但高通量测序法却并未检出,猜测可能是高通量测序法生物信息学软件分析结果时产生错误。高通量测序法与新技术ddPCR 法检测EGFR 基因突变,检出率差异无统计学意义。理论上ddPCR法检测EGFR基因突变应有更高的突变检出率,但实践中ddPCR法商用检测试剂盒仅能检测少数已知的热点突变,部分罕见和未知突变无法检测,导致突变检出率并不高。综合来看,高通量测序法拥有更高的检测通量和突变检出率,并可同时检测多个基因,更适合应用于NSCLC诊疗。Sanger测序法和ddPCR法可作为有益的补充。
虽然高通量测序技术应用于NSCLC 诊疗过程中仍有诸多问题亟待解决,但随着高通量测序技术的不断发展,持续降低成本,缩短检测周期及提高准确性,将更广泛地应用于肿瘤尤其是NSCLC的临床诊断及个体化治疗中。
