降解呕吐毒素菌株的筛选及鉴定
2021-03-22王明清龚魁杰于丽娜张初署毕洁宋昱迟晓元孙杰
王明清,龚魁杰,于丽娜,张初署,毕洁,宋昱,迟晓元,孙杰
(1. 山东省花生研究所,山东 青岛 266100;2. 山东省农业科学院作物研究所,山东 济南 250100)
呕吐毒素,又名脱氧雪腐镰刀菌烯醇(deoxynivalenol),是一种主要由禾谷镰刀菌(Fusariumgraminearum)、粉红镰刀菌(F.roseum)和拟枝镰刀菌(F.sporotrichioide)等镰刀菌产生的真菌毒素[1,2]。呕吐毒素在被污染的小麦、玉米、大豆等粮食中广泛存在,是食品和饲料中较常见的真菌毒素之一[3]。该毒素能通过影响免疫细胞增殖和免疫细胞因子生成从而降低机体的免疫力;还可抑制mRNA翻译和调节蛋白激酶活性[4,5],从而加速细胞凋亡,严重危害人和动物健康。1998年呕吐毒素被国际癌症研究机构列为3类致癌物。因此,采取有效措施去除小麦、玉米等粮食和饲料中的呕吐毒素,保障食品和饲料安全,对人和动物健康具有重要意义。
由于呕吐毒素的化学结构稳定,导致该毒素很难在加热等处理中被破坏和去除。目前常用的脱除方法主要分为物理法、化学法和生物法[6],其中物理和化学方法脱除效果不稳定,同时还会破坏粮食中的营养物质,并且容易引入新的污染物[7]。生物法主要是利用微生物产生的酶降解呕吐毒素[8],该方法具有效率高、专一性强、环保等优点,受到广泛关注,因此微生物降解已成为研究的热点[9]。本试验从小麦田土壤中分离到一株高效降解呕吐毒素的菌株,并对其降解特征进行了研究,为其应用于呕吐毒素的脱除奠定了基础。
1 材料与方法
1.1 试验材料
土壤样品采集自山东省青岛市小麦地;邻苯二甲酸二正辛酯购自国药集团化学试剂有限公司;呕吐毒素标准品购自以色列Fermentek公司;Super GelRed荧光染料购自US Everbright Inc.;呕吐毒素ELISA试剂盒购自北京华安麦科生物技术有限公司。
1.2 培养基
液体初筛培养基[10](g/L):0.25 g KH2PO4,0.25 g MgSO4·7H2O,0.5 g KNO3,0.5 g (NH4)2SO4,0.005 g CaCl2,0.003 g FeCl3·6H2O,2.0 g邻苯二甲酸二正辛酯,pH 7.0,高压灭菌15 min。
固体初筛培养基:初筛培养基加入2%琼脂粉。
复筛培养基(g/L):10 g蛋白胨,3 g牛肉膏,10 g NaCl,1 g KH2PO4,1 g葡萄糖,pH 7.0,高压灭菌15 min。
1.3 降解呕吐毒素菌株的初筛
取2 g土壤样品于200 mL无菌水中,涡旋振荡后取300 μL悬液至300 mL液体初筛培养基中,37℃恒温振荡培养一周左右。当培养基出现浑浊后,在固体初筛培养基进行多次划线纯化,放置于37℃生化培养箱中培养。
1.4 降解呕吐毒素菌株的复筛
将初筛获得的菌株接种于复筛培养基,37℃摇床发酵48 h。取发酵菌液1 980 μL,加入20 μL呕吐毒素标准品(浓度为200 mg/L),使最终体系中呕吐毒素含量为2 000 μg/L,以加入同样浓度呕吐毒素的空白发酵培养基作为对照。37℃孵育48 h后,采用呕吐毒素ELISA试剂盒检测呕吐毒素含量。降解率计算公式为:
y(%)=(1-S/C)×100 。
式中,y是呕吐毒素降解率,C是空白对照样品中呕吐毒素含量,S是处理样品中呕吐毒素含量。
1.5 菌种鉴定
1.5.1 生理生化特征 于37℃培养箱对呕吐毒素降解率最高的菌株进行培养,16 h后观察菌落形态、色泽。观察菌株革兰氏染色反应及其氧化酶、过氧化氢酶等活性。
1.5.2 细菌16S rRNA基因的扩增及分析 取10 mL菌株发酵液,利用细菌DNA提取试剂盒提取基因组DNA。采用通用引物27F和1492R[11],利用PCR仪扩增16S rRNA基因。取5 μL PCR产物上样于1.0%琼脂糖凝胶,电泳结束后通过凝胶成像系统观察PCR扩增产物,片段大小合理的产物送测序公司测序。测序获得的16S rRNA基因序列在EzTaxon-e server中进行比对分析,然后用MEGA X 软件构建系统进化树[12]。
1.6 降解特性分析
对10 mL发酵菌体进行高速离心,制备胞外上清液。无菌水冲洗菌体后,加入10 mL无菌水制备菌悬液。通过超声破碎菌悬液,再经高速离心和0.22 μm无菌滤膜过滤获得胞内液。上清液、菌悬液、胞内液3种组分中分别加入呕吐毒素,37℃孵育48 h,利用试剂盒检测各组分去除呕吐毒素的效果。
1.7 对小麦样品中呕吐毒素的降解
将呕吐毒素超标的小麦样品经研磨、灭菌,再经40℃干燥至恒重,测量其呕吐毒素的含量。取菌株发酵液,与上述呕吐毒素超标的小麦样品按照5∶1(体积质量比)混合;以添加等体积液体培养基的小麦样品作为空白对照,37℃孵育48 h,测量样品中呕吐毒素的残留量。
2 结果与分析
2.1 降解呕吐毒素菌株筛选
由图1可知,菌株QD11、QD12、QD36、JJ15、ZJ4、ZJ5均能降解35%以上的呕吐毒素,其中菌株QD36的降解率最高,为84.6%。因此选择菌株QD36进行下一步研究。
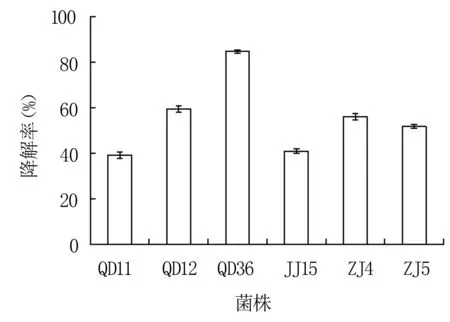
图1 各菌株降解呕吐毒素的能力
2.2 菌种鉴定
2.2.1 菌株QD36生理生化特征 菌株QD36在固体LB平板中生长较快,菌落凸起,乳白色,不透明,呈现皱褶(图2),该特征是芽孢杆菌的典型特征之一。革兰氏染色呈阳性,具有氧化酶和过氧化氢酶活性。
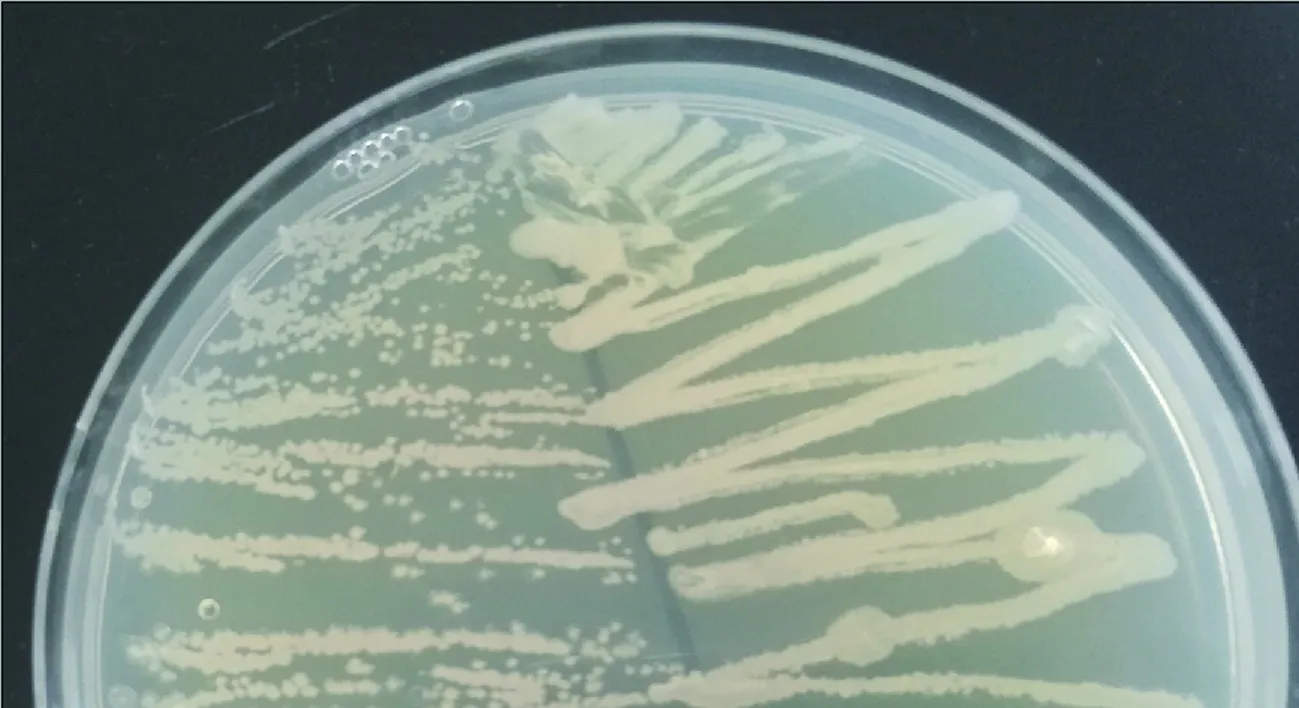
图2 菌株QD36的菌落形态
2.2.2 菌株QD36的16S rRNA基因鉴定 利用凝胶成像系统观察16S rRNA基因的PCR产物,在约1 500 bp处获得一条特异性扩增条带(图3)。测序结果(图4)表明菌株QD36与芽孢杆菌属的菌株处于同一大的分支,其中与标准菌株BacillussiamensisPD-A10T聚类在一起,相似度高达99.9%。结合生理生化特征和16S rRNA基因分析结果,菌株QD36被命名为暹罗芽孢杆菌QD36(BacillussiamensisQD36)。
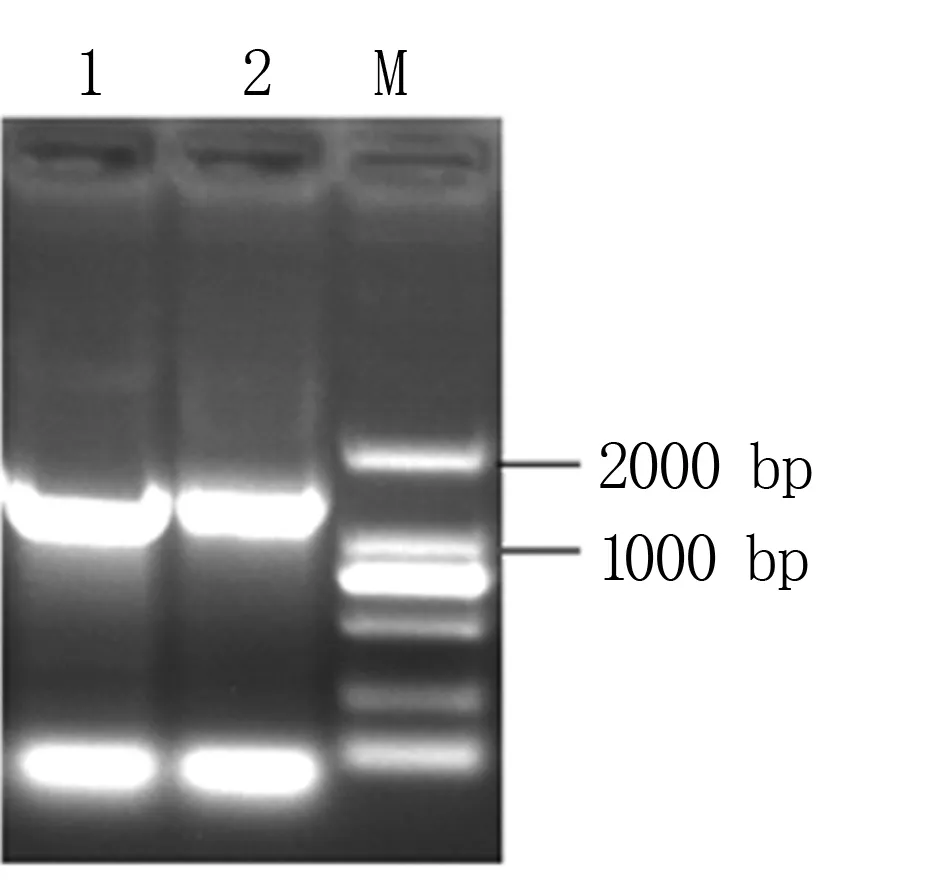
1, 2: 菌株QD36的16S rRNA基因; M: DL2000 DNA Marker。
2.3 菌株QD36降解特性
比较菌株QD36不同组分去除呕吐毒素的能力,由图5可知,上清液、菌悬液、胞内液可分别去除84.1%、13.9%和6.5%的呕吐毒素。该结果表明菌株QD36分泌至胞外的活性物质主导呕吐毒素的生物降解。
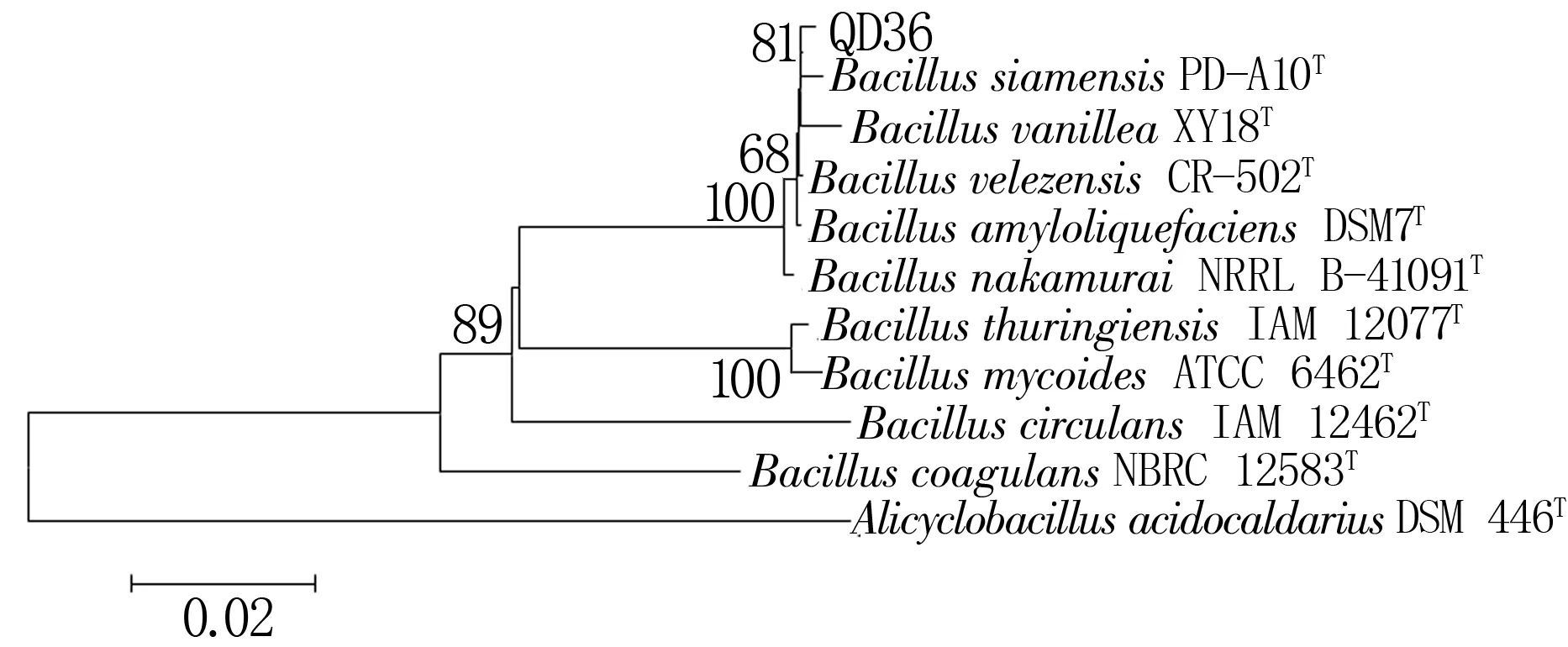
Bacillussiamensis: 暹罗芽孢杆菌;Bacillusvanillea: 香草芽孢杆菌;Bacillusvelezensis: 贝莱斯芽孢杆菌;Bacillusamyloliquefaciens: 解淀粉芽孢杆菌;Bacillusnakamurai: 中村芽孢杆菌;Bacillusthuringiensis: 苏云金芽孢杆菌;Bacillusmycoides: 蕈状芽孢杆菌;Bacilluscirculans: 环太芽孢杆菌;Bacilluscoagulans: 凝结 芽孢杆菌;Alicyclobacillusacidocaldarius: 酸热脂环酸杆菌。
图4菌株QD36的16SrRNA基因系统发育树
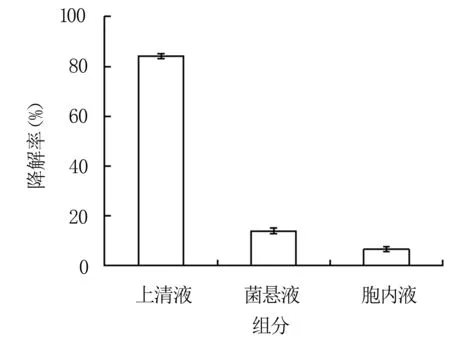
图5 菌株QD36各组分呕吐毒素降解率
2.4 菌株QD36降解小麦中呕吐毒素试验
以呕吐毒素超标的小麦样品为研究对象,经48 h处理后,空白对照样品S1的呕吐毒素含量为2 530 μg/kg,加入菌株QD36处理的样品S2呕吐毒素含量为456 μg/kg(图6),降解率为82.0%。以上结果表明,菌株QD36能显著降解小麦样品中的呕吐毒素,具有去除呕吐毒素的潜力。
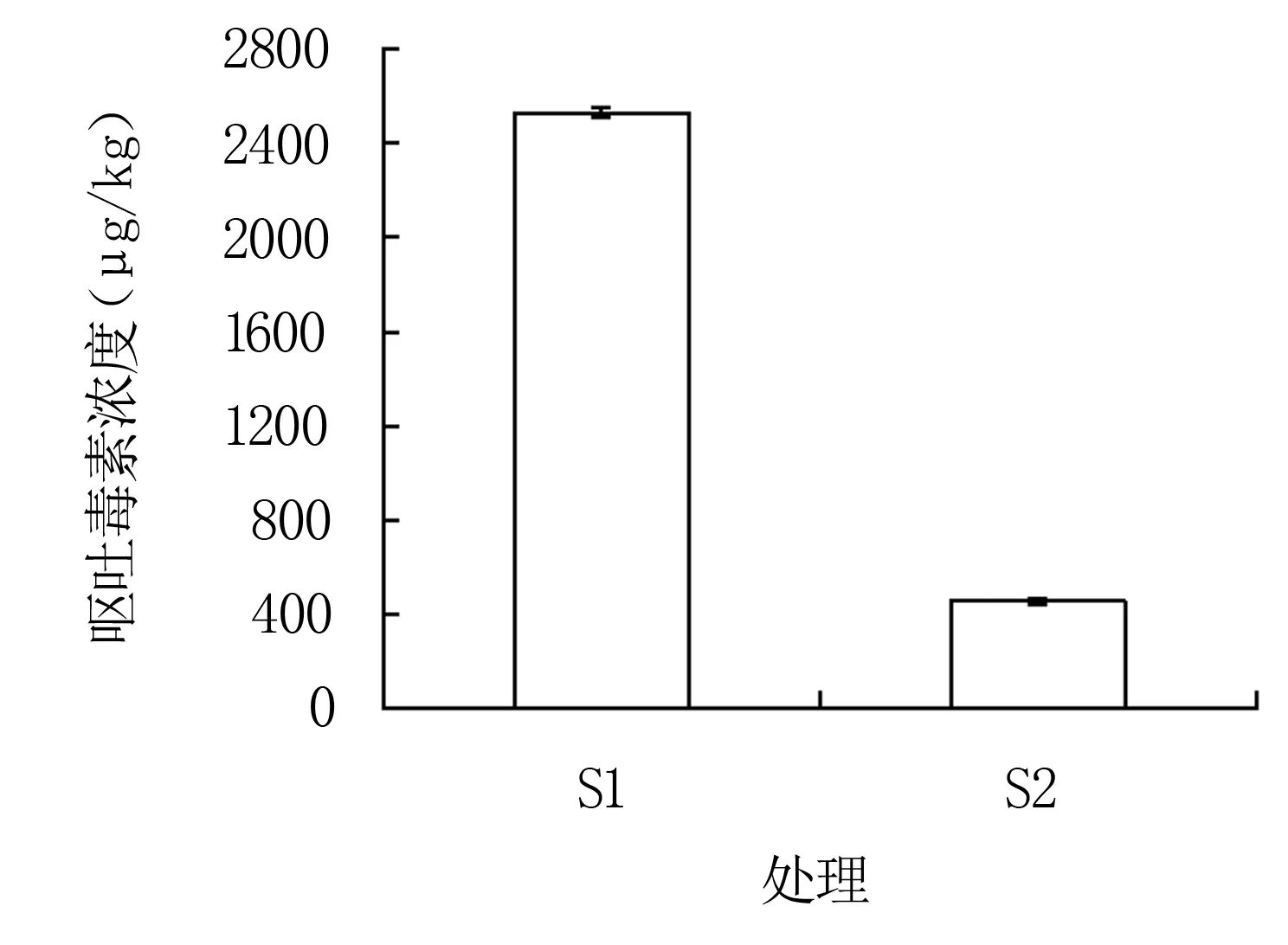
S1: 空白对照; S2: 加入菌株QD36处理的样品。
3 讨论与结论
被呕吐毒素污染的小麦、玉米等粮食和饲料严重危害人和动物健康。由于物理、化学处理方法有多种缺点,因此生物法去除呕吐毒素越来越受到研究人员的重视。梁含等[13]筛选了3株呕吐毒素降解菌,分别是解淀粉芽孢杆菌、枯草芽孢杆菌、植物乳酸菌,其中枯草芽孢杆菌和植物乳酸菌组合对麸皮发酵处理可降解71%的呕吐毒素。李晓凤等[14]从土壤中筛选了一株肠杆菌,可降解40.4%的呕吐毒素。谭剑等[9]筛选到一株枯草芽孢杆菌,该菌发酵液可降解玉米浆中80%的呕吐毒素。余祖华等[15]筛选到一株蜡样芽孢杆菌,可降解饲料中82.68%的呕吐毒素。付苗苗等[16]从土壤中筛选到一株脓杆菌,可降解64.6%的呕吐毒素,起降解作用的物质主要存在于发酵上清液中。
本研究通过初筛和复筛从青岛小麦地土壤中筛选到多株降解呕吐毒素的菌株,其中菌株QD36具有较强的降解能力,可降解84.6%的呕吐毒素,相对于已报道的多株降解菌株,该菌降解效率较高;结合生理生化特征和16S rRNA基因测序结果,菌株QD36鉴定为暹罗芽孢杆菌(Bacillussiamensis)。该菌株对呕吐毒素降解的活性物质主要存在于上清液中,具有很好的应用潜力。本研究为去除粮食和饲料中的呕吐毒素提供了菌种资源。
